名校
1 . 常温下,CaF2、BaF2的沉淀溶解曲线如图所示。下列叙述错误的是
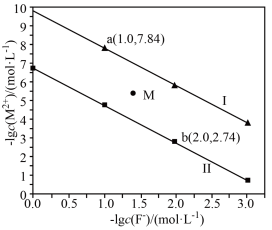
已知:CaF2的溶解度小于BaF2,M代表Ba或Ca

已知:CaF2的溶解度小于BaF2,M代表Ba或Ca
A.曲线Ⅰ代表 与−lgc(F⁻)的关系 与−lgc(F⁻)的关系 |
| B.M点对应的溶液是CaF2的不饱和溶液 |
| C.常温下,Ksp(BaF2)=10-6.74 |
D.BaF2(s)+Ca2+(aq) CaF2(s)+Ba2+(aq)的平衡常数K为103.1 CaF2(s)+Ba2+(aq)的平衡常数K为103.1 |
您最近一年使用:0次
2023-11-20更新
|
458次组卷
|
2卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
解题方法
2 . 下列实验装置或操作能达到实验目的的是
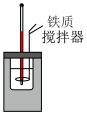 | 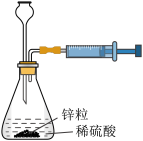 |
| A.测定中和反应的反应热 | B.测定锌与稀硫酸反应的反应速率 |
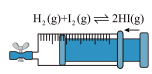 | 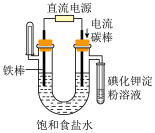 |
| C.探究压强对平衡的影响 | D.验证NaCl溶液(含酚酞)电解产物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-11更新
|
333次组卷
|
3卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
解题方法
3 . 隔膜电解法制备 K2FeO4的工作原理如下图所示。下列说法正确的是

| A.隔膜为阴离子交换膜 |
| B.该方法中KOH可以循环使用,但需另外补充 |
C.Fe电极上的反应为:Fe - 6e- 4H2O = FeO 8H+ 8H+ |
| D.电路中每转移0.2mol e-,Pt 电极上理论上产生 2.24L气体 |
您最近一年使用:0次
2023-11-11更新
|
355次组卷
|
2卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
解题方法
4 . 下列有关说法不正确 的是
| A.25℃,用pH试纸测得某氯水的pH为5 |
B.任何温度下,利用 和 和 浓度的相对大小均可判断溶液的酸碱性 浓度的相对大小均可判断溶液的酸碱性 |
C.25℃, 的NaOH溶液,由水电离出的 的NaOH溶液,由水电离出的 |
D. 的醋酸溶液与 的醋酸溶液与 的盐酸等体积混合,混合液的 的盐酸等体积混合,混合液的 |
您最近一年使用:0次
2023-11-10更新
|
244次组卷
|
3卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
解题方法
5 . 电化学原理在工农业生产中有重要应用。已知N2H4是一种重要的清洁高能燃料,产物无污染。根据如图所示装置回答下列问题(C1~C6均为石墨电极,假设各装置在工作过程中溶液体积不变)

(1)甲装置C2电极为___________ 极,C1电极上的电极反应为 ___________
(2)装置中Ag电极上的电极反应为___________ ,若乙装置中溶液体积为400mL,开始时溶液pH为6,当电极上通过0.04mol电子时溶液pH约为___________ 。
(3)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,膜X为___________ (填“阳离子”“阴离子”或“质子”)交换膜,当电极上通过0.04mol电子时,中间硫酸钠废水的质量改变___________ g(假定水分子不能通过膜X和膜Y)。
(4)电解一段时间后,丁装置中能观察到的现象是___________ ,丁装置中电解反应的总化学方程式为___________ 。

(1)甲装置C2电极为
(2)装置中Ag电极上的电极反应为
(3)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,膜X为
(4)电解一段时间后,丁装置中能观察到的现象是
您最近一年使用:0次
2023-11-07更新
|
602次组卷
|
4卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
解题方法
6 . 标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下,已知 (g)和
(g)和 (g)的相对能量为0,下列说法不正确的是
(g)的相对能量为0,下列说法不正确的是

 (g)和
(g)和 (g)的相对能量为0,下列说法不正确的是
(g)的相对能量为0,下列说法不正确的是
A.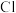 (g)在历程Ⅱ中作催化剂 (g)在历程Ⅱ中作催化剂 |
B.相同条件下, 的平衡转化率:历程Ⅱ>历程I 的平衡转化率:历程Ⅱ>历程I |
C.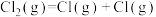 的 的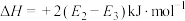 |
D.历程I、历程Ⅱ中速率最快的一步反应的热化学方程式为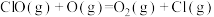  |
您最近一年使用:0次
2023-11-05更新
|
154次组卷
|
4卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
解题方法
7 . 许多生活智慧都蕴含化学原理。下列保存食物的方法体现了“温度影响化学反应速率”的是
| A.干燥保存 | B.加盐腌制 | C.置于冰箱 | D.真空密封 |
您最近一年使用:0次
2023-10-22更新
|
635次组卷
|
7卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
名校
8 . 对于反应2A(g)+4B(g) 5C(s)+3D(g)来说,下列反应速率中最快的是
5C(s)+3D(g)来说,下列反应速率中最快的是
 5C(s)+3D(g)来说,下列反应速率中最快的是
5C(s)+3D(g)来说,下列反应速率中最快的是| A.v(A)=0.006mol•L-1•s-1 | B.v(B)=0.6mol•L-1•min-1 |
| C.v(C)=0.8mol•L-1•min-1 | D.v(D)=0.5mol•L-1•min-1 |
您最近一年使用:0次
2023-10-17更新
|
567次组卷
|
3卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
9 . 根据下图判断,下列说法正确的是
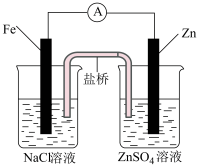 | 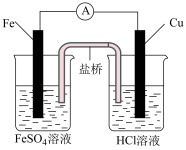 |
| Ⅰ | Ⅱ |
A.装置Ⅰ和装置Ⅱ中负极反应均是 |
B.装置Ⅰ和装置Ⅱ中正极反应均是 |
| C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动 |
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的 均增大 均增大 |
您最近一年使用:0次
2023-10-11更新
|
273次组卷
|
25卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)
重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)重庆市巫山县官渡中学2021-2022学年高二下学期期末考试化学试题(已下线)2012届河南省郑州市高三第一次质量预测化学试卷2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷福建省泉州市泉港区第一中学2017-2018学年高二上学期期中考试化学试题人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第一节 原电池 教材帮福建省莆田第二中学2020-2021学年高二上学期期中考试化学试题广西壮族自治区贺州市2021-2022学年高二上学期期末考试化学试题山东省德州市2020-2021学年高二上学期反应原理月考(A)化学试题河北省邯郸市魏县旭日中学2021-2022学年高二上学期期中考试化学试题山东省青岛第二中学2020-2021学年高二上学期期中考试化学试题山东省青岛第二中学2021-2022学年高二上学期10月月考化学试题(已下线)2015届辽宁省大连二十中高三上学期期中化学试卷2016届湖南省浏阳市第一中学高三上学期第二次月考化学试卷2016届广西钦州港经济技术开发区中学高三上学期第二次月考化学试卷2016届山东省菏泽市高三上学期期末考试化学试卷(已下线)2018年9月13日 《每日一题》一轮复习-原电池工作原理以及正、负极的判定(已下线)考点09 原电池原理及其应用——备战2019年浙江新高考化学考点(已下线)2019年9月12日《每日一题》2020年一轮复习—— 原电池工作原理以及正、负极的判定(已下线)考点09 原电池及化学电源——《备战2020年高考精选考点专项突破题集》(已下线)第20讲 原电池 化学电源(精练)-2021年高考化学一轮复习讲练测四川省绵阳市南山中学2021届高三下学期3月月考试题化学试题(已下线)第16讲 原电池 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第16讲 原电池 新型电源 (练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省牡丹江市阳明区2022-2023学年高三上学期第四次阶段考试化学试题
名校
10 . 清洁能源的综合利用是实现“碳中和、碳达峰”的重要途径。
(1)以环已烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。芳构化反应: (g)→
(g)→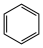 (g)+3H2(g) △H=
(g)+3H2(g) △H=___________ 。

(2)H2和CO2合成乙醇反应为:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)。将等物质的量的CO2和H2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的关系如图乙。
C2H5OH(g)+3H2O(g)。将等物质的量的CO2和H2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的关系如图乙。
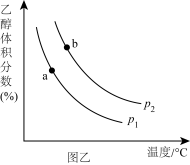
①压强p1___________ p2 (填“>”“=”或“<”,下同);a、b两点的平衡常数Ka___________ Kb。
②已知Arrhenius经验公式为Rlnk=-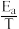 +C [ Ea为活化能,k为速率常数,R和C为常数],为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。在m催化剂作用下,该反应的活化能Ea=
+C [ Ea为活化能,k为速率常数,R和C为常数],为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。在m催化剂作用下,该反应的活化能Ea=___________ J/ mol。从图中信息获知催化效能较高的催化剂是___________ (填“m”或“n”)。

(3)H2和CO合成甲烷反应为:2CO(g)+2H2(g) CH4(g)+CO2(g)。T℃将等物质的量CO和H2充入恒压(200kPa)的密闭容器中。已知逆反应速率v逆=k逆p(CH4)·p(CO2),其中p为分压,该温度下k逆=5.0×10-4kPa·s-1,反应达平衡时测得v正=0.3125 kPa·s-1。CO的平衡转化率为
CH4(g)+CO2(g)。T℃将等物质的量CO和H2充入恒压(200kPa)的密闭容器中。已知逆反应速率v逆=k逆p(CH4)·p(CO2),其中p为分压,该温度下k逆=5.0×10-4kPa·s-1,反应达平衡时测得v正=0.3125 kPa·s-1。CO的平衡转化率为___________ ,该温度下反应的Kp=___________ (用组分的分压计算的平衡常数)。
(1)以环已烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。芳构化反应:
 (g)→
(g)→ (g)+3H2(g) △H=
(g)+3H2(g) △H=
(2)H2和CO2合成乙醇反应为:2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g)。将等物质的量的CO2和H2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的关系如图乙。
C2H5OH(g)+3H2O(g)。将等物质的量的CO2和H2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的关系如图乙。
①压强p1
②已知Arrhenius经验公式为Rlnk=-
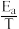 +C [ Ea为活化能,k为速率常数,R和C为常数],为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。在m催化剂作用下,该反应的活化能Ea=
+C [ Ea为活化能,k为速率常数,R和C为常数],为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。在m催化剂作用下,该反应的活化能Ea=
(3)H2和CO合成甲烷反应为:2CO(g)+2H2(g)
 CH4(g)+CO2(g)。T℃将等物质的量CO和H2充入恒压(200kPa)的密闭容器中。已知逆反应速率v逆=k逆p(CH4)·p(CO2),其中p为分压,该温度下k逆=5.0×10-4kPa·s-1,反应达平衡时测得v正=0.3125 kPa·s-1。CO的平衡转化率为
CH4(g)+CO2(g)。T℃将等物质的量CO和H2充入恒压(200kPa)的密闭容器中。已知逆反应速率v逆=k逆p(CH4)·p(CO2),其中p为分压,该温度下k逆=5.0×10-4kPa·s-1,反应达平衡时测得v正=0.3125 kPa·s-1。CO的平衡转化率为
您最近一年使用:0次
2023-10-04更新
|
542次组卷
|
3卷引用:重庆市育才中学校2023-2024学年高二上学期三校联考模拟考化学试题(平行班)



