1 . 一定条件下,密闭容器中发生反应: ,其平均反应速率
,其平均反应速率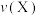 如下,其中反应速率最大的是
如下,其中反应速率最大的是
 ,其平均反应速率
,其平均反应速率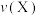 如下,其中反应速率最大的是
如下,其中反应速率最大的是A.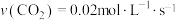 | B. |
C. | D. |
您最近一年使用:0次
2024-08-21更新
|
347次组卷
|
2卷引用:重庆十八中两江实验中学2023-2024学年高二上学期期中质量监测化学试题
2 . 在一密闭容器中的一定量混合气体发生反应: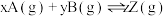 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,A的浓度为0.30mol/L。下列有关判断正确的是
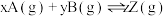 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,A的浓度为0.30mol/L。下列有关判断正确的是A.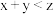 | B.平衡常数增大 |
| C.物质B的转化率降低 | D.物质Z的体积分数增大 |
您最近一年使用:0次
2024-08-19更新
|
313次组卷
|
2卷引用:重庆十八中两江实验中学2023-2024学年高二上学期期中质量监测化学试题
解题方法
3 . 反应
 ,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是

 ,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是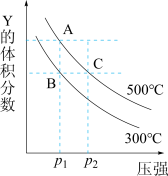
A.该反应的 |
B.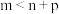 |
C.A、B、C两点化学平衡常数: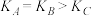 |
D.A、C两点的反应速率 |
您最近一年使用:0次
4 . 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下。_______ (填“M”或“N”)。
(2)已知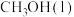 的燃烧热
的燃烧热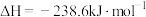 ,
,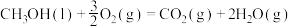 ,
,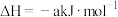 ,则a
,则a_______ 238.6(填“>”,“<”或“=”)。16g的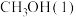 完全燃烧完,转移的电子数目为:
完全燃烧完,转移的电子数目为:_______ ,放出_______ kJ的热量。
(3)已知: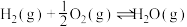
 ,该反应逆反应的活化能为
,该反应逆反应的活化能为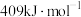 ,则其反应的活化能为
,则其反应的活化能为_______ 。
(4)1.5mol甲烷燃烧时,生成液态水和二氧化碳,同时放出1335.45kJ的热量,写出甲烷燃烧的热化学方程式_______ 。
(5)已知存在下列热化学方程式:
①氢气燃烧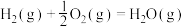
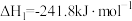
②太阳光分解水制氢气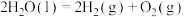
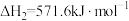
③液态水转化为水蒸气

_______ 
回答下列问题:
a.从能量转化角度分析,反应①为_______ 反应(填“吸热”或“放热”)。
b.若在反应②中使用催化剂,
_______ (填“增大”“减小”或“不变”)。
c.写出表示氢气燃烧热的热化学方程式:_______ 。
(1)有机物M经过太阳光光照可转化成N,转化过程如下。

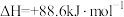
(2)已知
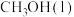 的燃烧热
的燃烧热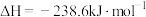 ,
,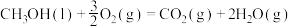 ,
,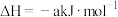 ,则a
,则a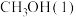 完全燃烧完,转移的电子数目为:
完全燃烧完,转移的电子数目为:(3)已知:
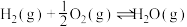
 ,该反应逆反应的活化能为
,该反应逆反应的活化能为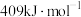 ,则其反应的活化能为
,则其反应的活化能为(4)1.5mol甲烷燃烧时,生成液态水和二氧化碳,同时放出1335.45kJ的热量,写出甲烷燃烧的热化学方程式
(5)已知存在下列热化学方程式:
①氢气燃烧
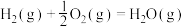
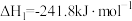
②太阳光分解水制氢气
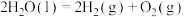
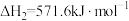
③液态水转化为水蒸气



回答下列问题:
a.从能量转化角度分析,反应①为
b.若在反应②中使用催化剂,

c.写出表示氢气燃烧热的热化学方程式:
您最近一年使用:0次
解题方法
5 . Ⅰ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)通过实验①和②,可探究出_______ (填外部因素)的改变对化学反应速率的影响,其中
_______ 、
_______ ;通过实验_______ (填实验序号)可探究出温度变化对化学反应速率的影响,其中
_______ 。
(2)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是_______ 。
(3)写出 H2C2O4溶液和酸性KMnO4溶液的反应的化学反应方程式:_______ 。
(4)忽略溶液体积的变化,利用实验②中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率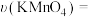
_______ 。
Ⅱ.某同学用等质量的锌粉先后与过量的盐酸和同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如图所示)。_______ 1mol/L(填“>”“<”或“=”),若用1mol/L硫酸代替上述实验中的1mol/L盐酸,二者的反应速率_______ 相同(填“是”或“不”)。
(6)为控制反应速率,防止因反应过快而难以测量H2体积,且不改变生成H2的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是_______。
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
|
|
|
|
| |||
① | 298 | 2 | 0.02 | 4 | 0.1 | 0 |
|
② |
| 2 | 0.02 |
| 0.1 | 1 | 8 |
③ | 313 | 2 | 0.02 | 3 | 0.1 |
|
|
(1)通过实验①和②,可探究出



(2)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是(3)写出 H2C2O4溶液和酸性KMnO4溶液的反应的化学反应方程式:
(4)忽略溶液体积的变化,利用实验②中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率
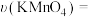
Ⅱ.某同学用等质量的锌粉先后与过量的盐酸和同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如图所示)。
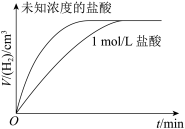
(6)为控制反应速率,防止因反应过快而难以测量H2体积,且不改变生成H2的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是_______。
| A.蒸馏水 | B.KCl溶液 | C.KNO3溶液 | D.CuSO4溶液 |
您最近一年使用:0次
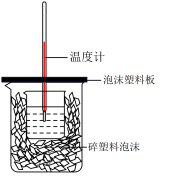
6 . 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验。_______ 。
(2)该装置中缺少的一种玻璃仪器是_______ ,装置中还存在的错误有_______ ;大烧杯杯口若不盖泡沫塑料板,测得中和热的数值将_______ (填“偏大”、“偏小”或“无影响”)。
(3)实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热_______ (填“相等”或“不相等”)。
(4)现将一定量的稀氢氧化钾溶液、稀氢氧化钙、稀氨水分别和1L1mol/L的稀盐酸恰好完全反应,其反应热分别为 、
、 、
、 ,则为
,则为 、
、 、
、 的大小关系
的大小关系_______ 。
(5)下列说法正确的是_______ (填字母)。
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成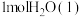 时所测得的中和反应的反应热(
时所测得的中和反应的反应热( )有影响,
)有影响, 会偏大
会偏大
(6)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如表原始数据:
已知盐酸、NaOH溶液密度均近似为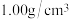 ,中和后混合液的比热容
,中和后混合液的比热容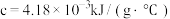 ,则该反应的中和热
,则该反应的中和热
_______ 。(保留到小数点后1位)
(2)该装置中缺少的一种玻璃仪器是
(3)实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
(4)现将一定量的稀氢氧化钾溶液、稀氢氧化钙、稀氨水分别和1L1mol/L的稀盐酸恰好完全反应,其反应热分别为
 、
、 、
、 ,则为
,则为 、
、 、
、 的大小关系
的大小关系(5)下列说法正确的是
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成
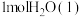 时所测得的中和反应的反应热(
时所测得的中和反应的反应热( )有影响,
)有影响, 会偏大
会偏大(6)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如表原始数据:
实验序号 | 起始温度 | 终止温度 | 温差 | ||
盐酸 |
| 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
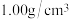 ,中和后混合液的比热容
,中和后混合液的比热容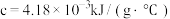 ,则该反应的中和热
,则该反应的中和热
您最近一年使用:0次
7 . 下列事实能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用适当过量的氧气,以提高 的转化率 的转化率 |
B.反应 达平衡后,对容器进行压缩,气体颜色变深 达平衡后,对容器进行压缩,气体颜色变深 |
C.加入 可以加快 可以加快 的分解速率 的分解速率 |
| D.工业合成氨采用高温条件 |
您最近一年使用:0次
解题方法
8 . 已知
 。在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是
。在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是

 。在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是
。在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是A.单位时间内消耗nmol的NO同时消耗nmol的 |
| B.体系中混合气体密度不变 |
| C.混合气体的平均相对分子质量不变 |
D.体系中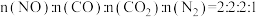 |
您最近一年使用:0次
9 . 氢气可通过下列反应制得:
 ,为了提高一氧化碳在平衡体系中的转化率,可采取的措施是
,为了提高一氧化碳在平衡体系中的转化率,可采取的措施是

 ,为了提高一氧化碳在平衡体系中的转化率,可采取的措施是
,为了提高一氧化碳在平衡体系中的转化率,可采取的措施是| A.减小压强 | B.降低温度 |
| C.更换更高效催化剂 | D.增大CO的浓度 |
您最近一年使用:0次
10 . 下列反应属于非氧化还原反应,且能量变化与图示能量相符合的是
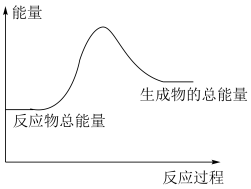
A. 与稀 与稀 反应 反应 |
| B.铝热反应 |
C.灼热的炭与 反应 反应 |
D. 晶体和 晶体和 晶体的反应 晶体的反应 |
您最近一年使用:0次


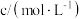





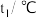
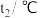
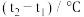
 溶液
溶液

