真题
1 . 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为_______ ,装置B的作用为_______ 。 反应的探究如下:
反应的探究如下:_______ ;产生的气体为_______ 。比较实验①和②,从氧化还原角度说明 的作用是
的作用是_______ 。
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,mgX完全分解为ng黑色氧化物Y,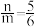 。X的化学式为
。X的化学式为_______ 。
(4)取含X粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用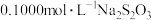 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00mL。(已知:
标准溶液15.00mL。(已知: ,
, )标志滴定终点的现象是
)标志滴定终点的现象是_______ ,粗品中X的相对含量为_______ 。
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为

 反应的探究如下:
反应的探究如下:
 的作用是
的作用是(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,mgX完全分解为ng黑色氧化物Y,
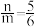 。X的化学式为
。X的化学式为(4)取含X粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用
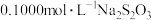 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液15.00mL。(已知:
标准溶液15.00mL。(已知: ,
, )标志滴定终点的现象是
)标志滴定终点的现象是
您最近一年使用:0次
2023-06-14更新
|
8267次组卷
|
18卷引用:2023年高考湖北卷化学真题
2023年高考湖北卷化学真题(已下线)专题19 实验综合题(已下线)T18-实验题(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)第13讲氮及其化合物(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题(已下线)题型二 实验中常考滴定计算-备战2024年高考化学答题技巧与模板构建(已下线)第03讲 物质的量在化学方程式计算中的应用(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)专题12 化学实验综合题-【好题汇编】3年(2022-2024)高考1年模拟化学真题分类汇编(湖北专用)(已下线)暑假作业18 化学实验综合题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)(已下线)第04讲 金属材料及金属矿物的开发利用(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)专题16 化学实验综合题-备战2025年高考化学真题题源解密(新高考通用)
真题
2 . 回答下列问题:
(1)两种有机物的相关数据如表:
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是______ 。
(2)四种晶体的熔点数据如表:
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是______ 。
(1)两种有机物的相关数据如表:
| 物质 | HCON(CH3)2 | HCONH2 |
| 相对分子质量 | 73 | 45 |
| 沸点/℃ | 153 | 220 |
(2)四种晶体的熔点数据如表:
| 物质 | CF4 | SiF4 | BF3 | AlF3 |
| 熔点/℃ | -183 | -90 | -127 | >1000 |
您最近一年使用:0次
2022-01-12更新
|
4811次组卷
|
5卷引用:2022 年1月浙江省普通高校招生选考科目考试化学试题
2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)2022年浙江1月高考真题变式题(26-31)海南省五指山中学2021-2022学年高二下学期期中考试化学试题(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
真题
解题方法
3 . 回答下列问题:
(1)乙醇的挥发性比水的强,原因是_______ 。
(2)金属氢化物是应用广泛的还原剂。KH的还原性比NaH的强,原因是_______ 。
(1)乙醇的挥发性比水的强,原因是
(2)金属氢化物是应用广泛的还原剂。KH的还原性比NaH的强,原因是
您最近一年使用:0次
4 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图甲所示:
第一步: 2NH3(g)+CO2(g) NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1
第二步:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
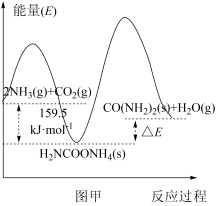
①图中ΔE=_______ kJ/mol。
②反应速率较快的是_______ 反应(填“第一步”或“第二步”),理由是_______ 。
II.以CO2和CH4催化重整制备合成气: CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g) 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
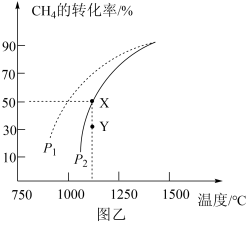
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填序号)。
A容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正 (H2) D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,压强P1_______ P2 (填“>”“<”或“=”,下同); Y点速率v正_______ v逆。
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=_______ (用含P2的代数式表示)。
III. 电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:
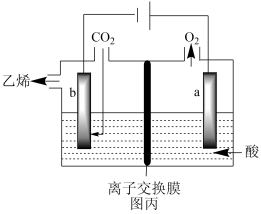
(4)阴极电极反应式为_______ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。
CO(NH2)2(s)+H2O(g) ∆H= -87 kJ/mol。(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
第一步: 2NH3(g)+CO2(g)
 NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1第二步:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
①图中ΔE=
②反应速率较快的是
II.以CO2和CH4催化重整制备合成气: CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2 (g)
 2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO (g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正 (H2) D.同时断裂2molC- H键和1 molH-H键
②由图乙可知,压强P1
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=
III. 电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

(4)阴极电极反应式为
您最近一年使用:0次
2022-05-12更新
|
3161次组卷
|
3卷引用:四川省南充市2022届高三适应性考试(三诊)理综化学试题
5 . 萤石( )与浓硫酸共热可制备HF气体,写出该反应的化学方程式:
)与浓硫酸共热可制备HF气体,写出该反应的化学方程式:_______ ,该反应中体现浓硫酸的性质是_______ 。
A.强氧化性 B.难挥发性 C.吸水性 D.脱水性
 )与浓硫酸共热可制备HF气体,写出该反应的化学方程式:
)与浓硫酸共热可制备HF气体,写出该反应的化学方程式:A.强氧化性 B.难挥发性 C.吸水性 D.脱水性
您最近一年使用:0次
6 . 化学反应的速率与限度在社会生产、生活和科学研究中具有广泛的应用,对人类文明的进步和现代化建设具有重大的价值,与我们每个人息息相关。恒温条件下,在5L恒容密闭容器内充入1.5molX(g)与2.0molY(g),反应10min后达到平衡,此时X的物质的量减少1mol,Y的物质的量浓度为 ,0~10min内,生成Z的平均反应速率为
,0~10min内,生成Z的平均反应速率为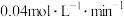 。请回答下列问题:
。请回答下列问题:
(1)该反应的化学方程式为__________________ 。
(2)0~10min内,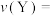
______ 
(3)反应达到平衡状态时,X、Y的转化率分别为______ (保留三位有效数字)。
(4)若改变下列一个条件,推测该反应的速率变化(填“增大”、“减小”或“不变”):
①将容器的体积扩大为10L,化学反应速率______ 。
②充入1mol氦气,化学反应速率______ 。
(5)下列说法能判断该反应达到平衡状态的是______(填标号)。
 ,0~10min内,生成Z的平均反应速率为
,0~10min内,生成Z的平均反应速率为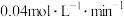 。请回答下列问题:
。请回答下列问题:(1)该反应的化学方程式为
(2)0~10min内,
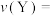

(3)反应达到平衡状态时,X、Y的转化率分别为
(4)若改变下列一个条件,推测该反应的速率变化(填“增大”、“减小”或“不变”):
①将容器的体积扩大为10L,化学反应速率
②充入1mol氦气,化学反应速率
(5)下列说法能判断该反应达到平衡状态的是______(填标号)。
| A.容器内混合气体的平均相对分子质量不变 |
B. |
| C.容器内混合气体的压强不变 |
| D.容器内混合气体的密度不变 |
您最近一年使用:0次
2023-03-31更新
|
1810次组卷
|
5卷引用:广东省部分名校2022-2023学年高一下学期3月大联考化学试题
广东省部分名校2022-2023学年高一下学期3月大联考化学试题(已下线)期中模拟题(二)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册) 宁夏回族自治区银川一中2022-2023学年高一下学期期中考试化学试题(已下线)期末模拟题(一)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)青海省西宁市第十四中学2023-2024学年高一下学期6月月考化学试卷
真题
解题方法
7 . (1)已知3种原子晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是_______ 。
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是_______ 。
| 金刚石 | 碳化硅 | 晶体硅 | |
| 熔点/℃ | >3550 | 2600 | 1415 |
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是
您最近一年使用:0次
2021-06-15更新
|
3797次组卷
|
9卷引用:2021年6月新高考浙江化学高考真题
2021年6月新高考浙江化学高考真题(已下线)考点08 分子间作用力 氢键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题08.微粒间相互作用力-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年6月浙江高考化学试题变式题26-31(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
8 . 化合物X是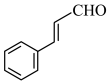 的同分异构体,可发生银镜反应,与酸性高锰酸钾反应后可以得到对苯二甲酸,写出X的结构简式
的同分异构体,可发生银镜反应,与酸性高锰酸钾反应后可以得到对苯二甲酸,写出X的结构简式_______ 。
 的同分异构体,可发生银镜反应,与酸性高锰酸钾反应后可以得到对苯二甲酸,写出X的结构简式
的同分异构体,可发生银镜反应,与酸性高锰酸钾反应后可以得到对苯二甲酸,写出X的结构简式
您最近一年使用:0次
2023-01-21更新
|
1768次组卷
|
5卷引用:突破超重点 有机化学基础 超重点8 “有序思维”突破有机物同分异构难题
突破超重点 有机化学基础 超重点8 “有序思维”突破有机物同分异构难题(已下线)专题31 同分异构体的书写及数目判断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)04 常考题空4 有限制条件同分异构体的书写 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型12 有机物同分异构体的推断、书写-高考必备50个题型(已下线)题型二 限制条件同分异构体的书写-备战2024年高考化学答题技巧与模板构建
名校
9 . 二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①

②
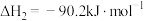
③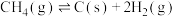
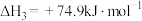
④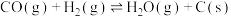
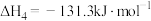
回答下列问题:
(1)
_______ ,反应①_______ 正向自发进行(填标号)。
A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为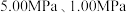 和
和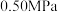 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为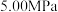 的曲线是
的曲线是_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是_______ 。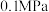 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是_______ 。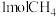 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为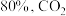 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为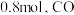 的物质的量为
的物质的量为_______  ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数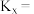
_______ (结果保留两位小数)。
上述平衡时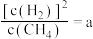 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,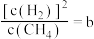 ,则a
,则a_______ b(填“>”“<”或“=”)。(已知反应 的
的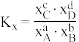 ,物质
,物质 的摩尔分数
的摩尔分数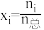 )
)
①


②

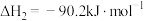
③
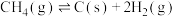
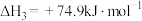
④
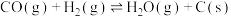
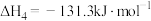
回答下列问题:
(1)

A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为
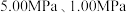 和
和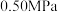 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为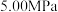 的曲线是
的曲线是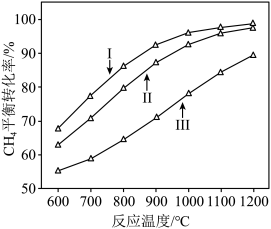
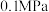 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是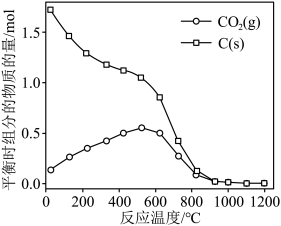
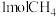 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为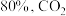 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为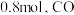 的物质的量为
的物质的量为 ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数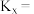
上述平衡时
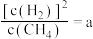 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,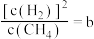 ,则a
,则a 的
的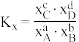 ,物质
,物质 的摩尔分数
的摩尔分数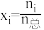 )
)
您最近一年使用:0次
2024-01-20更新
|
1226次组卷
|
4卷引用:2024年1月河南普通高等学校招生考试适应性测试化学试题
2024年1月河南普通高等学校招生考试适应性测试化学试题(已下线)T29-原理综合题(已下线)2024年1月“九省联考”河南卷真题完全解读与考后提升湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题
2023高三上·全国·专题练习
名校
解题方法
10 . 信息型氧化还原反应方程式的书写:
(1)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_______ 。
(2)滤液(含Fe2+和H+)加入H2O2氧化时发生反应的离子方程式为_______ 。
(3)在稀硫酸中,Z(Cr)的最高价含氧酸的钾盐(橙色)氧化M(O)的一种氢化物,Z(Cr)被还原为+3价,该反应的化学方程式是_______ 。
(4)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO 将NO2转化为NO
将NO2转化为NO ,其离子方程式为
,其离子方程式为_______ 。
(5)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是_______ 。
(6)KClO3可用于实验室制O2 ,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,写出该反应的化学方程式:_______ 。
(7)某地污水中的有机污染物主要成分是三氯乙烯(C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式:_______ 。
(1)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为
(2)滤液(含Fe2+和H+)加入H2O2氧化时发生反应的离子方程式为
(3)在稀硫酸中,Z(Cr)的最高价含氧酸的钾盐(橙色)氧化M(O)的一种氢化物,Z(Cr)被还原为+3价,该反应的化学方程式是
(4)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO
 将NO2转化为NO
将NO2转化为NO ,其离子方程式为
,其离子方程式为(5)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是
(6)KClO3可用于实验室制O2 ,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1,写出该反应的化学方程式:
(7)某地污水中的有机污染物主要成分是三氯乙烯(C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式:
您最近一年使用:0次



