名校
解题方法
1 . 氮元素的单质及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
I.一定条件下,在2 L密闭容器中发生反应:3A(g) + B(g) 2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。
2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。
(1)用A的浓度变化表示反应的平均速率:___________ 。
(2)在2 min末,B的浓度为___________ 。
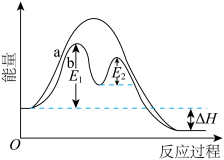
II.某反应过程的能量变化如下图所示。
(3)反应过程___________ (填“a”或“b”)有催化剂参与。
(4)①该反应为___________ 反应(填“放热”或“吸热”)。
②已知:
反应i:
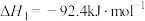
反应ii:
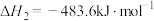
则氨气完全燃烧生成氮气和水蒸气的热化学方程式为___________ 。
III.已知反应i断开化学键所需的能量如下表。
(5)则断开 N—H键所需的能量是
N—H键所需的能量是___________ 。
I.一定条件下,在2 L密闭容器中发生反应:3A(g) + B(g)
 2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。
2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。(1)用A的浓度变化表示反应的平均速率:
(2)在2 min末,B的浓度为
II.某反应过程的能量变化如下图所示。
(3)反应过程
(4)①该反应为
②已知:
反应i:

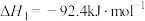
反应ii:

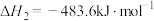
则氨气完全燃烧生成氮气和水蒸气的热化学方程式为
III.已知反应i断开化学键所需的能量如下表。
| 化学键 |  | H—H | N—H |
键能/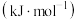 | 945 | 436 | ? |
(5)则断开
 N—H键所需的能量是
N—H键所需的能量是
您最近一年使用:0次
解题方法
2 . 根据题意回答下列问题。
(1)下列属于放热反应的是___________ 。
① 与
与 反应
反应
② 溶于水
溶于水
③
④碳与水蒸气反应
⑤ 与
与 反应
反应
(2)用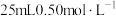 硫酸与
硫酸与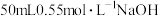 溶液在如图所示的装置中进行中和热的测定。
溶液在如图所示的装置中进行中和热的测定。
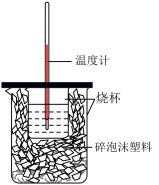
①从实验装置上看,图中尚缺少的一种玻璃仪器是___________ 。
②通过测定,计算出产生的热量为1.42kJ,请写出该反应的中和热的热化学方程式___________ 。
③若用相同浓度和体积的氨水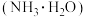 代替NaOH溶液进行上述实验,测得的中和热的数值会
代替NaOH溶液进行上述实验,测得的中和热的数值会___________ (填“偏大”“偏小”或“无影响”)
(3)家用液化气的成分之一是丁烷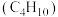 ,当
,当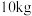 丁烷完全燃烧生成
丁烷完全燃烧生成 和液态水时,放出
和液态水时,放出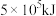 的热量。请写出丁烷燃烧热的热化学反应方程式
的热量。请写出丁烷燃烧热的热化学反应方程式___________ 。
(4)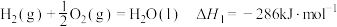
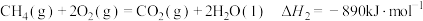
在25℃、101kPa, 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 ,放出热量
,放出热量 的热量。计算该混合气体
的热量。计算该混合气体 和
和 的体积比
的体积比___________ 。
(5)葡萄糖是人体所需能量的重要来源之一,设他在人体组织中完全氧化时的热化学方程式:
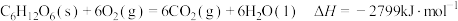 。计算100克葡萄糖在人体组织中完全氧化时产生的热量为
。计算100克葡萄糖在人体组织中完全氧化时产生的热量为___________ 。
(1)下列属于放热反应的是
①
 与
与 反应
反应②
 溶于水
溶于水③

④碳与水蒸气反应
⑤
 与
与 反应
反应(2)用
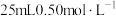 硫酸与
硫酸与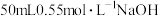 溶液在如图所示的装置中进行中和热的测定。
溶液在如图所示的装置中进行中和热的测定。
①从实验装置上看,图中尚缺少的一种玻璃仪器是
②通过测定,计算出产生的热量为1.42kJ,请写出该反应的中和热的热化学方程式
③若用相同浓度和体积的氨水
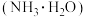 代替NaOH溶液进行上述实验,测得的中和热的数值会
代替NaOH溶液进行上述实验,测得的中和热的数值会(3)家用液化气的成分之一是丁烷
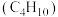 ,当
,当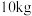 丁烷完全燃烧生成
丁烷完全燃烧生成 和液态水时,放出
和液态水时,放出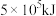 的热量。请写出丁烷燃烧热的热化学反应方程式
的热量。请写出丁烷燃烧热的热化学反应方程式(4)
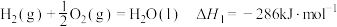
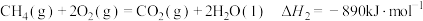
在25℃、101kPa,
 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 ,放出热量
,放出热量 的热量。计算该混合气体
的热量。计算该混合气体 和
和 的体积比
的体积比(5)葡萄糖是人体所需能量的重要来源之一,设他在人体组织中完全氧化时的热化学方程式:
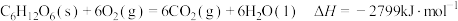 。计算100克葡萄糖在人体组织中完全氧化时产生的热量为
。计算100克葡萄糖在人体组织中完全氧化时产生的热量为
您最近一年使用:0次
3 . 倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示。回答下列问题:
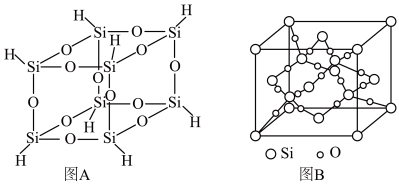
(1)基态Si原子的核外电子排布式为_______ ,其中每对成对电子之间的区别是_______ 。
(2)图A分子结构中,一个硅原子被3个_______ 元环共用,该分子的分子式为_______ 。
(3)图A分子结构中H元素的化合价为_______ ,O原子采用_______ 杂化,形成的极性共价键类型为(电子云重叠方式)_______ ;键的极性:Si-O键_______ Si-H键(填“>”“<”或“=”)。
(4)氢基倍半硅氧烷为_______ 晶体,SiO2为_______ 晶体。
(5)每个SiO2晶胞中含有O原子的个数为_______ ;已知SiO2晶体为面心立方结构,晶胞参数为anm,阿伏加德罗常数的值为NA,则SiO2晶体的密度为_______ g•cm-3。

(1)基态Si原子的核外电子排布式为
(2)图A分子结构中,一个硅原子被3个
(3)图A分子结构中H元素的化合价为
(4)氢基倍半硅氧烷为
(5)每个SiO2晶胞中含有O原子的个数为
您最近一年使用:0次
名校
4 . 在一定温度下,向体积为2L的恒容密闭容器中充入一定量的A、B发生化学反应(除物质D为固体外,其余的物质均为气体),各物质的含量随时间的变化情况如图所示,请回答下列问题:
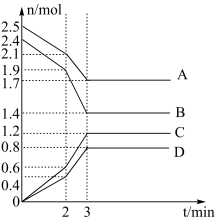
(1)写出该反应的化学方程式:___________ ,0~2min内用C表示的化学反应速率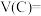
___ 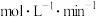 。
。
(2)该反应在2min时改变了某一条件,则该条件可能为___________ 。
(3)下列能说明反应达到平衡的是___________(填标号)。
(4)反应至某时刻,此时压强与初始压强的比值为43:49,则此时B物质的转化率为_________ %(保留三位有效数字),此时该反应________ (填“是”或“否”)达到平衡。

(1)写出该反应的化学方程式:
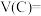
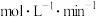 。
。(2)该反应在2min时改变了某一条件,则该条件可能为
(3)下列能说明反应达到平衡的是___________(填标号)。
| A.反应体系内气体的压强不再发生变化 |
| B.反应体系内气体的密度不再发生变化 |
| C.A与C的浓度之比为6:4 |
D.当有 被消耗的同时有 被消耗的同时有 被消耗 被消耗 |
您最近一年使用:0次
2022-07-28更新
|
585次组卷
|
2卷引用:辽宁省营口市普通高中2021-2022学年高一下学期期末化学试题
5 . 某芳香族化合物A为无色片状结晶,易溶于热水。为研究A的组成与结构,进行了如表实验:
| 实验步骤 | 解释或实验结论 |
| I.称取3.4gA升温使其汽化,测其密度约为相同条件下氧气的4.25倍 | 通过计算填空:(1)A的相对分子质量为 |
| II.将此3.4gA在足量纯O2中充分燃烧,只生成8.8gCO2和1.8gH2O | (2)A的分子式为 |
| III.另取A6.8g,与足量的NaHCO3溶液反应,生成1.12LCO2(标准状况) | (3)写出A中含有的官能团的结构简式: |
IV.A的核磁共振氢谱如图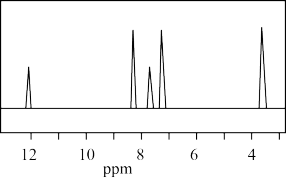 | (4)A中含有 |
| (5)综上所述,A的结构简式为 | |
| (6)写出A与NaHCO3溶液发生反应的化学方程式: | |
您最近一年使用:0次
名校
解题方法
6 . 填空
(1)下列物质中,互为同位素的有_______ ,互为同素异形体的有_______ ,互为同系物的有_______ ,互为同分异构体的有_______ ,属于同种物质有_______ 。
①O2和O3②35Cl和37Cl③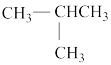 和
和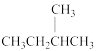 ④
④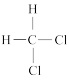 +和
+和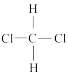 ⑤CH3(CH2)2CH3和(CH3)2CHCH3⑥乙醇和甲醚(CH3OCH3)
⑤CH3(CH2)2CH3和(CH3)2CHCH3⑥乙醇和甲醚(CH3OCH3)
(2)立方烷结构为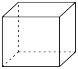 ,它的结构高度对称,其二氯代物有
,它的结构高度对称,其二氯代物有_______ 种。
(3)化合物甲只含C、H两种元素,化合物乙只含C、H、F三种元素,甲、乙都是饱和化合物,且分子中都含有26个电子,据此推断:
①甲的分子式是_______ ;若甲分子中有两个H原子被F原子代替,所得产物可能有_______ 种结构。
②乙是性能优异的环保产品,可替代某些会破坏臭氧层的氟里昂产品,用作制冷剂。已知乙分子中C、H、F原子个数比为1∶2∶2,则下列对于乙的描述正确的是_______
A.其分子空间构型为正四面体 B.碳为sp3杂化
C.具有两种同分异构体 D.没有同分异构体
(1)下列物质中,互为同位素的有
①O2和O3②35Cl和37Cl③
 和
和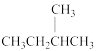 ④
④ +和
+和 ⑤CH3(CH2)2CH3和(CH3)2CHCH3⑥乙醇和甲醚(CH3OCH3)
⑤CH3(CH2)2CH3和(CH3)2CHCH3⑥乙醇和甲醚(CH3OCH3)(2)立方烷结构为
 ,它的结构高度对称,其二氯代物有
,它的结构高度对称,其二氯代物有(3)化合物甲只含C、H两种元素,化合物乙只含C、H、F三种元素,甲、乙都是饱和化合物,且分子中都含有26个电子,据此推断:
①甲的分子式是
②乙是性能优异的环保产品,可替代某些会破坏臭氧层的氟里昂产品,用作制冷剂。已知乙分子中C、H、F原子个数比为1∶2∶2,则下列对于乙的描述正确的是
A.其分子空间构型为正四面体 B.碳为sp3杂化
C.具有两种同分异构体 D.没有同分异构体
您最近一年使用:0次
名校
7 . 将某浓度的NH4HSO4溶液,加入到50mLNaOH溶液中并加热,得气体标况下体积如下表:
(1)等浓度的NH4HSO4与NaOH溶液,体积比为1:2混合并加热的离子方程式______ 。
(2)c(NaOH)=_______ 。
| V(NH4HSO4)/mL | 30 | 60 | 90 | 120 | 150 |
| 产生气体体积/L | 0.672 | 0.896 | 0.224 | 0 | 0 |
(1)等浓度的NH4HSO4与NaOH溶液,体积比为1:2混合并加热的离子方程式
(2)c(NaOH)=
您最近一年使用:0次
名校
解题方法
8 . 恒温恒容下,将2 mol红棕色气体A和1.5 mol无色气体B通入体积为1 L的密闭容器中发生如下反应: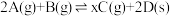 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_______ mol/(L·min)
(2)x=_______ ;A的转化率与B的转化率之比为_______
(3)写出该温度下的平衡常数表达式_______ (用相关字母表示),数值_______
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)_______ v(逆)。(填“>”、“=”或“<”)
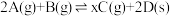 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)写出该温度下的平衡常数表达式
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)
您最近一年使用:0次
2022-06-02更新
|
806次组卷
|
7卷引用:辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题
辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题云南省大理白族自治州民族中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
9 . 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下反应: ,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
,测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3min到9min,v(H2)=___________  。
。
(2)若降低温度,则该反应的正反应速率___________ (填“加快”“减慢”或“不变”。下同),逆反应速率___________ 。
(3)第4min时,正、逆反应速率的大小关系为
___________ (填“>““<”“=”) 。
。
(4)能说明上述反应达到平衡状态的是___________(填字母)。
(5)平衡时CO2的转化率为___________ 。
(6)反应达到平衡,此时体系内压强与开始时的压强之比为___________ 。
 ,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从3min到9min,v(H2)=
 。
。(2)若降低温度,则该反应的正反应速率
(3)第4min时,正、逆反应速率的大小关系为

 。
。(4)能说明上述反应达到平衡状态的是___________(填字母)。
| A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点) |
| B.混合气体中CO2的浓度不再改变 |
| C.单位时间内生成1mol H2,同时生成1mol CH3OH |
| D.混合气体的平均相对分子质量不随时间的变化而变化 |
(6)反应达到平衡,此时体系内压强与开始时的压强之比为
您最近一年使用:0次
2022-04-23更新
|
1001次组卷
|
4卷引用:辽宁省彰武县高级中学2021-2022学年高一下学期第二次月考化学试题
辽宁省彰武县高级中学2021-2022学年高一下学期第二次月考化学试题重庆市名校联盟2021-2022学年高一下学期第一次联合考试化学试题甘肃省张掖市第二中学 2021-2022学年高一下学期期中考试化学试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
名校
解题方法
10 . 氢气既是一种清洁能源,又是重要的化工原料。回答下列问题:
(1)已知:断裂1 molH-H、1 mol O=O、1 molH-O键吸收的能量依次为436 kJ、498 kJ、467 kJ。在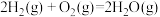 反应中,44.8 LH2 (标准状况)恰好完全反应放出的能量为
反应中,44.8 LH2 (标准状况)恰好完全反应放出的能量为___________ kJ。
(2)实验室用锌粒和稀硫酸反应制备氢气。
①其他条件相同,粗锌制备氢气的速率___________ 纯锌(填“大于”“小于”或“等于”)。
②其他条件相同,相同质量的锌粉和锌粒分别与足量1 mol/L硫酸溶液反应产生氢气的体积与时间的关系如图所示。曲线Ⅱ代表___________ (填“锌粉”或“锌粒”)。

(3)氢氧燃料电池的能量转化率较高,工作原理如图所示。

放电时,负极反应式为___________ ;刚开始放电时,正极附近电解质溶液的pH___________ (填“升高”“降低”或“不变”)。
(4)工业上常利用合成气(H2、CO)合成甲醇,原理为 。一定温度下,向体积为2 L的恒容密闭容器中充入2 mol H2和1 mol CO,在不同催化剂
。一定温度下,向体积为2 L的恒容密闭容器中充入2 mol H2和1 mol CO,在不同催化剂 、
、 作用下反应,测得CH3OH的浓度与时间的关系如图所示。
作用下反应,测得CH3OH的浓度与时间的关系如图所示。
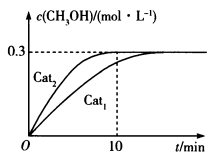
①催化效率:Cat1______ Cat2 (填“>”“<”或“=”)。
②0~10 min内, 作用下用H2表示的平均反应速率v(H2)=
作用下用H2表示的平均反应速率v(H2)=___________ 。
③该温度及Cat2作用下,达到平衡时CO的转化率为___________ (A的平衡转化率 )。
)。
(1)已知:断裂1 molH-H、1 mol O=O、1 molH-O键吸收的能量依次为436 kJ、498 kJ、467 kJ。在
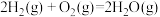 反应中,44.8 LH2 (标准状况)恰好完全反应放出的能量为
反应中,44.8 LH2 (标准状况)恰好完全反应放出的能量为(2)实验室用锌粒和稀硫酸反应制备氢气。
①其他条件相同,粗锌制备氢气的速率
②其他条件相同,相同质量的锌粉和锌粒分别与足量1 mol/L硫酸溶液反应产生氢气的体积与时间的关系如图所示。曲线Ⅱ代表

(3)氢氧燃料电池的能量转化率较高,工作原理如图所示。

放电时,负极反应式为
(4)工业上常利用合成气(H2、CO)合成甲醇,原理为
 。一定温度下,向体积为2 L的恒容密闭容器中充入2 mol H2和1 mol CO,在不同催化剂
。一定温度下,向体积为2 L的恒容密闭容器中充入2 mol H2和1 mol CO,在不同催化剂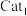 、
、 作用下反应,测得CH3OH的浓度与时间的关系如图所示。
作用下反应,测得CH3OH的浓度与时间的关系如图所示。
①催化效率:Cat1
②0~10 min内,
 作用下用H2表示的平均反应速率v(H2)=
作用下用H2表示的平均反应速率v(H2)=③该温度及Cat2作用下,达到平衡时CO的转化率为
 )。
)。
您最近一年使用:0次
2021-07-21更新
|
843次组卷
|
3卷引用:辽宁省东北师范大学连山实验高中2021-2022学年高一下学期第一次线上考试化学试题



