1 . 铁是一种重要的金属元素,铁的单质及化合物在社会生产、生活和科学研究中应用广泛。回答下列问题:
(1)基态Fe的价层电子排布式为___________ ,其中含有的单电子数为___________ 。
(2)已知 的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则
的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则 的晶体类型为
的晶体类型为___________ ;画出 二聚体的结构式(不要求立体结构):
二聚体的结构式(不要求立体结构):___________ 。
(3)已知反式尖晶石结构晶体的通式为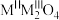 ,属于立方晶系。其晶胞中一半
,属于立方晶系。其晶胞中一半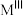 占据所有
占据所有 构成的四面体空隙,
构成的四面体空隙,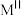 与另外一半
与另外一半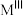 占据所有
占据所有 构成的八面体空隙。
构成的八面体空隙。 晶体为反式尖晶石结构,1个
晶体为反式尖晶石结构,1个 晶胞中,
晶胞中, 堆积共形成四面体空隙和八面体空隙的总和为24,则1个
堆积共形成四面体空隙和八面体空隙的总和为24,则1个 晶胞中
晶胞中 构成的四面体空隙的数目为
构成的四面体空隙的数目为___________ 。
(4)研究储氢材料对解决未来能源问题具有重要意义。某种Mg与Fe形成的储氢材料储氢后的晶胞结构如图所示(H原子位置未标出),晶胞参数(晶胞棱长)为a pm,H原子以正八面体、6配位的配位模式分布在Fe原子的周围,晶胞中每条棱上有2个H原子,H原子与Fe原子的最短距离为 。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为
。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为___________ %(Mg原子的填隙率 );该材料的化学式为
);该材料的化学式为___________ ;晶体中Mg原子与H原子之间的最短距离为___________ pm。
(1)基态Fe的价层电子排布式为
(2)已知
 的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则
的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则 的晶体类型为
的晶体类型为 二聚体的结构式(不要求立体结构):
二聚体的结构式(不要求立体结构):(3)已知反式尖晶石结构晶体的通式为
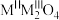 ,属于立方晶系。其晶胞中一半
,属于立方晶系。其晶胞中一半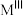 占据所有
占据所有 构成的四面体空隙,
构成的四面体空隙,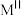 与另外一半
与另外一半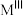 占据所有
占据所有 构成的八面体空隙。
构成的八面体空隙。 晶体为反式尖晶石结构,1个
晶体为反式尖晶石结构,1个 晶胞中,
晶胞中, 堆积共形成四面体空隙和八面体空隙的总和为24,则1个
堆积共形成四面体空隙和八面体空隙的总和为24,则1个 晶胞中
晶胞中 构成的四面体空隙的数目为
构成的四面体空隙的数目为(4)研究储氢材料对解决未来能源问题具有重要意义。某种Mg与Fe形成的储氢材料储氢后的晶胞结构如图所示(H原子位置未标出),晶胞参数(晶胞棱长)为a pm,H原子以正八面体、6配位的配位模式分布在Fe原子的周围,晶胞中每条棱上有2个H原子,H原子与Fe原子的最短距离为
 。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为
。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为 );该材料的化学式为
);该材料的化学式为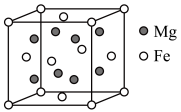
您最近一年使用:0次
7日内更新
|
5次组卷
|
2卷引用:陕西省榆林市2023-2024学年高三下学期开学理综试题-高中化学
2 . 油气开采、石油化工、合成氨等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2O(g)=2H2(g)+O2(g)△H1=+484kJ/mol
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H2=-912kJ/mol
③4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) △H3=+87kJ/mol
计算H2S热分解反应④2H2S(g)=S2(g)+2H2(g)的△H4=_______ 。
(2)对于H2S热分解反应④:恒温条件下增大压强,平衡_______ 移动(填“向左”“向右”或“不”);恒压条件下温度升高,H2S平衡转化率_______ (填“变大”“变小”或“不变”)。
(3)在1470K、108kPa 反应条件下,将n(H2S):n(Ar)=l:1的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等, H2S平衡转化率为_______ ,平衡常数Kp=_______ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
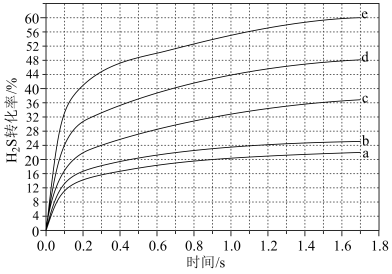
(4)在1470K、108kPa反应条件下,对于n(H2S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如下图所示。_______ (填“a”、“b”、“c”、“d”或“a”),理由是_______ 。
(5)下图所示的转化过程为合成氨工业含H2S废气处理提供了一种思路。
A B
B C
C D
D
已知D为含氧强酸,D的浓溶液可与铜反应并生成B气体,请写出该反应的化学方程式_______ 。
(1)已知下列反应的热化学方程式:
①2H2O(g)=2H2(g)+O2(g)△H1=+484kJ/mol
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H2=-912kJ/mol
③4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) △H3=+87kJ/mol
计算H2S热分解反应④2H2S(g)=S2(g)+2H2(g)的△H4=
(2)对于H2S热分解反应④:恒温条件下增大压强,平衡
(3)在1470K、108kPa 反应条件下,将n(H2S):n(Ar)=l:1的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等, H2S平衡转化率为
(4)在1470K、108kPa反应条件下,对于n(H2S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如下图所示。
(5)下图所示的转化过程为合成氨工业含H2S废气处理提供了一种思路。
A
 B
B C
C D
D已知D为含氧强酸,D的浓溶液可与铜反应并生成B气体,请写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1)R位于元素周期表第___________ 周期___________ 族;T的基态原子核外电子排布式为___________ 。
(2)用“>”或“<”填空:
(3)在加热的条件下单质X可与R的浓的最高价氧化物的水化物反应,写出该反应的化学方程式___________ 。
(4)下列现象与原子核外电子跃迁有关的是___________ (填标号)。
a.激光 b.LED灯光 c.金属导电 d.核辐射
(5)在101 kPa、25℃下,由最稳定单质生成1 mol该化合物时的热效应称为该化合物的标准生成焓(ΔH)。已知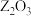 标准生成焓(ΔH)为:ΔH=-399.09 kJ/mol,
标准生成焓(ΔH)为:ΔH=-399.09 kJ/mol,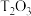 的标准生成焓(ΔH)为:ΔH=-269.70 kJ/mol,试写出单质Z和
的标准生成焓(ΔH)为:ΔH=-269.70 kJ/mol,试写出单质Z和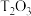 反应的热化学方程式
反应的热化学方程式___________ 。
| 元素 | 相关信息 |
| X | 元素最高正价与最低负价的绝对值相等 |
| Y | 是地壳中含量最多的元素 |
| Z | 元素基态原子3p能级只有一个电子 |
| W | 与Z位于同周期,能量最高的p能级电子为半充满 |
| R | 单质为黄色固体,常存在于火山喷发口 |
| T | 元素基态原子核外未成对电子最多 |
(1)R位于元素周期表第
(2)用“>”或“<”填空:
| 第一电离能 | 简单离子的半径 | 简单离子的还原性 | 最高价氧化物的熔点 |
| W | Y | Y | X |
(4)下列现象与原子核外电子跃迁有关的是
a.激光 b.LED灯光 c.金属导电 d.核辐射
(5)在101 kPa、25℃下,由最稳定单质生成1 mol该化合物时的热效应称为该化合物的标准生成焓(ΔH)。已知
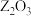 标准生成焓(ΔH)为:ΔH=-399.09 kJ/mol,
标准生成焓(ΔH)为:ΔH=-399.09 kJ/mol,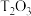 的标准生成焓(ΔH)为:ΔH=-269.70 kJ/mol,试写出单质Z和
的标准生成焓(ΔH)为:ΔH=-269.70 kJ/mol,试写出单质Z和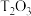 反应的热化学方程式
反应的热化学方程式
您最近一年使用:0次
4 . 氢溴酸( )是一种重要的化工产品,也是一种强酸。
)是一种重要的化工产品,也是一种强酸。
(1)已知: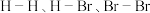 键能依次为
键能依次为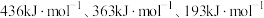 。则
。则
_____ kJ/mol。
(2)一定条件下,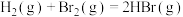 速率方程式为
速率方程式为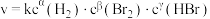 (
( 为速率常数,
为速率常数,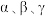 为各物质的反应级数)。某温度下测得实验数据如表所示:
为各物质的反应级数)。某温度下测得实验数据如表所示:
则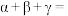
___________ 。
(3) 催化氧化反应为
催化氧化反应为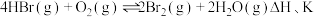 。研究表明,总反应分三步进行,其反应历程如图1所示。
。研究表明,总反应分三步进行,其反应历程如图1所示。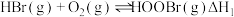 平衡常数
平衡常数
(Ⅱ)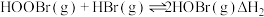 平衡常数
平衡常数
(Ⅲ) 平衡常数
平衡常数
①控速反应是___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)反应。
②
___________ (用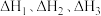 的表达式表示);
的表达式表示);
___________ (用 表示)。
表示)。
(4)向体积均为 的甲、乙恒容密闭容器中分别充入
的甲、乙恒容密闭容器中分别充入 和
和 ,发生反应:
,发生反应: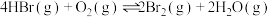 ,分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图2所示。
,分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图2所示。___________ (填“恒温”或“绝热”)条件下进行。
②反应速率: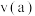
___________ 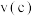 (填“>”“<”或“=”)
(填“>”“<”或“=”)
③b点浓度商
___________  ;甲条件下平衡常数K
;甲条件下平衡常数K___________ b点的Q(填“>”“<”或“=”)。
 )是一种重要的化工产品,也是一种强酸。
)是一种重要的化工产品,也是一种强酸。(1)已知:
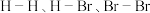 键能依次为
键能依次为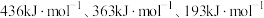 。则
。则
(2)一定条件下,
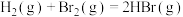 速率方程式为
速率方程式为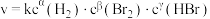 (
( 为速率常数,
为速率常数,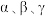 为各物质的反应级数)。某温度下测得实验数据如表所示:
为各物质的反应级数)。某温度下测得实验数据如表所示:| 序号 | 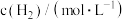 |  | 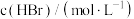 | 反应速率 |
| Ⅰ | 0.10 | 0.10 | 0.10 |  |
| Ⅱ | 0.20 | 0.10 | 0.10 |  |
| Ⅲ | 0.20 | 0.40 | 0.10 |  |
| Ⅳ | 0.40 | 0.90 | 0.20 | 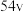 |
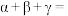
(3)
 催化氧化反应为
催化氧化反应为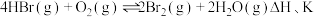 。研究表明,总反应分三步进行,其反应历程如图1所示。
。研究表明,总反应分三步进行,其反应历程如图1所示。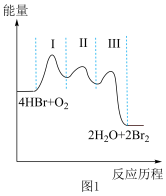
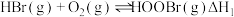 平衡常数
平衡常数
(Ⅱ)
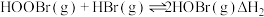 平衡常数
平衡常数
(Ⅲ)
 平衡常数
平衡常数
①控速反应是
②

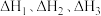 的表达式表示);
的表达式表示);
 表示)。
表示)。(4)向体积均为
 的甲、乙恒容密闭容器中分别充入
的甲、乙恒容密闭容器中分别充入 和
和 ,发生反应:
,发生反应: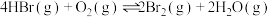 ,分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图2所示。
,分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图2所示。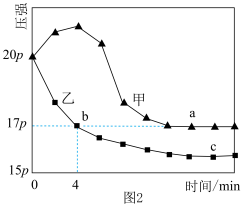
②反应速率:
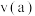
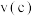 (填“>”“<”或“=”)
(填“>”“<”或“=”)③b点浓度商

 ;甲条件下平衡常数K
;甲条件下平衡常数K
您最近一年使用:0次
5 . 锰酸锂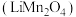 是锂电池的正极材料,有望取代
是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为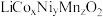 ,含少量铝箔、炭黑和有机粘合剂)制备
,含少量铝箔、炭黑和有机粘合剂)制备 的流程如下:
的流程如下:
(1) 位于周期表中
位于周期表中___________ 区;基态锰原子能量最高能级的电子排布图为___________ 。
(2)“灼烧”目的是___________ ;“碱浸”中会产生气体,该气体是___________ (填化学式)。
(3)“酸浸”中产生气泡,推测双氧水的作用是___________ 。
(4)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。“溶液变为紫红色”的原因是___________ (用离子方程式表示,加入 溶液之前,锰以
溶液之前,锰以 形式存在)。“紫红色褪去”后,还有实验现象:
形式存在)。“紫红色褪去”后,还有实验现象:___________ 。
(5)“合成”在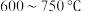 下进行,写出化学方程式:
下进行,写出化学方程式:___________ 。
(6) 热失重图像如图所示。c点得到的固体的化学式为
热失重图像如图所示。c点得到的固体的化学式为___________ 。
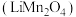 是锂电池的正极材料,有望取代
是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为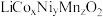 ,含少量铝箔、炭黑和有机粘合剂)制备
,含少量铝箔、炭黑和有机粘合剂)制备 的流程如下:
的流程如下: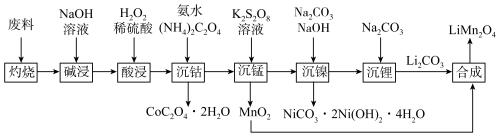
(1)
 位于周期表中
位于周期表中(2)“灼烧”目的是
(3)“酸浸”中产生气泡,推测双氧水的作用是
(4)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。“溶液变为紫红色”的原因是
 溶液之前,锰以
溶液之前,锰以 形式存在)。“紫红色褪去”后,还有实验现象:
形式存在)。“紫红色褪去”后,还有实验现象:(5)“合成”在
 下进行,写出化学方程式:
下进行,写出化学方程式:(6)
 热失重图像如图所示。c点得到的固体的化学式为
热失重图像如图所示。c点得到的固体的化学式为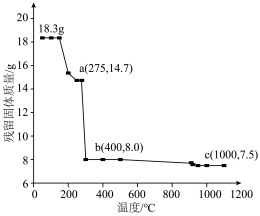
您最近一年使用:0次
6 . 软锰矿的主要成分为MnO2,含少量Al2O3和SiO2.闪锌矿主要成分为ZnS,含少量FeS、CuS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下:
Ⅱ.常温下各种金属离子开始沉淀和完全沉淀的pH如下表:
回答下列问题:
(1)为了加快矿石的酸浸速率,通常采用的方法有___________ 。
(2)滤渣2的主要成分是___________ (填化学式)。
(3)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的离子方程式:___________ 。
(4)步骤③中MnO2的作用可以用一种常见的绿色氧化剂的溶液来代替,其化学式为___________ ;若物质X是用来调节溶液的pH至a,试分析a的范围是___________ 。
(5)当金属离子物质的量浓度为1×10-5 时认为离子完全沉淀,则Ksp[Al(OH)3]=
时认为离子完全沉淀,则Ksp[Al(OH)3]=___________ 。
(6)步骤④是以锂离子电池作电源,结合流程图分析用惰性电极进行电解时:在阴极放电的离子是___________ (填离子符号),阳极的电极反应式为___________ 。
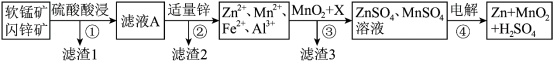
Ⅱ.常温下各种金属离子开始沉淀和完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| 开始沉淀 | 5.7 | 7.9 | 7.2 | 2.3 | 3.3 |
| 完全沉淀 | 8.4 | 10.1 | 9.3 | 3.7 | 4.9 |
(1)为了加快矿石的酸浸速率,通常采用的方法有
(2)滤渣2的主要成分是
(3)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的离子方程式:
(4)步骤③中MnO2的作用可以用一种常见的绿色氧化剂的溶液来代替,其化学式为
(5)当金属离子物质的量浓度为1×10-5
 时认为离子完全沉淀,则Ksp[Al(OH)3]=
时认为离子完全沉淀,则Ksp[Al(OH)3]=(6)步骤④是以锂离子电池作电源,结合流程图分析用惰性电极进行电解时:在阴极放电的离子是
您最近一年使用:0次
7 . 研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g) 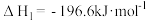
2NO(g)+O2(g) 2NO2(g)
2NO2(g) 
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的
SO3(g)+NO(g)的 。
。
(2)用NH3催化还原氮氧化物(SCR)技术是常见的烟气氮氧化物脱除技术,反应原理如图。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应,写出该反应的化学方程式___________ 。 进行吸附,主要反应为:C(s)+2NO(g)
进行吸附,主要反应为:C(s)+2NO(g) N2(g) +CO2(g)。t℃时,向容积恒定为10L的密闭容器中加入1molC(s)和2mol
N2(g) +CO2(g)。t℃时,向容积恒定为10L的密闭容器中加入1molC(s)和2mol (g)进行反应,5min时反应恰好达到平衡状态,且0~5min内v(CO2)=0.016mol·L-1·min-1.回答下列问题:
(g)进行反应,5min时反应恰好达到平衡状态,且0~5min内v(CO2)=0.016mol·L-1·min-1.回答下列问题:
①下列可判断该可逆反应达到化学平衡状态的标志是___________ 。
A.消耗2molN2的同时消耗了4molNO
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.c(N2)=c(CO2)
② t℃时,该反应的平衡常数K=___________ ;保持其他条件不变,在5min时向容器中同时通入0.1mol 和0.2molN2,此时速率:v正
和0.2molN2,此时速率:v正 ___________ (填“大于”“小于”或“等于”)v逆 。
(4)在汽车尾气的净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g) 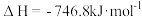 ,实验测得,v正= k正c2(NO)· c2(CO),v逆= k逆c(N2) c2(CO2)( k正、k逆为速率常数,均随温度的升高而增大,且都只与温度有关)。
,实验测得,v正= k正c2(NO)· c2(CO),v逆= k逆c(N2) c2(CO2)( k正、k逆为速率常数,均随温度的升高而增大,且都只与温度有关)。
①当该反应达到平衡状态后,保持其他条件不变,仅改变一个条件,下列有关说法正确的是___________ (填字母)。
A.加入催化剂可加快正、逆反应速率,同时增大反应物的转化率
B.降低温度,正反应速率减小的程度比逆反应速率减小的程度小
C.增大压强,平衡向正向移动,平衡常数增大
D.加入一定量的CO,平衡正向移动,但CO的转化率减小
②达到平衡后,仅升高温度,k正 增大的倍数___________ (填“大于”、“小于”或“等于”)k逆 增大的倍数。
(1)已知:2SO2(g)+O2(g)
 2SO3(g)
2SO3(g) 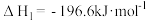
2NO(g)+O2(g)
 2NO2(g)
2NO2(g) 
则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的
SO3(g)+NO(g)的 。
。(2)用NH3催化还原氮氧化物(SCR)技术是常见的烟气氮氧化物脱除技术,反应原理如图。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应,写出该反应的化学方程式
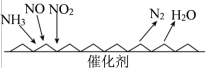
 进行吸附,主要反应为:C(s)+2NO(g)
进行吸附,主要反应为:C(s)+2NO(g) N2(g) +CO2(g)。t℃时,向容积恒定为10L的密闭容器中加入1molC(s)和2mol
N2(g) +CO2(g)。t℃时,向容积恒定为10L的密闭容器中加入1molC(s)和2mol (g)进行反应,5min时反应恰好达到平衡状态,且0~5min内v(CO2)=0.016mol·L-1·min-1.回答下列问题:
(g)进行反应,5min时反应恰好达到平衡状态,且0~5min内v(CO2)=0.016mol·L-1·min-1.回答下列问题:①下列可判断该可逆反应达到化学平衡状态的标志是
A.消耗2molN2的同时消耗了4molNO
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.c(N2)=c(CO2)
② t℃时,该反应的平衡常数K=
 和0.2molN2,此时速率:v正
和0.2molN2,此时速率:v正 (4)在汽车尾气的净化装置中CO和NO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)
N2(g)+2CO2(g) 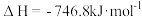 ,实验测得,v正= k正c2(NO)· c2(CO),v逆= k逆c(N2) c2(CO2)( k正、k逆为速率常数,均随温度的升高而增大,且都只与温度有关)。
,实验测得,v正= k正c2(NO)· c2(CO),v逆= k逆c(N2) c2(CO2)( k正、k逆为速率常数,均随温度的升高而增大,且都只与温度有关)。①当该反应达到平衡状态后,保持其他条件不变,仅改变一个条件,下列有关说法正确的是
A.加入催化剂可加快正、逆反应速率,同时增大反应物的转化率
B.降低温度,正反应速率减小的程度比逆反应速率减小的程度小
C.增大压强,平衡向正向移动,平衡常数增大
D.加入一定量的CO,平衡正向移动,但CO的转化率减小
②达到平衡后,仅升高温度,k正 增大的倍数
您最近一年使用:0次
8 . 合理应用和处理氮及其化合物,在生产生活中有重要意义。
(一)利用催化转化反应 ,可有效地将汽车尾气中的CO和NO同时除去。
,可有效地将汽车尾气中的CO和NO同时除去。
已知:
 ;
;

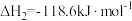 。
。
(1)计算: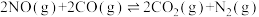

______ 。
(二)一定温度下,向某密闭容器中充入等物质的量的NO和CO,发生上述反应。测得NO浓度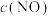 随时间t的变化曲线如图。
随时间t的变化曲线如图。
______  。
。
(3)下列有关该反应的说法正确的是______(填标号)。
(三)增大催化剂的比表面积可提高该反应速率,为了探究温度、催化剂的比表面积对该反应速率的影响规律,某同学设计了如下三组实验。
(4)a=______ 。
(5)探究温度对该反应速率影响规律的实验有______ (填实验编号)。
(6)实验Ⅰ和实验Ⅱ中,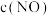 随时间t的变化曲线如图,表示实验Ⅱ的是曲线
随时间t的变化曲线如图,表示实验Ⅱ的是曲线______ (填“甲”或“乙”)。______ 。
(8)电池工作时, 移向
移向______ 电极(填“a”或“b”)。
(一)利用催化转化反应
 ,可有效地将汽车尾气中的CO和NO同时除去。
,可有效地将汽车尾气中的CO和NO同时除去。已知:

 ;
;
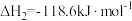 。
。(1)计算:
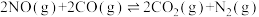

(二)一定温度下,向某密闭容器中充入等物质的量的NO和CO,发生上述反应。测得NO浓度
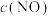 随时间t的变化曲线如图。
随时间t的变化曲线如图。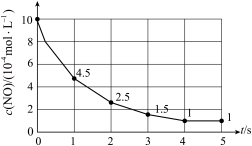

 。
。(3)下列有关该反应的说法正确的是______(填标号)。
| A.体系中混合气体的平均摩尔质量不变时,该反应达到平衡状态 |
B.体系中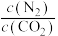 保持不变时,该反应达到平衡状态 保持不变时,该反应达到平衡状态 |
C.一定压强下充入惰性气体, 、 、 均不变 均不变 |
D.5s时,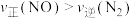 |
(三)增大催化剂的比表面积可提高该反应速率,为了探究温度、催化剂的比表面积对该反应速率的影响规律,某同学设计了如下三组实验。
| 实验编号 | T℃ | NO初始浓度 /(  ) ) | CO初始浓度 /(  ) ) | 催化剂的比表面积 /( 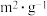 ) ) |
| Ⅰ | 280 | 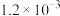 |  | 82 |
| Ⅱ | 280 | 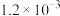 | b | 124 |
| Ⅲ | 350 | a |  | 82 |
(4)a=
(5)探究温度对该反应速率影响规律的实验有
(6)实验Ⅰ和实验Ⅱ中,
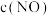 随时间t的变化曲线如图,表示实验Ⅱ的是曲线
随时间t的变化曲线如图,表示实验Ⅱ的是曲线
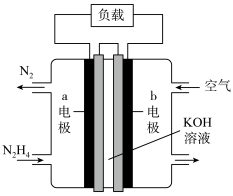
(8)电池工作时,
 移向
移向
您最近一年使用:0次
解题方法
9 . 回答下列问题。
Ⅰ. 和CO是常见的环境污染气体。
和CO是常见的环境污染气体。
(1)对于反应 来说,“
来说,“ ”可作为此反应的催化剂。其总反应分两步进行:第一步为
”可作为此反应的催化剂。其总反应分两步进行:第一步为 ;则第二步为
;则第二步为_______ (写方程式)。已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_______ (填“大于”“小于”或“等于”)第二步反应的活化能。
Ⅱ.三氧化钼( )是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备,回答下列相关问题。
)通过一定条件来制备,回答下列相关问题。
已知:
①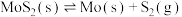
②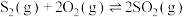
③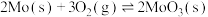
(2)则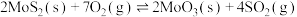 的
的
_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)若在恒温恒容的容器中加入一定量 ,仅发生反应
,仅发生反应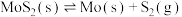
①下列说法正确的是_______ (填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时 (g)的浓度为1.4
(g)的浓度为1.4 ,若
,若 时充入一定量的
时充入一定量的 (g),到
(g),到 反应再次达到平衡,请在下图中画出
反应再次达到平衡,请在下图中画出 -
- 时间段
时间段 (g)的浓度与时间的关系图
(g)的浓度与时间的关系图_______ 。 (g)和1.5mol
(g)和1.5mol  (g),若仅发生反应:
(g),若仅发生反应: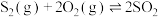
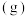 ,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,
,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内, (g)的反应速率为
(g)的反应速率为_______
 。
。
(5)在恒容密闭容器中,加入足量的 和
和 ,仅发生反应:
,仅发生反应:
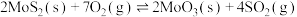
 。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
_______ (填“>”“<”“=”)0;比较 、
、 、
、 的大小:
的大小:_______ 。
②若初始时通入7.0mol ,
, 为7.0MPa,则A点平衡常数
为7.0MPa,则A点平衡常数
_______ (用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。压强为 ,温度为1100K时,平衡常数
,温度为1100K时,平衡常数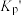
_______ (填“>”“<”“=”) 。
。
Ⅰ.
 和CO是常见的环境污染气体。
和CO是常见的环境污染气体。(1)对于反应
 来说,“
来说,“ ”可作为此反应的催化剂。其总反应分两步进行:第一步为
”可作为此反应的催化剂。其总反应分两步进行:第一步为 ;则第二步为
;则第二步为Ⅱ.三氧化钼(
 )是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备,回答下列相关问题。
)通过一定条件来制备,回答下列相关问题。已知:
①
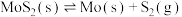
②
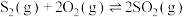
③
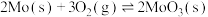
(2)则
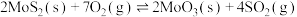 的
的
 、
、 、
、 的代数式表示)。
的代数式表示)。(3)若在恒温恒容的容器中加入一定量
 ,仅发生反应
,仅发生反应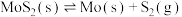
①下列说法正确的是
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加
 的量,平衡正向移动
的量,平衡正向移动②达到平衡时
 (g)的浓度为1.4
(g)的浓度为1.4 ,若
,若 时充入一定量的
时充入一定量的 (g),到
(g),到 反应再次达到平衡,请在下图中画出
反应再次达到平衡,请在下图中画出 -
- 时间段
时间段 (g)的浓度与时间的关系图
(g)的浓度与时间的关系图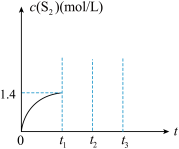
 (g)和1.5mol
(g)和1.5mol  (g),若仅发生反应:
(g),若仅发生反应: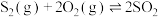
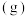 ,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,
,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内, (g)的反应速率为
(g)的反应速率为 。
。(5)在恒容密闭容器中,加入足量的
 和
和 ,仅发生反应:
,仅发生反应: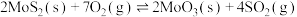
 。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
。测得氧气的平衡转化率与起始压强、温度的关系如图所示。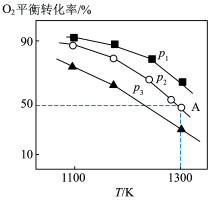

 、
、 、
、 的大小:
的大小:②若初始时通入7.0mol
 ,
, 为7.0MPa,则A点平衡常数
为7.0MPa,则A点平衡常数
 ,温度为1100K时,平衡常数
,温度为1100K时,平衡常数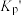
 。
。
您最近一年使用:0次
2024-09-16更新
|
176次组卷
|
2卷引用:浙江省宁波市金兰教育合作组织2023-2024学年高二上学期期中联考化学试题
解题方法
10 . 某同学欲配制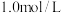 的氢氧化钠溶液
的氢氧化钠溶液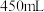 ,完成下列步骤:
,完成下列步骤:
(1)应选用容量瓶的规格为___________ ;下列关于容量瓶的叙述错误的是___________ (填序号)。
a.贮存溶液
b.配制一定体积、一定物质的量浓度的溶液
c.用来加热溶解固体溶质
d.使用前需检查是否漏水
(2)用托盘天平称取氢氧化钠固体___________ 。
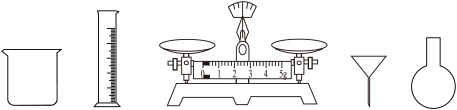
(3)需要的仪器除了药匙、玻璃棒、胶头滴管、一定容积的容量瓶、托盘天平外,还需要的玻璃仪器有___________ (从下图中选择仪器并填写名称)。
①正确的实验操作顺序是___________ (用字母表示,每个符号只能用一次)。
A.将已恢复至室温的氢氧化钠溶液移液,用玻璃棒引流将其缓缓注入所选用的容量瓶中
B.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
C.用托盘天平准确称取所需氢氧化钠固体放入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其全部溶解
D.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
E.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线 处
处
F.盖好瓶塞,反复上下颠倒摇匀
②下列操作可能使所配溶液浓度偏低的是___________ (填字母)。
A.未进行①中操作B
B.称取氢氧化钠固体时砝码与药品放反
C.定容时俯视容量瓶瓶颈上的刻度线
D.加蒸馏水时不慎超过容量瓶瓶颈上的刻度线
E.容量瓶用蒸馏水洗净后,没晾干直接使用
③若实验中出现以下情况,应该怎么处理:向容量瓶中转移溶液时(操作A)不慎将少量溶液洒到容量瓶外面:___________ 。
(5)从已配制好的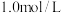 的
的 溶液中取出
溶液中取出 ,则取出的溶液中溶质的物质的量浓度是
,则取出的溶液中溶质的物质的量浓度是___________ ,如果该溶液的密度为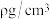 ,则其质量分数为
,则其质量分数为___________ (用含 的代数式表达)。
的代数式表达)。
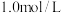 的氢氧化钠溶液
的氢氧化钠溶液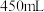 ,完成下列步骤:
,完成下列步骤:(1)应选用容量瓶的规格为
a.贮存溶液
b.配制一定体积、一定物质的量浓度的溶液
c.用来加热溶解固体溶质
d.使用前需检查是否漏水
(2)用托盘天平称取氢氧化钠固体
(3)需要的仪器除了药匙、玻璃棒、胶头滴管、一定容积的容量瓶、托盘天平外,还需要的玻璃仪器有
①正确的实验操作顺序是
A.将已恢复至室温的氢氧化钠溶液移液,用玻璃棒引流将其缓缓注入所选用的容量瓶中
B.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液全部注入容量瓶中,轻轻摇动容量瓶
C.用托盘天平准确称取所需氢氧化钠固体放入烧杯中,再向烧杯中加入少量蒸馏水,慢慢搅动,使其全部溶解
D.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶瓶颈上的刻度线相切
E.继续往容量瓶中加蒸馏水,直到液面接近瓶颈上的刻度线
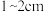 处
处F.盖好瓶塞,反复上下颠倒摇匀
②下列操作可能使所配溶液浓度偏低的是
A.未进行①中操作B
B.称取氢氧化钠固体时砝码与药品放反
C.定容时俯视容量瓶瓶颈上的刻度线
D.加蒸馏水时不慎超过容量瓶瓶颈上的刻度线
E.容量瓶用蒸馏水洗净后,没晾干直接使用
③若实验中出现以下情况,应该怎么处理:向容量瓶中转移溶液时(操作A)不慎将少量溶液洒到容量瓶外面:
(5)从已配制好的
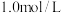 的
的 溶液中取出
溶液中取出 ,则取出的溶液中溶质的物质的量浓度是
,则取出的溶液中溶质的物质的量浓度是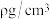 ,则其质量分数为
,则其质量分数为 的代数式表达)。
的代数式表达)。
您最近一年使用:0次



