解题方法
1 . 某学生设计下列实验装置制取少量漂白粉。
(1)装置A中仪器a的名称是_______ 。
(2)装置B中盛放的试剂是_______ 。
(3)装置C中制取漂白粉的化学方程式是_______ 。
(4)装置D中 溶液的作用是
溶液的作用是_______ 。
(5)下列说法不正确 的是_______。

(1)装置A中仪器a的名称是
(2)装置B中盛放的试剂是
(3)装置C中制取漂白粉的化学方程式是
(4)装置D中
 溶液的作用是
溶液的作用是(5)下列说法
| A.搭好装置后,先加药品再检查气密性 |
| B.浓盐酸在反应中仅体现还原性 |
| C.漂白粉可用作游泳池的消毒剂 |
D.多孔球泡和搅拌器都能使石灰乳充分吸收 |
您最近一年使用:0次
2 . 工业上以海水为原料富集镁并冶炼金属镁,其流程如图:
(1)海水中含有大量MgCl2、NaCl和CaCl2,它们属于______ (填“酸”或“盐”)。
(2)熟石灰溶于水,所得的溶液呈______ (填“酸性”或“碱性”)。
(3)冶炼镁(操作Ⅱ)的方法属于______ (填“电解法”或“热分解法”)。
(4)工业上制取光气(COCl2)的反应: 。某体积为2 L的恒容反应器中发生上述反应,Cl2的物质的量与时间的关系如图。则:
。某体积为2 L的恒容反应器中发生上述反应,Cl2的物质的量与时间的关系如图。则:______  ;
;
②其他条件不变时,往反应器中通入氩气(不参与反应),该反应的反应速率______ (填“增大”或“不变”)。

(1)海水中含有大量MgCl2、NaCl和CaCl2,它们属于
(2)熟石灰溶于水,所得的溶液呈
(3)冶炼镁(操作Ⅱ)的方法属于
(4)工业上制取光气(COCl2)的反应:
 。某体积为2 L的恒容反应器中发生上述反应,Cl2的物质的量与时间的关系如图。则:
。某体积为2 L的恒容反应器中发生上述反应,Cl2的物质的量与时间的关系如图。则: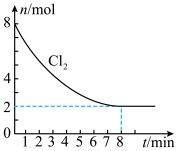
 ;
;②其他条件不变时,往反应器中通入氩气(不参与反应),该反应的反应速率
您最近一年使用:0次
3 . 某实验小组研究Zn单质与三价铁盐的反应。
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
【实验过程】
【分析解释】
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为___________ 。
(2)实验II中,产生的大量气体为___________ (填化学式)。
(3)实验III中,溶液变成深棕色,NO 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:___________ 。
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为___________ (填实验编号)。
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为___________
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO
 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。【实验过程】
| 实验 | 编号 | 试剂 | 现象 |
| I | 0.1 mol·L-1 FeCl3溶液(pH≈1.30 ) | 黄色溶液很快变浅,有无色气泡产生,无铁产生 |
| II | 1 mol·L-1 FeCl3溶液 (pH≈0.70 ) | 片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁 | |
| III | 1 mol·L-1 Fe(NO3)3溶液(pH≈0.70 ) | 约半小时后,溶液变为深棕色且浑浊,无铁产生 | |
| IV | 0.5 mol·L-1 Fe2(SO4)3溶液(pH≈0.70 ) | 约半小时后,溶液呈浅绿色且浑浊,产生少量铁 |
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为
(2)实验II中,产生的大量气体为
(3)实验III中,溶液变成深棕色,NO
 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:3Zn + NO
NO +8H+=3Zn2++
+8H+=3Zn2++ ___________+4H2O
___________+4H2O
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为
您最近一年使用:0次
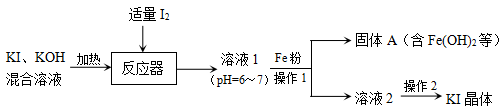
4 . KI广泛用于皮肤科、眼科等疾病的治疗,可以利用海水中获得的I2与KI、KOH的混合溶液为原料制备KI,流程如下:
ii.pH=6~7的溶液显弱酸性;
iii.KI的溶解度:
(1)溶液1中的溶质主要为KI、___________ (填化学式)。
(2)使用粉末状的铁能加快反应速率,原因是___________ 。
(3)用文字描述Fe所起的作用是___________ 。
(4)向固体A中加入稀硫酸能够制备FeSO4,该过程的离子方程式:___________ 、___________ 。
(5)操作2是___________ ,过滤,洗涤,干燥。
ii.pH=6~7的溶液显弱酸性;
iii.KI的溶解度:
| 温度/℃ | 6 | 20 | 60 | 100 |
| KI溶解度/g | 128 | 140 | 176 | 206 |
(2)使用粉末状的铁能加快反应速率,原因是
(3)用文字描述Fe所起的作用是
(4)向固体A中加入稀硫酸能够制备FeSO4,该过程的离子方程式:
(5)操作2是
您最近一年使用:0次
解题方法
5 . 工业上以黄铁矿为原料制备硫酸的原理示意图如下。
(1)黄铁矿主要成分的化学式是_______ 。
(2)SO2使品红溶液褪色,体现SO2具有_______ 性。
(3)步骤Ⅲ的化学方程式是_______ 。
(4)下列说法不正确 的是_______。

(1)黄铁矿主要成分的化学式是
(2)SO2使品红溶液褪色,体现SO2具有
(3)步骤Ⅲ的化学方程式是
(4)下列说法
| A.步骤Ⅰ前需将黄铁矿粉碎,目的是增大接触面积,加快反应速率 |
| B.步骤Ⅱ中使用催化剂,能使SO2的转化率达到100% |
| C.步骤Ⅲ中选用98.3%的浓硫酸作吸收剂 |
| D.图中每一步含硫物质均发生氧化反应 |
您最近一年使用:0次
6 . 工业上可以用 和
和 反应生成燃料甲醇,制备甲醇的化学方程式如下:
反应生成燃料甲醇,制备甲醇的化学方程式如下:
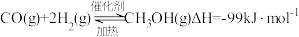
回答下列问题:
1.找到合适的催化剂是实现反应工业化的关键。该反应使用催化剂可以实现的目标有_____。
2.某温度下,将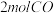 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后,达到平衡时测得
后,达到平衡时测得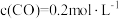 ,则
,则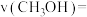
_____ 。
3.将 和
和 按照等物质的量进行反应,测得
按照等物质的量进行反应,测得 在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
4.反应中的 ,可由如下反应制得:
,可由如下反应制得: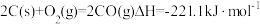 ,判断该反应能否自发进行,并简述原因:
,判断该反应能否自发进行,并简述原因:_____ 。
5.甲醇燃料电池以甲醇为燃料,其工作原理示意图:_____ 极。
(2)写出a极反应式_____ 。
6. ,两种酸的电离平衡常数如表所示:
,两种酸的电离平衡常数如表所示:
(1)写出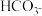 的电离平衡常数表达式
的电离平衡常数表达式
_____ 。
(2)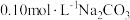 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为_____ 。
(3)向 溶液中加入足量的
溶液中加入足量的 溶液,发生反应的离子方程式是
溶液,发生反应的离子方程式是_____ 。
7.碳酸钙沉淀能溶于盐酸,用平衡移动原理解释其原因:_____ 。
 和
和 反应生成燃料甲醇,制备甲醇的化学方程式如下:
反应生成燃料甲醇,制备甲醇的化学方程式如下: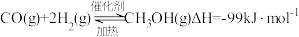
回答下列问题:
1.找到合适的催化剂是实现反应工业化的关键。该反应使用催化剂可以实现的目标有_____。
| A.缩短达到平衡所需时间 | B.增大甲醇的体积分数 |
| C.提高单位时间内甲醇的产量 | D.提高 的平衡转化率 的平衡转化率 |
 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后,达到平衡时测得
后,达到平衡时测得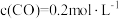 ,则
,则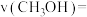
3.将
 和
和 按照等物质的量进行反应,测得
按照等物质的量进行反应,测得 在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是_____。
A.温度: | B.正反应速率: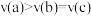 |
C.平衡常数: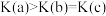 | D.平均摩尔质量: |
 ,可由如下反应制得:
,可由如下反应制得: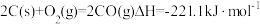 ,判断该反应能否自发进行,并简述原因:
,判断该反应能否自发进行,并简述原因:5.甲醇燃料电池以甲醇为燃料,其工作原理示意图:
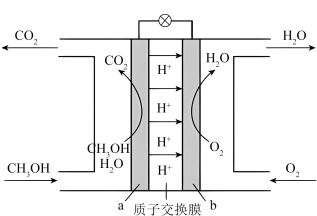
(2)写出a极反应式
6.
 ,两种酸的电离平衡常数如表所示:
,两种酸的电离平衡常数如表所示: |  | |
 | 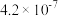 | 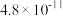 |
 |  |  |
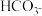 的电离平衡常数表达式
的电离平衡常数表达式
(2)
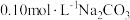 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为(3)向
 溶液中加入足量的
溶液中加入足量的 溶液,发生反应的离子方程式是
溶液,发生反应的离子方程式是7.碳酸钙沉淀能溶于盐酸,用平衡移动原理解释其原因:
您最近一年使用:0次
7 . 某同学设计了如下图所示的装置,利用铜与浓硫酸反应制备 ,并探究其性质。A~d均为蘸有相应试液的棉花,夹持装置、加热装置已省略。
,并探究其性质。A~d均为蘸有相应试液的棉花,夹持装置、加热装置已省略。
1.写出加热条件下铜与浓硫酸反应的化学方程式_____ 。
2.能够说明 具有还原性的实验现象是_____。(单选)
具有还原性的实验现象是_____。(单选)
3.b处现象是_____ ,说明 具有
具有_____ 性。
 ,并探究其性质。A~d均为蘸有相应试液的棉花,夹持装置、加热装置已省略。
,并探究其性质。A~d均为蘸有相应试液的棉花,夹持装置、加热装置已省略。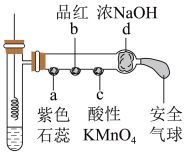
1.写出加热条件下铜与浓硫酸反应的化学方程式
2.能够说明
 具有还原性的实验现象是_____。(单选)
具有还原性的实验现象是_____。(单选)| A.a处 | B.b处 | C.c处 | D.d处 |
 具有
具有
您最近一年使用:0次
解题方法
8 .  溶液在工业上用于蚀刻铜箔电路板,从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示(省略部分物质)。
溶液在工业上用于蚀刻铜箔电路板,从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示(省略部分物质)。 蚀刻铜箔的离子方程式
蚀刻铜箔的离子方程式_____ 。
2.要检验废液中是否还存在 ,实验方案是
,实验方案是_____ 。
3.操作I的名称是_____(单选)
4.为了从固体中分离出铜,需加入的试剂X是_____。(单选)
5.若要使溶液Ⅱ再生为蚀刻液,可选用的试剂是_____ (填化学式)。发生反应的化学方程式是_____ 。
 溶液在工业上用于蚀刻铜箔电路板,从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示(省略部分物质)。
溶液在工业上用于蚀刻铜箔电路板,从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示(省略部分物质)。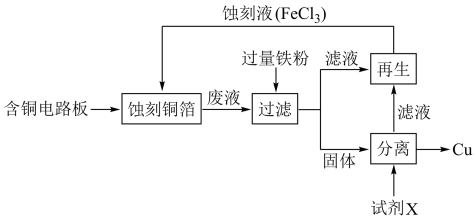
 蚀刻铜箔的离子方程式
蚀刻铜箔的离子方程式2.要检验废液中是否还存在
 ,实验方案是
,实验方案是3.操作I的名称是_____(单选)
| A.蒸发 | B.结晶 | C.过滤 | D.分液 |
A. | B. | C. | D. |
您最近一年使用:0次
名校
9 . 菱铁矿主要成分是碳酸亚铁( ),以菱铁矿为原料制取铁的一种流程如图:
),以菱铁矿为原料制取铁的一种流程如图:
(1)“氧化”和“沉淀”是将“酸浸”过程中产生的 全部转化为
全部转化为 ,
, 为一种
为一种______ (填“白”或“红褐”)色沉淀。
(2)“分解”过程的产物为水和______ (填“FeO”或“ ”)。
”)。
(3)利用金属活动性的不同,可以采取不同的冶炼方法,上述流程中的“过程Ⅰ”属于______ (填“热还原法”或“热分解法”)。
(4)氨水由氨气溶于水制备,工业合成氨的化学方程式为 。一定条件下,在2L密闭容器中,充入3mol
。一定条件下,在2L密闭容器中,充入3mol  和1mol
和1mol  发生反应,2min时测得生成了0.4mol
发生反应,2min时测得生成了0.4mol  。则:
。则:
①用 表示2min内该反应的速率为
表示2min内该反应的速率为______  。
。
②其他条件不变,将容器的容积压缩为1L,则该反应的速率______ (填“增大”“减小”或“不变”)。
 ),以菱铁矿为原料制取铁的一种流程如图:
),以菱铁矿为原料制取铁的一种流程如图: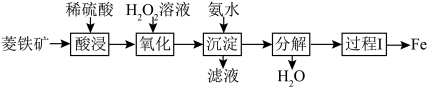
(1)“氧化”和“沉淀”是将“酸浸”过程中产生的
 全部转化为
全部转化为 ,
, 为一种
为一种(2)“分解”过程的产物为水和
 ”)。
”)。(3)利用金属活动性的不同,可以采取不同的冶炼方法,上述流程中的“过程Ⅰ”属于
(4)氨水由氨气溶于水制备,工业合成氨的化学方程式为
 。一定条件下,在2L密闭容器中,充入3mol
。一定条件下,在2L密闭容器中,充入3mol  和1mol
和1mol  发生反应,2min时测得生成了0.4mol
发生反应,2min时测得生成了0.4mol  。则:
。则:①用
 表示2min内该反应的速率为
表示2min内该反应的速率为 。
。②其他条件不变,将容器的容积压缩为1L,则该反应的速率
您最近一年使用:0次
10 . 制造印刷电路板的重要反应为 ,某学习小组模拟从其废液中回收铜,并获得
,某学习小组模拟从其废液中回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:
(1)操作(Ⅰ)的名称为___________ 。
(2)加过量盐酸发生反应的离子方程式为___________ 。
(3)溶液(Ⅰ)和溶液(Ⅱ)中主要金属阳离子为___________ (填“ ”或“
”或“ ”)。
”)。
(4)学习小组为探究Fe与盐酸的反应速率,将一定量的铁粉与100mL 1 盐酸混合,3min后,溶液中
盐酸混合,3min后,溶液中 浓度为0.3
浓度为0.3 。则:
。则:
①用 浓度变化表示该反应速率为
浓度变化表示该反应速率为___________  ;
;
②其他条件不变,换2 的盐酸,则反应速率
的盐酸,则反应速率___________ (填“增大”或“减小”)。
 ,某学习小组模拟从其废液中回收铜,并获得
,某学习小组模拟从其废液中回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:
(1)操作(Ⅰ)的名称为
(2)加过量盐酸发生反应的离子方程式为
(3)溶液(Ⅰ)和溶液(Ⅱ)中主要金属阳离子为
 ”或“
”或“ ”)。
”)。(4)学习小组为探究Fe与盐酸的反应速率,将一定量的铁粉与100mL 1
 盐酸混合,3min后,溶液中
盐酸混合,3min后,溶液中 浓度为0.3
浓度为0.3 。则:
。则:①用
 浓度变化表示该反应速率为
浓度变化表示该反应速率为 ;
;②其他条件不变,换2
 的盐酸,则反应速率
的盐酸,则反应速率
您最近一年使用:0次




