解题方法
1 . 探究是创新的源泉,某化学兴趣小组进行了制备氯气并探究卤素性质的实验。
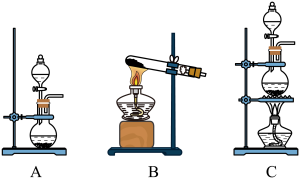
(1)用二氧化锰与浓盐酸制备氯气,应选择的发生装置是_______ (填字母代号),该反应体现了浓盐酸的酸性和_______ (填“氧化性”或“还原性”)。
①甲中反应的离子方程式为_______ ,向反应后的橙黄色溶液中滴加 KI-淀粉溶液,溶液变为蓝色,通过上述实验_______ (填“能”或“不能”)得出氧化性:Cl2>Br2>I2。
②乙装置中 NaOH 溶液的作用为_______ ,其主要反应的化学方程式为_______ 。
(1)用二氧化锰与浓盐酸制备氯气,应选择的发生装置是
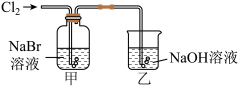
①甲中反应的离子方程式为
②乙装置中 NaOH 溶液的作用为
您最近一年使用:0次
名校
解题方法
2 . 侯氏制碱法是我国化学工程专家侯德榜将氨碱法和合成氨法两种工艺联合起来生产纯碱的方法。主要过程如图所示(部分物质已略去):
(1)纯碱的化学式为___________ (填“ ”或“
”或“ ”);
”);
(2)操作①的名称是___________ (填“蒸发”或“过滤”);
(3)上述实验过程中可以循环使用的物质是___________ (填化学式);
(4)工业上可以用氨生产尿素,其方程式为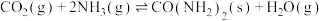 ,一定温度下,将1 mol
,一定温度下,将1 mol  和2 mol
和2 mol  充入体积为1L的密闭容器中,5 min后测得
充入体积为1L的密闭容器中,5 min后测得 的物质的量为0.6 mol,则:
的物质的量为0.6 mol,则:
①对上述反应,若适当升高温度,化学反应速率会___________ (填“增大”或“减小”);
②用 的浓度变化表示该反应的平均速率为
的浓度变化表示该反应的平均速率为___________ mol/(L·min)。
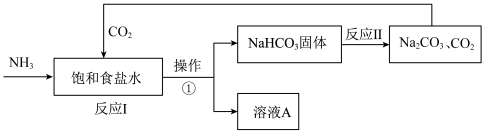
(1)纯碱的化学式为
 ”或“
”或“ ”);
”);(2)操作①的名称是
(3)上述实验过程中可以循环使用的物质是
(4)工业上可以用氨生产尿素,其方程式为
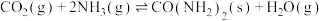 ,一定温度下,将1 mol
,一定温度下,将1 mol  和2 mol
和2 mol  充入体积为1L的密闭容器中,5 min后测得
充入体积为1L的密闭容器中,5 min后测得 的物质的量为0.6 mol,则:
的物质的量为0.6 mol,则:①对上述反应,若适当升高温度,化学反应速率会
②用
 的浓度变化表示该反应的平均速率为
的浓度变化表示该反应的平均速率为
您最近一年使用:0次
名校
解题方法
3 . 实验室采用下列实验装置制取少量 并对其性质进行探究:
并对其性质进行探究:
(1)装置B中的现象是品红溶液___________ (填“褪色”或“不褪色”);
(2)装置C中溶液紫红色褪去,体现了 的
的___________ (填“漂白性”或“还原性”);
(3)装置E中倒置漏斗的作用是___________ ;
(4)若装置E中NaOH溶液足量,则E中发生反应的化学方程式为___________ ;
(5)欲制取2.24L(标准状况) ,至少需要
,至少需要 的质量为
的质量为___________ g。
 并对其性质进行探究:
并对其性质进行探究: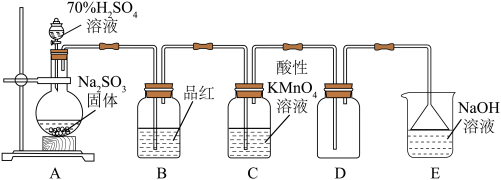

(1)装置B中的现象是品红溶液
(2)装置C中溶液紫红色褪去,体现了
 的
的(3)装置E中倒置漏斗的作用是
(4)若装置E中NaOH溶液足量,则E中发生反应的化学方程式为
(5)欲制取2.24L(标准状况)
 ,至少需要
,至少需要 的质量为
的质量为
您最近一年使用:0次
4 . 过二硫酸钠( )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: 。
。
(1)写出装置中生成 的反应的化学方程式:
的反应的化学方程式:___________ 。
(2)盛装NaOH溶液的仪器名称为___________ ,持续通入氮气的目的是___________ 。
(3)装置中硫酸的作用是___________ 。
(4)某兴趣小组设计实验探究不同环境下 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
①在___________ (填“中性”“酸性”或“碱性”)条件下, 的氧化能力最强。
的氧化能力最强。
②若用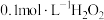 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___________ ;达到滴定终点时,消耗 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中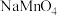 的质量为
的质量为___________ g(用含 的代数式表示,
的代数式表示,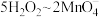 )
)
 )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: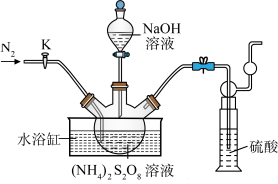
 。
。(1)写出装置中生成
 的反应的化学方程式:
的反应的化学方程式:(2)盛装NaOH溶液的仪器名称为
(3)装置中硫酸的作用是
(4)某兴趣小组设计实验探究不同环境下
 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变为深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色( ) ) | 10s后溶液逐渐变为深紫色( ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀硫酸无明显现象 | 煮沸3min后,有气泡冒出 |
 的氧化能力最强。
的氧化能力最强。②若用
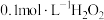 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中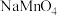 的质量为
的质量为 的代数式表示,
的代数式表示,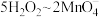 )
)
您最近一年使用:0次
解题方法
5 . 下表显示了元素周期表中的一部分。
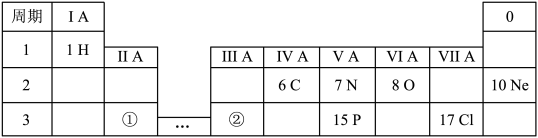
请回答下列问题:
(1)磷元素的原子序数是___________ 。
(2)属于稀有气体的是___________ (选填“ ”或“
”或“ ”)。
”)。
(3)碳元素在元素周期表的第___________ (选填“二”或“三”)周期第___________ (选填“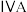 ”或“
”或“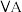 ”)族。
”)族。
(4)红棕色气体 中氮元素的化合价为
中氮元素的化合价为___________ (选填“ ”或“
”或“ ”)价。
”)价。
(5)含有共价键的单质是___________ (选填“ ”或“
”或“ ”)。
”)。
(6)已知同周期元素从左到右金属性逐渐减弱,则元素的金属性强弱:①___________ ②(选填“大于”或“小于”)。
(7)下列化学用语使用正确的是:___________ (填写字母)。
A.中子数为8的碳原子符号为 B.氯化氢的电子式为
B.氯化氢的电子式为

请回答下列问题:
(1)磷元素的原子序数是
(2)属于稀有气体的是
 ”或“
”或“ ”)。
”)。(3)碳元素在元素周期表的第
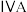 ”或“
”或“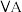 ”)族。
”)族。(4)红棕色气体
 中氮元素的化合价为
中氮元素的化合价为 ”或“
”或“ ”)价。
”)价。(5)含有共价键的单质是
 ”或“
”或“ ”)。
”)。(6)已知同周期元素从左到右金属性逐渐减弱,则元素的金属性强弱:①
(7)下列化学用语使用正确的是:
A.中子数为8的碳原子符号为
 B.氯化氢的电子式为
B.氯化氢的电子式为
您最近一年使用:0次
名校
解题方法
6 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛应用于纺织业和造纸业。利用碱性NaBH4溶液或Zn还原含硫化合物是制备Na2S2O4常用方法。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入___________ (请完成溶液配制,所需试剂为40gNaOH固体及12gNaBH4固体)。
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是___________ 。

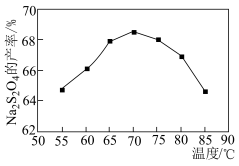
(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是___________ 。Na2S2O4在水溶液中发生歧化反应的离子方程式为___________ 。
Ⅱ.锌粉还原法
已知:①Zn+2H2SO3 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;
②二价锌在水溶液中的存在形式与pH的关系如图所示。
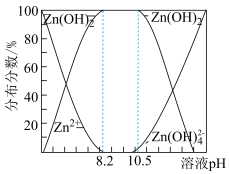
(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,___________ ,向滤液中加入氯化钠粉末至有大量晶体析出,过滤得到Na2S2O4粗品(实验中须使用的试剂:SO2、1mol·L-1NaOH溶液)。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是

(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是

Ⅱ.锌粉还原法
已知:①Zn+2H2SO3
 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;②二价锌在水溶液中的存在形式与pH的关系如图所示。

(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,
您最近一年使用:0次
2024-02-22更新
|
346次组卷
|
2卷引用:江苏省南通市如东中学,如东一高等四校2023-2024学年高三上学期12月学情调研化学试题
名校
7 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+),实现镍、钴、镁元素的回收。
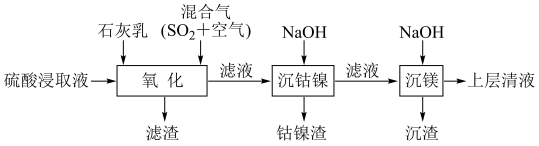
回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为___________ 。(答出一条即可)
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:___________ 。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为___________ 。(H2SO5的电离第一步完全,第二步微弱)
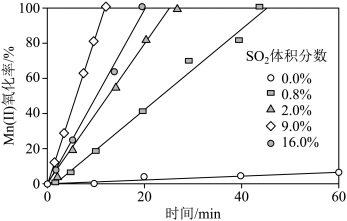
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。
(5)将“钴镍渣”酸溶后,进行如下流程:
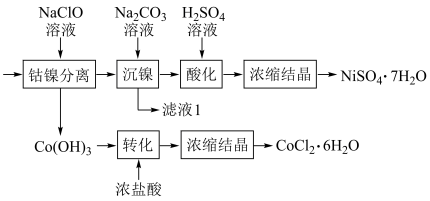
①写出“钴镍分离”时发生反应的离子方程式:___________ 。
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=___________ (要求写出计算过程)。[已知:Ksp(NiCO3)=1.0×10-7,沉镍率= ]
]

回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是

(5)将“钴镍渣”酸溶后,进行如下流程:

①写出“钴镍分离”时发生反应的离子方程式:
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO
 )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率= ]
]
您最近一年使用:0次
名校
解题方法
8 . 关于氢能源制取和CO2减排和成为研究热点。
(一)热解H2S制H2.根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(s) 2H2(g)+S2(g);ΔH1=170kJ·mol-1
2H2(g)+S2(g);ΔH1=170kJ·mol-1
Ⅱ.CH4(g)+S2(g) CS2(g)+2H2(g);ΔH2=64kJ·mol-1
CS2(g)+2H2(g);ΔH2=64kJ·mol-1
总反应:Ⅲ.2H2S(g)+CH4(g) CS2(g)+4H2(g)
CS2(g)+4H2(g)
投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
(1)①已知ΔG=ΔH-TΔS,当ΔG<0时,反应Ⅲ能自发进行的条件是___________ 。
②在950~1150℃范围内(其他条件不变),S2(g)的体积分数随温度升高的变化是___________ (填“先升高后降低”或“先降低后升高”),分析原因:___________ 。
(二)我国科学家研究LiCO2电池,在获得能量的同时可以达到碳固定的目的。LiCO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行。
Ⅰ.2CO2+2e-=C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ.___________
Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
(2)写出步骤Ⅲ的离子方程式________ 。
(三)科研的工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳减排的目标,如图所示。
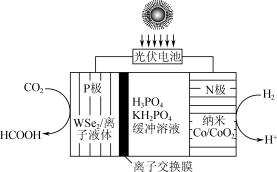
(3)①离子交换膜为质子交换膜,当消耗标准状况下11.2LH2时,P极电解液质量变化情况为___________ 。
②光伏电池中涉及NOCl光化学分解反应,在一定频率(ν)光的照射下机理如下:NOCl+hν→NOCl*、NOCl+NOCl*→2NO+Cl2,其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收___________ mol光子。
(四)已知反应CO2(g)+H2(g) HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g)
HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g) HCOOH(g) K=2。
HCOOH(g) K=2。
(4)实验测得v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T2℃时,k正=1.8k逆,则T2℃>T1℃,请通过计算说明原因:___________ 。
(一)热解H2S制H2.根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(s)
 2H2(g)+S2(g);ΔH1=170kJ·mol-1
2H2(g)+S2(g);ΔH1=170kJ·mol-1Ⅱ.CH4(g)+S2(g)
 CS2(g)+2H2(g);ΔH2=64kJ·mol-1
CS2(g)+2H2(g);ΔH2=64kJ·mol-1总反应:Ⅲ.2H2S(g)+CH4(g)
 CS2(g)+4H2(g)
CS2(g)+4H2(g)投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释;常压,不同温度下反应相同时间后,测得H2和CS2体积分数如下表:
| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
| H2/V(%) | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
| CS2/V(%) | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
(1)①已知ΔG=ΔH-TΔS,当ΔG<0时,反应Ⅲ能自发进行的条件是
②在950~1150℃范围内(其他条件不变),S2(g)的体积分数随温度升高的变化是
(二)我国科学家研究LiCO2电池,在获得能量的同时可以达到碳固定的目的。LiCO2电池中,Li为单质锂片。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行。
Ⅰ.2CO2+2e-=C2O

Ⅱ.C2O
 =CO2+CO
=CO2+CO
Ⅲ.___________
Ⅳ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3(2)写出步骤Ⅲ的离子方程式
(三)科研的工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳减排的目标,如图所示。

(3)①离子交换膜为质子交换膜,当消耗标准状况下11.2LH2时,P极电解液质量变化情况为
②光伏电池中涉及NOCl光化学分解反应,在一定频率(ν)光的照射下机理如下:NOCl+hν→NOCl*、NOCl+NOCl*→2NO+Cl2,其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收
(四)已知反应CO2(g)+H2(g)
 HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g)
HCOOH(g);ΔH<0。温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应CO2(g)+H2(g) HCOOH(g) K=2。
HCOOH(g) K=2。(4)实验测得v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。温度为T2℃时,k正=1.8k逆,则T2℃>T1℃,请通过计算说明原因:
您最近一年使用:0次
名校
9 . 化合物H(磷酸奥司他韦)适用于流感病毒的治疗,尤其对甲流效果明显,部分合成路线如下:
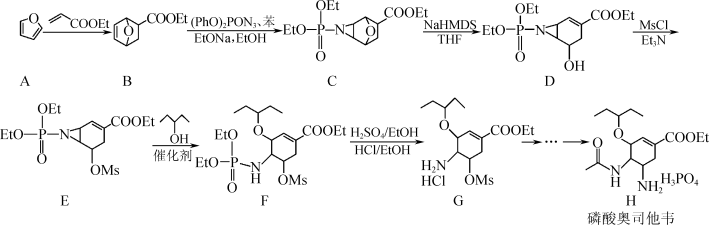
注:Et-:C2H5-;Ms-: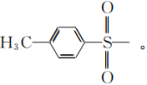
(1)H中含氧官能团的名称为醚键、___________ ;A→B的反应类型为___________ 。
(2)D→E反应中使用Et3N的作用为___________ 。
(3)E转化为F时有副产品M(与F互为同分异构体)生成,M的结构简式为___________ 。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________ 。
①分子中含有3种不同化学环境的氢原子;
②不能与FeCl3发生显色反应;
③1mol该同分异构体能与活泼金属钠反应产生1.5molH2。
(5)写出以 、CH3CH2OH、(PhO)2PON3为原料制备
、CH3CH2OH、(PhO)2PON3为原料制备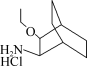 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。__________

注:Et-:C2H5-;Ms-:

(1)H中含氧官能团的名称为醚键、
(2)D→E反应中使用Et3N的作用为
(3)E转化为F时有副产品M(与F互为同分异构体)生成,M的结构简式为
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①分子中含有3种不同化学环境的氢原子;
②不能与FeCl3发生显色反应;
③1mol该同分异构体能与活泼金属钠反应产生1.5molH2。
(5)写出以
 、CH3CH2OH、(PhO)2PON3为原料制备
、CH3CH2OH、(PhO)2PON3为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
您最近一年使用:0次
名校
10 . 锰元素能形成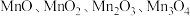 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为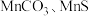 ),和软锰矿(主要成分为
),和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
已知: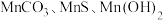 常温下皆为难溶于水的固体,硫化氢
常温下皆为难溶于水的固体,硫化氢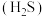 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
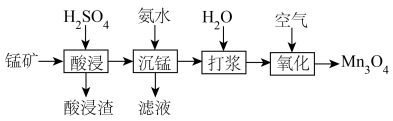
(1)“酸浸”: 溶于硫酸的离子方程式:
溶于硫酸的离子方程式:___________ 。
(2)“打浆”:将所得 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是___________ 。
(3)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
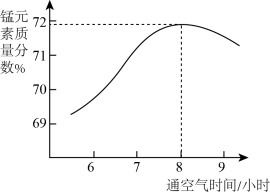
通空气超过8小时,产物中锰元素质量分数减小的原因是___________ 。
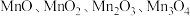 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为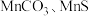 ),和软锰矿(主要成分为
),和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。已知:
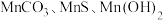 常温下皆为难溶于水的固体,硫化氢
常温下皆为难溶于水的固体,硫化氢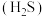 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
(1)“酸浸”:
 溶于硫酸的离子方程式:
溶于硫酸的离子方程式:(2)“打浆”:将所得
 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是(3)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。

通空气超过8小时,产物中锰元素质量分数减小的原因是
您最近一年使用:0次



