1 . 某地出产的矿石A可看作由主要成分硅酸铜盐X·7H2O (摩尔质量=406 g·mol-1 )与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液I和II中滴入KSCN溶液,前者无现象,后者显血红色。所有数据均已折算为标准状况。
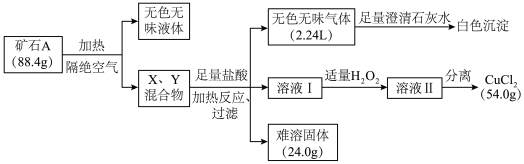
请回答:
(1)写出Y中除氧以外的元素符号_________ ,X的化学式为________ 。
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式________ ; 加足量H2O2后对溶液II进行分离,可得到该元素的氧化物Z 4.0g,写出杂质Y与盐酸反应的化学方程式________ 。
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式________ 。
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成__________ 。

请回答:
(1)写出Y中除氧以外的元素符号
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成
您最近一年使用:0次
2 . 高钴酸钠是钴元素目前发现的最高价化合物,实验室可通过电解硫酸钠与氯化钴的混合溶液获得氧化亚钴(CoO),并通过一系列反应来制备高钴酸钠,相关化学方程式如下:
CoCl2+H2O CoO↓+H2↑+Cl2↑;
CoO↓+H2↑+Cl2↑;
CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为______ mL。
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为________ (计算结果并写出计算过程)。
CoCl2+H2O
 CoO↓+H2↑+Cl2↑;
CoO↓+H2↑+Cl2↑;CoO+O2 → Co3O4 (未配平)
Co3O4+Na2O+O2→Na3CoO4 (未配平)
请计算:
(1)以氯化钴为原料制备1.920 g的高钴酸钠,消耗标准状况下氧气的体积为
(2)若电解过程转移电子共0.100 mol,两极收集到气体标准状况下总体积2.016 L (不考虑气体的溶解),则可制得高钴酸钠的质量为
您最近一年使用:0次
3 . 请回答下列问题。
(1)金属铝的卤化物熔点如下表:
请画出其中不属于分子晶体的卤化铝的电子式_______ ,加热分解某种铵盐X,可以1:3的物质的量比获得该卤化铝与一种离子化合物Y,Y的阳离子与阴离子具有相同的核外电子数,写出X的化学式_______ 。
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因________ 。
(1)金属铝的卤化物熔点如下表:
| 化学式 | AlF3 | AlCl3 | AlBr3 | AlI3 |
| 熔点/°C | 1290 | 180 | 97.5 | 188 |
请画出其中不属于分子晶体的卤化铝的电子式
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因
您最近一年使用:0次
解题方法
4 . 我国承诺 2030年前做到“碳达峰和碳中和”,这里的碳主要指CO2, CO2与我们生活和生产息息相关。请回答:
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g) CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1
II. CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
副反应:
III. CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
IV. 2CH3OH(g) CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
请回答:
①△H3=________ kJ·mol-1。
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x= ,则理论上x=
,则理论上x=_______ 时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是___________ 。
(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g) CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
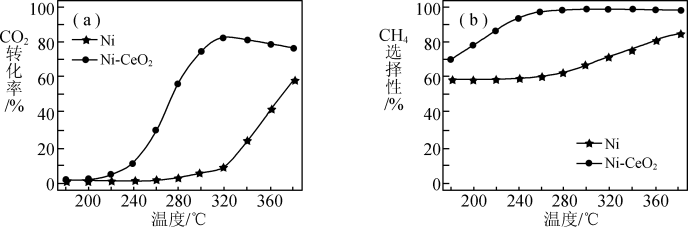
下列说法正确的是 。
(3)CO2可以与环氧丙烷反应合成碳酸丙烯酯:
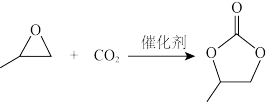 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1
通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):
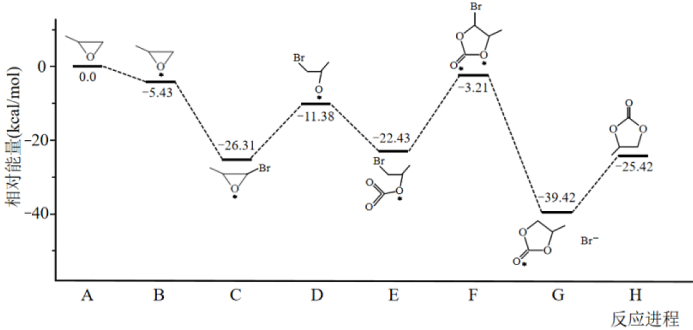
①决定总反应速率大小的步骤是______ (用图中字母表示), 该步骤的能垒(活化能)为_________ 。
②下列说法正确的是__________ 。
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
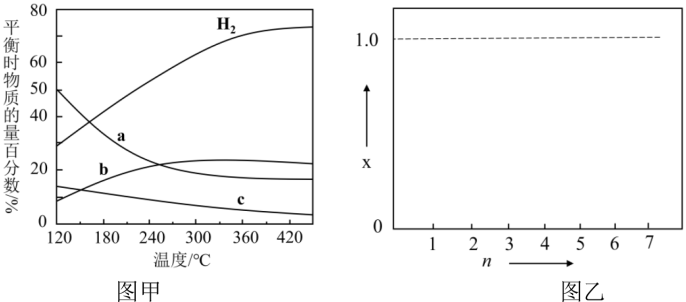
在120°C达到平衡时,CO2的转化率为________ ;若H2和CO2的物质的量之比为 n:1 (n≥3)进行投料,温度控制为120°C,相应平衡体系中CO2的转化率为x,在图乙中绘制x随n (n≥3 )变化的示意图________ (标出曲线的起点坐标)。
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g)
 CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1II. CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1副反应:
III. CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3IV. 2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1请回答:
①△H3=
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x=
 ,则理论上x=
,则理论上x=(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
下列说法正确的是 。
| A.高于320°C后,以Ni- CeO2为催化剂,CO2转化率略有下降的原因一定是CO2甲烷化反应已达平衡,升高温度平衡右移 |
| B.高于320°C后,以Ni为催化剂,CO2转化率上升的原因一定是CO2甲烷化反应速率较慢,升高温度反应速率加快,反应相同时间时CO2转化率增加 |
| C.工业上应选择的催化剂是Ni- CeO2 |
| D.工业上应使用的合适温度为360°C |
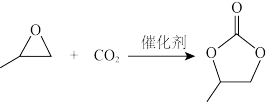 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):

①决定总反应速率大小的步骤是
②下列说法正确的是
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
在120°C达到平衡时,CO2的转化率为
您最近一年使用:0次
解题方法
5 . 工业上可用粗硅(含有铁、铝、硼、磷等杂质)与干燥的HCl气体反应制SiHCl3:Si+3HCl = SiHCl3+H2,SiHCl3可与过量H2在1000~1100°C反应制得纯硅。有关物质的物理常数见下表:
请回答:
(1)粗硅与HCl反应完全后的混合物冷却到标准状况,可通过________ 操作提纯得到SiHCl3。
(2)实验室也可以采用如右图装置(加热、夹持及尾气处理装置均略去)用SiHCl3与过量干燥H2反应制取纯硅。
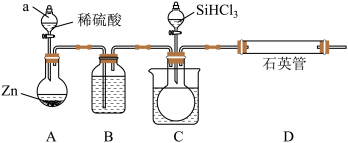
①仪器a的名称为_______ , 装置 B中的试剂为________ 。
②装置C为水浴加热,目的是________ , 反应一段时间后,D中可以观察到晶体硅生成,同时生成一种气体产物,写出其化学式_______ 。
③为保证实验安全,加热D装置前必须完成的操作是_________ 。
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | SiHCl3 | PCl5 |
| 沸点/°C | 57.7 | 12.8 | —— | 315 | 33.0 | —— |
| 熔点/°C | -70.0 | -107.2 | —— | —— | -126.5 | —— |
| 升华温度/°C | —— | —— | 180 | 300 | —— | 162 |
(1)粗硅与HCl反应完全后的混合物冷却到标准状况,可通过
(2)实验室也可以采用如右图装置(加热、夹持及尾气处理装置均略去)用SiHCl3与过量干燥H2反应制取纯硅。

①仪器a的名称为
②装置C为水浴加热,目的是
③为保证实验安全,加热D装置前必须完成的操作是
您最近一年使用:0次
解题方法
6 . 利用烧结的铁碳混合材料可除去废水中的污染物,在有、无溶解氧的情况下均可在溶液中生成絮凝剂,实现高效工作,其作用原理图示如下:
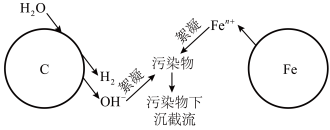
请回答:
(1)写出铁电极上电极方程式_________ 。
(2)下列叙述正确的是。
(3)有溶解氧时絮凝过程是利用了铁离子水解产物吸附污染物完成截流,写出相关的离子方程式_______ 。
(4)无溶解氧时,可以利用生成的絮凝剂处理含铬废水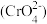 ,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为
,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为________ (以铬元素的量计算)。

请回答:
(1)写出铁电极上电极方程式
(2)下列叙述正确的是。
| A.铁电极为正极,碳电极为负极 |
| B.经过加热烧结的铁碳混合物表面空隙发达,吸附能力大幅提高,有利除污 |
| C.碳电极上的反应环境为无溶解氧环境 |
| D.铁碳混合材料工作过程中电子从铁电极流出,被絮凝剂运输至碳电极表面 |
(4)无溶解氧时,可以利用生成的絮凝剂处理含铬废水
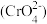 ,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为
,最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为mg·L-1,若每处理10.0 m3污水,电极上共转移1.20 mol电子,则该污水在处理前的排放浓度为
您最近一年使用:0次
解题方法
7 . 将硫酸铜的稀溶液放在密闭容器中,缓缓抽去容器中的水蒸气,溶液逐渐失水变成饱和溶液,再继续抽气,则变成各种含水盐,最后变成无水硫酸铜。50°C时,容器中的压强与晶体水合物中含水量的关系如图所示,下列说法错误的是
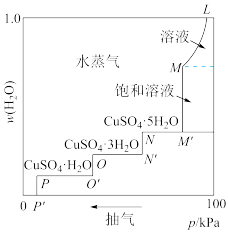

| A.由图可推测五水硫酸铜中,五个结晶水的化学环境不完全相同 |
| B.曲线M-M′对应溶液溶质的质量分数保持不变 |
C.曲线M′-N对应体系存在平衡:CuSO4(饱和溶液) CuSO4·5H2O(s)+ H2O(g) CuSO4·5H2O(s)+ H2O(g) |
| D.当容器中压强低于p′后得到无水硫酸铜 |
您最近一年使用:0次
解题方法
8 . 已知三氟化氯(ClF3)是 一种极强的氧化剂和氟化剂,能与大多数有机和无机材料甚至塑料反应,可以使许多材料不接触火源就燃烧。下列推测不合理的是
| A.ClF3与水按照1∶2反应只生成一种弱酸和一种强酸 |
| B.可以代替H2O2充当火箭推进剂中的氧化剂 |
| C.三氟化氯分子中电子分布不均匀,属于极性分子,所以它的空间构型不可能为平面正三角形,一定是类似氨分子的三角锥形 |
| D.能与一些金属反应生成氯化物和氟化物 |
您最近一年使用:0次
9 . 反电渗析是用离子交换膜将海水与淡水隔开,阴阳离子在溶液中定向移动将盐差能转化为电能的电池,原理如图所示。下列叙述错误的是
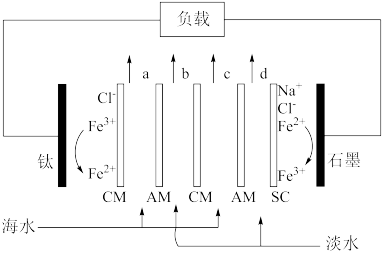

| A.电流由钛电极经负载、石墨电极、电解质溶液回到钛电极 |
| B.CM膜为阳离子交换膜,AM膜为阴离子交换膜 |
| C.该电池经过放电后,ac 出口变为淡水,bd出口变为海水 |
| D.该装置由于未涉及化学能转换,故不是有效的电池 |
您最近一年使用:0次
10 . 高氯酸、硫酸、盐酸和硝酸都是强酸,其酸性在水溶液中差别不大。表中是某温度下这四种酸在冰醋酸中的电离常数:
从表格中数据判断以下说法中正确的是
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6 ×10-5 | 6.3 ×10-9 | 1.6 ×10-9 | 4.2 ×10-10 |
A.硫酸在冰醋酸中的电离方程式:H2SO4 2H+ + 2H+ + |
| B.若将冰醋酸换成液氨,也可以区分四种酸的强弱 |
| C.从酸碱质子理论出发,四种酸的酸性在水中差别不大的原因是:水分子的碱性过强 |
| D.从酸碱质子理论出发,当纯硫酸和纯硝酸混合时,硝酸有可能被质子化 |
您最近一年使用:0次



