名校
1 . 下列叙述正确的是
| A.水晶、玻璃、水泥都是硅酸盐材料 |
| B.纤维素、维生素C、聚乳酸都是高分子化合物 |
| C.二氧化硫是导致酸雨、光化学烟雾的有害气体之一 |
| D.赤铁矿、磁铁矿、黄铁矿都是铁矿石 |
您最近一年使用:0次
2023-04-01更新
|
344次组卷
|
2卷引用:甘肃省华亭市第一中学2021-2022学年高一下学期期末考试化学试题
名校
2 . 下列叙述正确的是
| A.任何电解质熔化时均能导电 |
B.溶于水能电离产生 的电解质一定属于酸 的电解质一定属于酸 |
| C.氯化钠晶体不能导电,是由于其中不含离子 |
| D.在发生离子反应的反应物或生成物中,一定存在电解质 |
您最近一年使用:0次
2022-10-28更新
|
298次组卷
|
3卷引用:甘肃省平凉市庄浪县阳川中学2022-2023学年高一上学期期中测试化学试题
名校
解题方法
3 . 习近平总书记在世界领导人气候峰会上指出,中国将在2030年前实现“碳达峰”、2060年前实现“碳中和”。这是中国基于推动构建人类命运共同体的责任担当和实现可持续发展的内在要求作出的重大战略决策。因此 的捕集、创新利用与封存成为科学家研究的重要课题。
的捕集、创新利用与封存成为科学家研究的重要课题。
(1)最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把 从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如图:
从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如图:

上述工艺中采用气液逆流接触吸收(空气从吸收池底部进入,溶液从顶部喷淋),其目的是_______ 。写出吸收池中反应的化学方程式_______ 。
(2) 和
和 合成甲烷也是
合成甲烷也是 资源化利用的重要方法。一定条件下
资源化利用的重要方法。一定条件下 催化剂可使
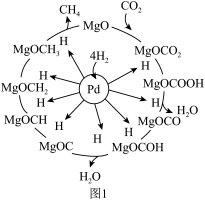
催化剂可使 “甲烷化”从而变废为宝,其反应机理如图1所示,该反应的化学方程式为
“甲烷化”从而变废为宝,其反应机理如图1所示,该反应的化学方程式为_______ ,反应过程中碳元素的化合价为-2价的中间体是_______ 。
(3)将 和
和 作为原料制造合成气的方法如下:200℃时,以镍合金为催化剂,向
作为原料制造合成气的方法如下:200℃时,以镍合金为催化剂,向 容器中通入
容器中通入 、
、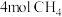 发生如下反应:
发生如下反应:
 。平衡体系中各组分体积分数如下表:
。平衡体系中各组分体积分数如下表:
①此温度下该反应的平衡常数
_______ 。
②为了探究反应 的反应速率与浓度的关系,起始时向恒容密闭容器中通入
的反应速率与浓度的关系,起始时向恒容密闭容器中通入 与
与 ,使其物质的量浓度均为
,使其物质的量浓度均为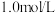 ,根据相关数据,粗略地绘制出两条速率—浓度关系曲线(如图):
,根据相关数据,粗略地绘制出两条速率—浓度关系曲线(如图):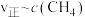 和
和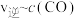 。则与
。则与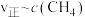 相对应曲线是图中
相对应曲线是图中_______ (填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时 、
、 相应的平衡点分别为
相应的平衡点分别为_______ (填字母)。
 的捕集、创新利用与封存成为科学家研究的重要课题。
的捕集、创新利用与封存成为科学家研究的重要课题。(1)最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把
 从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如图:
从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如图:
上述工艺中采用气液逆流接触吸收(空气从吸收池底部进入,溶液从顶部喷淋),其目的是
(2)
 和
和 合成甲烷也是
合成甲烷也是 资源化利用的重要方法。一定条件下
资源化利用的重要方法。一定条件下 催化剂可使
催化剂可使 “甲烷化”从而变废为宝,其反应机理如图1所示,该反应的化学方程式为
“甲烷化”从而变废为宝,其反应机理如图1所示,该反应的化学方程式为
(3)将
 和
和 作为原料制造合成气的方法如下:200℃时,以镍合金为催化剂,向
作为原料制造合成气的方法如下:200℃时,以镍合金为催化剂,向 容器中通入
容器中通入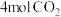 、
、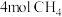 发生如下反应:
发生如下反应:
 。平衡体系中各组分体积分数如下表:
。平衡体系中各组分体积分数如下表:| 物质 |  |  | CO |  |
| 体积分数 | 0.3 | 0.3 | 0.2 | 0.2 |

②为了探究反应
 的反应速率与浓度的关系,起始时向恒容密闭容器中通入
的反应速率与浓度的关系,起始时向恒容密闭容器中通入 与
与 ,使其物质的量浓度均为
,使其物质的量浓度均为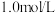 ,根据相关数据,粗略地绘制出两条速率—浓度关系曲线(如图):
,根据相关数据,粗略地绘制出两条速率—浓度关系曲线(如图):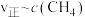 和
和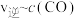 。则与
。则与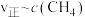 相对应曲线是图中
相对应曲线是图中 、
、 相应的平衡点分别为
相应的平衡点分别为
您最近一年使用:0次
2022-10-27更新
|
201次组卷
|
2卷引用:甘肃省平凉市第一中学2022-2023学年高二上学期第一次月考化学试题
解题方法
4 . 某科研小组研制了一种通过电解将草酸(HOOC-COOH)转化为羟基乙酸(HOCH2COOH)的装置。固体聚合物为两面分别是以Y2O3为基质的阳极和TiO2涂覆的阴极,H+可通过固体聚合物电解质。其装置如图所示,下列说法错误的是
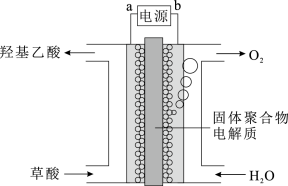

| A.电源的a极为负极 |
| B.电解池工作时,H+通过固体聚合物电解质向右移动 |
| C.为增强阳极电解液的导电性,可在水中添加适量Na2SO4 |
| D.阴极上的电极反应式为HOOC-COOH+4H++4e-=HOCH2COOH+H2O |
您最近一年使用:0次
2022-06-17更新
|
373次组卷
|
3卷引用:甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题
甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题河南省八市重点高中2021-2022学年高三下学期开学考试理综化学试题(已下线)第19讲 电解池 金属的电化学腐蚀与防护(练)-2023年高考化学一轮复习讲练测(全国通用)
解题方法
5 . 一种由X转化为Z的合成路线如图,下列有关化合物X、Y和Z的说法正确的是
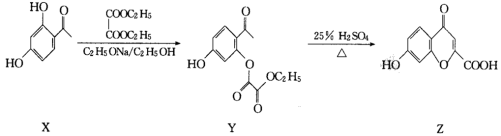

| A.Z中含有4种官能团 |
| B.Y的分子式为C11H10O6 |
| C.相同条件下,等物质的量的X、Y、Z与足量Na反应生成的气体体积之比为2:1:1 |
| D.Z既能使溴水褪色又能使酸性KMnO4溶液褪色 |
您最近一年使用:0次
2022-06-17更新
|
173次组卷
|
2卷引用:甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题
6 . 过二硫酸钾( )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
实验(一):探究过二硫酸钾的强氧化性。
探究 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:
(1)同学甲用碰撞理论分析,实验Ⅰ中 和
和 反应很慢的主要原因是
反应很慢的主要原因是___________
(2)同学乙猜想实验Ⅱ中 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:
(ⅰ)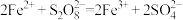 ;(ⅱ)___________。
;(ⅱ)___________。
①补充反应(ⅱ):___________ 。
②请你设计实验证明同学乙的猜想:___________ 。
(3)查阅文献知,氧化性: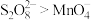 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是___________ ,该反应的离子方程式为___________ 。
实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
取适量的 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(4)加热之前,先通入一段时间 ,当观察到D中
,当观察到D中___________ (填实验现象)时点燃酒精灯。
(5)B中U形管收集的物质是___________ (填化学式)。
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为___________ 。
 )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。实验(一):探究过二硫酸钾的强氧化性。
探究
 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:| 实验 | 操作 | 现象 |
| Ⅰ | 在10L含淀粉的 的 的 溶液中滴加 溶液中滴加   溶液 溶液 | 一段时间后,溶液缓慢变蓝 |
| Ⅱ | 在 含淀粉的 含淀粉的 的 的 溶液中先滴几滴 溶液中先滴几滴 的 的 溶液,再滴加 溶液,再滴加   溶液 溶液 | 溶液迅速变蓝 |
 和
和 反应很慢的主要原因是
反应很慢的主要原因是(2)同学乙猜想实验Ⅱ中
 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:(ⅰ)
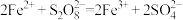 ;(ⅱ)___________。
;(ⅱ)___________。①补充反应(ⅱ):
②请你设计实验证明同学乙的猜想:
(3)查阅文献知,氧化性:
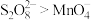 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
| 气体 |  |  |  |
| 熔点/℃ | 16.8 | -72.7 | -218.4 |
| 沸点/℃ | 44.8 | -10 | -182.9 |
 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(4)加热之前,先通入一段时间
 ,当观察到D中
,当观察到D中(5)B中U形管收集的物质是
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中
 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为
您最近一年使用:0次
2022-04-13更新
|
533次组卷
|
5卷引用:甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题
甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题陕西省榆林市2022届高三第二次联考化学试题(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)甘肃省兰州第一中学2022-2023学年高三上学期期中考试化学试题热点1物质性质探究类实验
解题方法
7 . 铁及含铁的化合物在生产生活中的应用广泛。回答下列问题:
(1)基态铁原子的核外电子排布式为___________ 。前四周期元素中,基态原子未成对电子数比铁原子多的元素有___________ 种。
(2)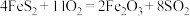 是工业制硫酸的主要反应,
是工业制硫酸的主要反应, 的VSEPR模型名称是
的VSEPR模型名称是___________ ; 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为___________ 。
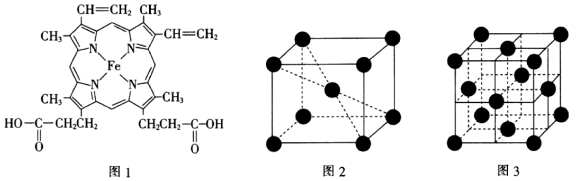
(3)血红素是血红蛋白的辅基,其结构如图1所示,结构中C原子的杂化方式为___________ ,所含非金属原子的电负性由大到小的顺序为___________ ;所含化学键的类型有___________ (填标号)。
a.极性键 b.非极性键 c.氢键 d.配位键 e.金属键
(4)温度在1183K以下,纯铁晶体(甲)的晶胞结构如图2所示,温度在1183K以上,纯铁晶体(乙)的晶胞结构如图3所示,两种晶体中铁原子之间的最短距离相等,甲晶体中铁原子的配位数与乙晶体中铁原子的配位数之比为___________ ;甲晶体的晶胞边长与乙晶体的晶胞边长之比为___________ ;甲晶体的密度与乙晶体的密度之比为___________ 。
(1)基态铁原子的核外电子排布式为
(2)
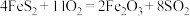 是工业制硫酸的主要反应,
是工业制硫酸的主要反应, 的VSEPR模型名称是
的VSEPR模型名称是 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为(3)血红素是血红蛋白的辅基,其结构如图1所示,结构中C原子的杂化方式为
a.极性键 b.非极性键 c.氢键 d.配位键 e.金属键

(4)温度在1183K以下,纯铁晶体(甲)的晶胞结构如图2所示,温度在1183K以上,纯铁晶体(乙)的晶胞结构如图3所示,两种晶体中铁原子之间的最短距离相等,甲晶体中铁原子的配位数与乙晶体中铁原子的配位数之比为
您最近一年使用:0次
2022-03-17更新
|
659次组卷
|
4卷引用:甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题
解题方法
8 . 氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。
已知:H—H键、O=O键、H—O键的键能依次为436kJ·mol-1、495kJ·mol-1、463kJ·mol-1。则2H2O(g)=2H2(g)+O2(g) △H=____ kJ·mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为____ ;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=____ mol·L-1·s-1。
(3)CH4分解时几种气体的平衡分压(ρPa)的对数值lgp与温度的关系如图所示。

①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H2(g)和H2(g),只发生反应2CH4(g) C2H2(g)+3H2(g) △H,△H
C2H2(g)+3H2(g) △H,△H____ (填“>”或“<”)0,此时的平衡常数Kp=____ (用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是____ (填标号)。
A.减小C2H2的浓度 B.升高温度 C.增大压强 D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为____ ,一段时间后阴、阳两极收集到的气体质量之比为____ 。
(1)利用光伏电池电解水制H2是氢能的重要来源。
已知:H—H键、O=O键、H—O键的键能依次为436kJ·mol-1、495kJ·mol-1、463kJ·mol-1。则2H2O(g)=2H2(g)+O2(g) △H=
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为(3)CH4分解时几种气体的平衡分压(ρPa)的对数值lgp与温度的关系如图所示。

①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H2(g)和H2(g),只发生反应2CH4(g)
 C2H2(g)+3H2(g) △H,△H
C2H2(g)+3H2(g) △H,△H②若只改变一个反应条件使Kp变大,则该条件是
A.减小C2H2的浓度 B.升高温度 C.增大压强 D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为
您最近一年使用:0次
2022-02-20更新
|
187次组卷
|
3卷引用:甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题
名校
解题方法
9 . 用K2Cr2O7固体配制K2Cr2O7溶液,并用Na2S2O3溶液标定K2Cr2O7溶液的浓度,主要操作步骤:先称量3.0 g K2Cr2O7固体,再配成一定物质的量浓度的K2Cr2O7溶液,后加入过量KI和适量稀硫酸,充分反应后,用标准Na2S2O3溶液滴定。上述操作中,不需要使用的仪器是
A.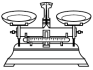 | B. | C. | D.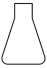 |
您最近一年使用:0次
2022-02-20更新
|
347次组卷
|
5卷引用:甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题
名校
解题方法
10 . 2021年国务院政府工作报告指出,要扎实做好碳中和、碳达峰的各项工作,以减少或消除二氧化碳等温室气体对气候的影响。下列措施能实现碳中和且可行的是
①通过植树造林捕捉二氧化碳②禁止使用煤和石油等化石能源③大力发展风能、太阳能等新型能源④工业中用碱石灰吸收 ⑤绿色出行,减少燃油车的使用
⑤绿色出行,减少燃油车的使用
①通过植树造林捕捉二氧化碳②禁止使用煤和石油等化石能源③大力发展风能、太阳能等新型能源④工业中用碱石灰吸收
 ⑤绿色出行,减少燃油车的使用
⑤绿色出行,减少燃油车的使用| A.①③④⑤ | B.①②③④ | C.②③④⑤ | D.①②④⑤ |
您最近一年使用:0次
2021-06-17更新
|
661次组卷
|
7卷引用:甘肃省华亭市第一中学2021-2022学年高一下学期期末考试化学试题



