名校
解题方法
1 . 歼-20飞机的某铁铝合金零件取7.2 g,全部溶于足量的稀硝酸中,产生的气体体积为 L(标准状况)。向所得溶液中加过量的NaOH溶液,过滤得滤液Ⅰ及红褐色沉淀。小心收集沉淀,洗涤、干燥、称重得
L(标准状况)。向所得溶液中加过量的NaOH溶液,过滤得滤液Ⅰ及红褐色沉淀。小心收集沉淀,洗涤、干燥、称重得 g,再加热分解至恒重,得固体质量为7.2 g。下列说法错误的是
g,再加热分解至恒重,得固体质量为7.2 g。下列说法错误的是
 L(标准状况)。向所得溶液中加过量的NaOH溶液,过滤得滤液Ⅰ及红褐色沉淀。小心收集沉淀,洗涤、干燥、称重得
L(标准状况)。向所得溶液中加过量的NaOH溶液,过滤得滤液Ⅰ及红褐色沉淀。小心收集沉淀,洗涤、干燥、称重得 g,再加热分解至恒重,得固体质量为7.2 g。下列说法错误的是
g,再加热分解至恒重,得固体质量为7.2 g。下列说法错误的是| A.合金中Fe与Al的物质的量之比为7∶3 |
B.红褐色沉淀质量 |
C.如果产生的气体只有NO,则气体体积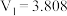 |
D.滤液Ⅰ主要成分为NaOH、 、 、 |
您最近一年使用:0次
名校
2 . 已知R、S、T、W为原子序数依次增大的前四周期元素,R、S为同周期相邻元素,R原子的核外电子数等于T原子的最外层电子数,R、T原子的核外电子数之和为S原子的核外电子数的3倍。W的单质为红色固体。下列说法正确的是
| A.R能形成氢化物只有一种 |
| B.S、T可形成一种常用消毒剂 |
| C.W单质与T单质反应形成的化合物是WT |
| D.R的最高价氧化物对应的水化物为弱酸 |
您最近一年使用:0次
名校
3 . 下列各组离子在指定溶液中一定能大量共存的是
①无色溶液中:K+、Na+、 、OH-
、OH-
②pH=11的溶液中: 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、Al3+、 、
、
④酸性溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、 、SCN-、Fe2+
、SCN-、Fe2+
⑥酸性溶液中:Fe3+、Al3+、I-、Cl-
①无色溶液中:K+、Na+、
 、OH-
、OH-②pH=11的溶液中:
 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、Al3+、
 、
、
④酸性溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、
 、SCN-、Fe2+
、SCN-、Fe2+⑥酸性溶液中:Fe3+、Al3+、I-、Cl-
| A.②③ | B.②④ | C.③⑥ | D.①⑤ |
您最近一年使用:0次
名校
4 . 有7种短周期元素,原子半径及主要化合价如表,下列说法正确的是:
| 元素代号 | X | Y | Z | M | W | Q | R |
| 原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
| 主要化合价 | +1 | +3 | +6,-2 | +7,-1 | +5,-3 | -2 | +1 |
| A.R可能为金属元素 |
| B.X、Z可以形成多种化合物 |
C.离子半径: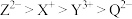 |
| D.Z的简单氢化物稳定性强于M的简单氢化物 |
您最近一年使用:0次
名校
解题方法
5 . 下列离子方程式正确的是
A.将氧气通入酸性碘化钾溶液中: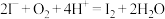 |
| B.腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+ |
C. 溶液中通入少量 溶液中通入少量 : : |
D.氯气溶于水: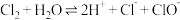 |
您最近一年使用:0次
名校
6 . A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E地壳中含量最高的金属元素。
(1)E元素在周期表中的位置为_______ ;E的单质和氧化铁反应可用于野外焊接钢轨,写出反应的化学方程式_______ ;该反应属于_______ (填“吸热”或“放热”)反应。
(2)五种元素原子半径由大到小的顺序是(写元素符号)_______ ;W、D、E的简单离子半径由大到小的顺序是_______ (写离子符号)。
(3)由A和W组成的10电子的分子以及阴离子的化学式_______ ;由A、B、W三种元素组成的18电子微粒的分子式为_______ 。
(4)已知D2W2为淡黄色固体,将过量D2W2投入到含有Fe2+的溶液中,有红褐色沉淀生成,写出该反应的离子方程式_______ 。
(5)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成,并且当消耗2molI-时,共转移的电子数为3mol,则该反应的离子方程式_______ 。
(6)元素D的单质在一定条件下与A单质生成DA,能与水反应生成A单质,若将1molDA和1molE的单质混合加入足量的水,充分反应,在标准状态下生成气体的体积_______ L。
(1)E元素在周期表中的位置为
(2)五种元素原子半径由大到小的顺序是(写元素符号)
(3)由A和W组成的10电子的分子以及阴离子的化学式
(4)已知D2W2为淡黄色固体,将过量D2W2投入到含有Fe2+的溶液中,有红褐色沉淀生成,写出该反应的离子方程式
(5)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成,并且当消耗2molI-时,共转移的电子数为3mol,则该反应的离子方程式
(6)元素D的单质在一定条件下与A单质生成DA,能与水反应生成A单质,若将1molDA和1molE的单质混合加入足量的水,充分反应,在标准状态下生成气体的体积
您最近一年使用:0次
名校
7 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如图装置进行实验:_______ →尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为_______ 。
③实验证明了气体产物中含有CO,依据的实验现象为_______ 。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是_______ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的实验现象为_______ 。
II.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL(已知: )。
)。
(4)步骤2中还涉及的离子方程式_______ ;步骤3中加入锌粉的目的_______ 。
(5)草酸亚铁样品的纯度为_______ (列出计算式即可);若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将_______ (填“偏高”、“偏低”或“不变”)。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
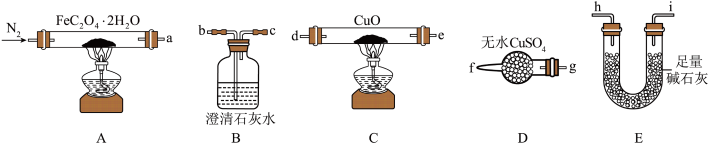
②检查装置气密性后,先通入一段时间N2,其目的为
③实验证明了气体产物中含有CO,依据的实验现象为
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的实验现象为
II.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL(已知:
 )。
)。(4)步骤2中还涉及的离子方程式
(5)草酸亚铁样品的纯度为
您最近一年使用:0次
名校
8 . 回答下列问题。
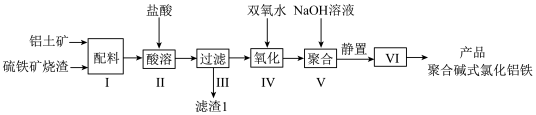
I.以铝土矿、硫铁矿烧渣为配料(主要成分为Al2O3、Fe2O3,含少量FeO、SiO2等)制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如图(提示:SiO2为难溶于盐酸的固体)。
(1)实验前,要将铝土矿粉碎的目的是_______ 。
(2)“滤渣1”的主要成分为_______ (填化学式)。
(3)步骤Ⅳ加入双氧水发生反应的离子方程式为_______ 。
(4)步骤V发生反应时溶液的pH=3,若pH过大,可能造成的影响是_______ 。
(5)测定聚合碱式氯化铝铁可表示为{[FeaAlb(OH)xCly]n}中 的比值的步骤如下:
的比值的步骤如下:
步骤1:准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体。
步骤2:另准确称取相同质量样品,溶于足量NaOH溶液讨滤,充分洗涤,将滤渣灼烧全质量不再变化,得到固体0.800g。
则产品中 为
为_______ (填最简整数比)。
Ⅱ.向一定量 、
、 溶液中滴加常用试剂
溶液中滴加常用试剂 与盐酸
与盐酸 点之前滴加的试剂为
点之前滴加的试剂为 点之后改滴试剂
点之后改滴试剂 ,沉淀的物质的量
,沉淀的物质的量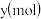 与试剂体积
与试剂体积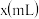 间的关系曲线如图所示:
间的关系曲线如图所示:____ ;CD段所表示的反应的离子方程式是_____ 。
(7)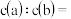
_______ ;原混合液中,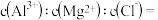
_______ 。
I.以铝土矿、硫铁矿烧渣为配料(主要成分为Al2O3、Fe2O3,含少量FeO、SiO2等)制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如图(提示:SiO2为难溶于盐酸的固体)。
(1)实验前,要将铝土矿粉碎的目的是
(2)“滤渣1”的主要成分为
(3)步骤Ⅳ加入双氧水发生反应的离子方程式为
(4)步骤V发生反应时溶液的pH=3,若pH过大,可能造成的影响是
(5)测定聚合碱式氯化铝铁可表示为{[FeaAlb(OH)xCly]n}中
 的比值的步骤如下:
的比值的步骤如下:步骤1:准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体。
步骤2:另准确称取相同质量样品,溶于足量NaOH溶液讨滤,充分洗涤,将滤渣灼烧全质量不再变化,得到固体0.800g。
则产品中
 为
为Ⅱ.向一定量
 、
、 溶液中滴加常用试剂
溶液中滴加常用试剂 与盐酸
与盐酸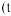 点之前滴加的试剂为
点之前滴加的试剂为 点之后改滴试剂
点之后改滴试剂 ,沉淀的物质的量
,沉淀的物质的量 与试剂体积
与试剂体积 间的关系曲线如图所示:
间的关系曲线如图所示: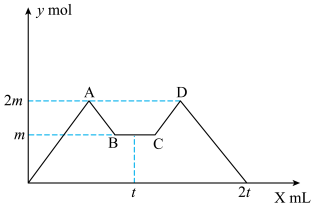
(7)
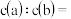
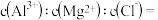
您最近一年使用:0次
名校
9 . 铁是人类较早使用的金属之一,下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。运用铁及其化合物的知识,回答下列问题。_______ ;E→F反应的化学方程式是_______ ,该反应过程的现象为_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点_______ ;湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式_______ 。
(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈_______ ,制得分散系为_______ ,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_______ 。
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点
 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是
您最近一年使用:0次
名校
解题方法
10 . 在500mL硫酸铁、硫酸铜的混合液中,金属阳离子的浓度均为 ,现加入amol铁粉,充分振荡反应后,下列说法不正确的是
,现加入amol铁粉,充分振荡反应后,下列说法不正确的是
 ,现加入amol铁粉,充分振荡反应后,下列说法不正确的是
,现加入amol铁粉,充分振荡反应后,下列说法不正确的是A.当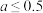 时,发生的反应为 时,发生的反应为 |
B.当 时,发生的反应为 时,发生的反应为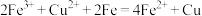 |
C.当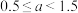 时,溶液中 时,溶液中 、 、 、 、 的物质的量之比为(1.5-a):(1+a):5 的物质的量之比为(1.5-a):(1+a):5 |
| D.当加入a为2.0时,此时反应中电子转移数目等于3NA |
您最近一年使用:0次



