名校
解题方法
1 . 下列有关反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4的说法中错误的是
| A.FeS2既是氧化剂又是还原剂 |
| B.CuSO4在反应中被还原 |
| C.被还原的S和被氧化的S的质量之比为7∶3 |
| D.14 mol CuSO4氧化了0.5 mol FeS2 |
您最近一年使用:0次
名校
2 . 人工合成某维生素(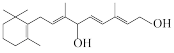 )的路线如下所示。
)的路线如下所示。
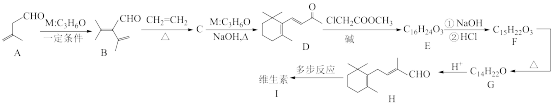
已知:①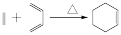 ;
;
②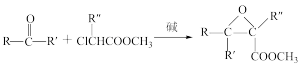 (R、R′、R″为H原子或烃基)。
(R、R′、R″为H原子或烃基)。
(1)有机物A与足量
 反应生成产物的名称为
反应生成产物的名称为(2)B→C的反应类型为
(3)D→E的化学方程式为
(4)F中含有
(5)G的同系物K分子式为
 ,其同分异构体中符合下列条件的有
,其同分异构体中符合下列条件的有①苯环上含有两个取代基 ②能与金属钠反应 ③存在两个甲基 ④水溶液呈中性
(6)参照上述合成路线,写出以氯乙酸甲酯(
 )和
)和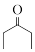 为主要原料合成
为主要原料合成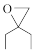 的路线。
的路线。
您最近一年使用:0次
2024-09-15更新
|
182次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2024-2025学年高三上学期9月月考化学试题
3 .  还原
还原 实现“双减”目标,涉及反应如下:
实现“双减”目标,涉及反应如下:
Ⅰ.

 ;
;
Ⅱ.
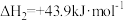
 。
。
回答下列问题:
(1)升高温度时, 将
将_______ (填“增大”“减少”或“不变”)。
(2)物质的标准摩尔生成焓是指在标准压力(100kPa)和某温度下,由元素最稳定的单质生成1mol该纯净物时的焓变。一些物质在298K时的标准摩尔生成焓( )如表所示。
)如表所示。

_______ 。
(3)阿伦尼乌斯公式为 (其中k为反应速率常数,A为比例系数,R为理想气体常数,
(其中k为反应速率常数,A为比例系数,R为理想气体常数, 为反应的活化能,e为自然对数的底,T为温度),反应Ⅰ的速率方程为
为反应的活化能,e为自然对数的底,T为温度),反应Ⅰ的速率方程为 ,
, ,增大体系的压强,
,增大体系的压强,
___ (填“增大”“减小”或“不变”)。
(4)一定条件下,向恒压密闭容器中以一定流速通入 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性[
选择性[ ]随温度、投料比的变化曲线如图所示。
]随温度、投料比的变化曲线如图所示。 选择性的曲线是
选择性的曲线是_______ (填“ ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是_______ 。
②生成 的最佳条件是
的最佳条件是_______ (填序号)。
a.220℃, b.220℃,
b.220℃,
c.320℃, d.320℃,
d.320℃,
(5)一定温度下,向恒压密闭容器中通入 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为a,
平衡转化率为a, 选择性为b,该温度下反应Ⅰ的平衡常数
选择性为b,该温度下反应Ⅰ的平衡常数
_______ ( 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。
 还原
还原 实现“双减”目标,涉及反应如下:
实现“双减”目标,涉及反应如下:Ⅰ.


 ;
;Ⅱ.

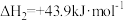
 。
。回答下列问题:
(1)升高温度时,
 将
将(2)物质的标准摩尔生成焓是指在标准压力(100kPa)和某温度下,由元素最稳定的单质生成1mol该纯净物时的焓变。一些物质在298K时的标准摩尔生成焓(
 )如表所示。
)如表所示。| 物质 |  |  |  |  |
 ( ( ) ) |  |  | 0 | 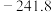 |

(3)阿伦尼乌斯公式为
 (其中k为反应速率常数,A为比例系数,R为理想气体常数,
(其中k为反应速率常数,A为比例系数,R为理想气体常数, 为反应的活化能,e为自然对数的底,T为温度),反应Ⅰ的速率方程为
为反应的活化能,e为自然对数的底,T为温度),反应Ⅰ的速率方程为 ,
, ,增大体系的压强,
,增大体系的压强,
(4)一定条件下,向恒压密闭容器中以一定流速通入
 和
和 混合气体,
混合气体, 平衡转化率和
平衡转化率和 选择性[
选择性[ ]随温度、投料比的变化曲线如图所示。
]随温度、投料比的变化曲线如图所示。
 选择性的曲线是
选择性的曲线是 ”或“
”或“ ”);
”); 平衡转化率随温度升高发生如图变化的原因是
平衡转化率随温度升高发生如图变化的原因是②生成
 的最佳条件是
的最佳条件是a.220℃,
 b.220℃,
b.220℃,
c.320℃,
 d.320℃,
d.320℃,
(5)一定温度下,向恒压密闭容器中通入
 和
和 ,充分反应后,测得
,充分反应后,测得 平衡转化率为a,
平衡转化率为a, 选择性为b,该温度下反应Ⅰ的平衡常数
选择性为b,该温度下反应Ⅰ的平衡常数
 为以物质的量分数表示的平衡常数)。
为以物质的量分数表示的平衡常数)。
您最近一年使用:0次
2024-09-15更新
|
202次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2024-2025学年高三上学期9月月考化学试题
名校
4 . 某小组设计实验制备 并测定产品纯度。
并测定产品纯度。
实验(一)制备 。
。
用如下装置制备氯化铁(部分夹持装置省略)。已知: 易升华,遇水蒸气易水解。
易升华,遇水蒸气易水解。______ →F(装置可以重复使用)。
(2)写出装置A中发生反应的离子方程式:______ 。
(3)盛放 的仪器名称为
的仪器名称为______ ,分液漏斗中橡胶管a的优点为______ 。
(4)C中所盛试剂的名称是______ ,作用是______ 。
实验(二)测定 样品的纯度。
样品的纯度。
已知: (无色,很稳定),AgF易溶于水且完全电离。
(无色,很稳定),AgF易溶于水且完全电离。
(5)实验步骤如下(已知杂质均不溶于水或不参与反应):
步骤1:准确称取5.0g样品,溶于水,滤去不溶物后,配成1000mL溶液,取10.00mL置于锥形瓶中;
步骤2:向锥形瓶中加入适量NaF溶液(恰好与铁离子完全反应),用力振荡,再加入20.00mL 0.1000mol/L 溶液(过量)使
溶液(过量)使 完全沉淀;
完全沉淀;
步骤3:向其中加入硝基苯,用力振荡;
步骤4:加入几滴 溶液,用0.1000mol/L
溶液,用0.1000mol/L  溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为12.71mL。已知:常温下,
溶液的体积为12.71mL。已知:常温下, ,
, 。
。
①滴定终点时锥形瓶内现象为______ 。
②若省略步骤3,测定结果将______ (填“偏大”、“偏小”或“无影响”)。
③测得样品中 的质量分数为
的质量分数为______ (保留2位有效数字)。
 并测定产品纯度。
并测定产品纯度。实验(一)制备
 。
。用如下装置制备氯化铁(部分夹持装置省略)。已知:
 易升华,遇水蒸气易水解。
易升华,遇水蒸气易水解。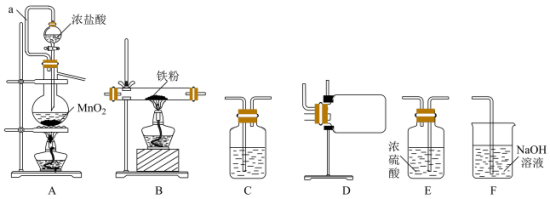
(2)写出装置A中发生反应的离子方程式:
(3)盛放
 的仪器名称为
的仪器名称为(4)C中所盛试剂的名称是
实验(二)测定
 样品的纯度。
样品的纯度。已知:
 (无色,很稳定),AgF易溶于水且完全电离。
(无色,很稳定),AgF易溶于水且完全电离。(5)实验步骤如下(已知杂质均不溶于水或不参与反应):
步骤1:准确称取5.0g样品,溶于水,滤去不溶物后,配成1000mL溶液,取10.00mL置于锥形瓶中;
步骤2:向锥形瓶中加入适量NaF溶液(恰好与铁离子完全反应),用力振荡,再加入20.00mL 0.1000mol/L
 溶液(过量)使
溶液(过量)使 完全沉淀;
完全沉淀;步骤3:向其中加入硝基苯,用力振荡;
步骤4:加入几滴
 溶液,用0.1000mol/L
溶液,用0.1000mol/L  溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为12.71mL。已知:常温下,
溶液的体积为12.71mL。已知:常温下, ,
, 。
。①滴定终点时锥形瓶内现象为
②若省略步骤3,测定结果将
③测得样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-09-15更新
|
132次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2024-2025学年高三上学期9月月考化学试题
名校
5 . 由钛铁矿(主要成分是钛酸亚铁: ,还含有少量
,还含有少量 、
、 等杂质),制备海绵钛的一种工艺流程示意如下:
等杂质),制备海绵钛的一种工艺流程示意如下: ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。
回答下列问题:
(1)浸渣为______ 。
(2)试剂X为______ (填化学式),X的作用是______ 。
(3)“操作Ⅱ”为______ 。
(4)“氯化”过程在高温条件下进行,发生反应的化学方程式为______ 。
(5)制备海绵钛中Ar的作用是______ 。
(6) 有三种类型晶体结构,其中一种晶胞结构如图所示。
有三种类型晶体结构,其中一种晶胞结构如图所示。______ 。
②晶胞中白球代表______ (填“钛”或“氧”),该晶体的密度为______  (用含a、b、
(用含a、b、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ,还含有少量
,还含有少量 、
、 等杂质),制备海绵钛的一种工艺流程示意如下:
等杂质),制备海绵钛的一种工艺流程示意如下: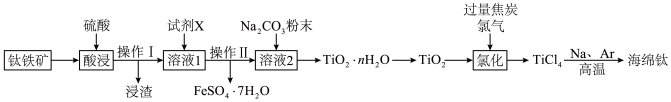
 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。回答下列问题:
(1)浸渣为
(2)试剂X为
(3)“操作Ⅱ”为
(4)“氯化”过程在高温条件下进行,发生反应的化学方程式为
(5)制备海绵钛中Ar的作用是
(6)
 有三种类型晶体结构,其中一种晶胞结构如图所示。
有三种类型晶体结构,其中一种晶胞结构如图所示。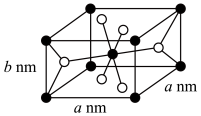
②晶胞中白球代表
 (用含a、b、
(用含a、b、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2024-09-15更新
|
127次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2024-2025学年高三上学期9月月考化学试题
名校
6 .  分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。(700℃左右有两个吸热峰。)
分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。(700℃左右有两个吸热峰。)
 分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。(700℃左右有两个吸热峰。)
分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。(700℃左右有两个吸热峰。)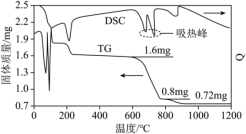
| A.0~400℃范围内,发生了化学变化 | B.600~800℃范围内,没有氧化还原反应发生 |
C.1000℃时,剩余固体的成分为 | D. 分解生成的气体可以用于制硫酸 分解生成的气体可以用于制硫酸 |
您最近一年使用:0次
2024-09-15更新
|
127次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2024-2025学年高三上学期9月月考化学试题
名校
7 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.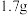 羟基和 羟基和 中含有的质子数均为 中含有的质子数均为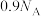 |
B. 含有的中子数为 含有的中子数为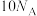 |
C. 乙烷和丙烯的混合气体中所含碳氢键数为 乙烷和丙烯的混合气体中所含碳氢键数为 |
D.常温下,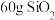 中含有Si—O极性键的数目为 中含有Si—O极性键的数目为 |
您最近一年使用:0次
2024-09-15更新
|
138次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2024-2025学年高三上学期9月月考化学试题
名校
解题方法
8 . 下列离子方程式能解释对应的实验事实的是
A.KI溶液滴入酸性 溶液中: 溶液中: |
B.向溴化亚铁溶液中通入足量氯气: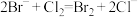 |
C.将过量 通入NaClO溶液中: 通入NaClO溶液中: |
D.用稀硝酸洗涤做过银镜反应的试管: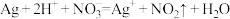 |
您最近一年使用:0次
名校
9 . 己二酸主要用作工程塑料的原料。实验室可用 氧化环己醇制备己二酸,其反应原理及实验过程如下:
氧化环己醇制备己二酸,其反应原理及实验过程如下: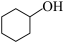
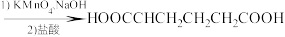 。
。
环己醇、高锰酸钾、10% NaOH溶液、
 和浓盐酸。
和浓盐酸。【步骤】
①在烧杯中加入5mL 10% NaOH溶液和50mL蒸馏水,在搅拌下加入6g高锰酸钾,待高锰酸钾溶解后,用滴管慢慢加入3mL环己醇,控制滴加速度;维持反应温度在45℃左右。滴加完毕后,维持反应5min左右,使氧化反应完全并使二氧化锰沉淀凝结。
②检验反应物。用玻璃棒蘸取一滴反应混合物点到滤纸上做点滴试验,如果有高锰酸盐存在,则在二氧化锰点的周围出现“紫色环”,可加入
 固体直到呈无色为止。
固体直到呈无色为止。③分离提纯产品。趁热过滤混合物,用少量热水洗涤滤渣X 3次,合并滤液与洗涤液,用约4mL浓盐酸酸化,使溶液呈强酸性。在石棉网上加热浓缩使溶液体积减少至10mL左右,加入少量活性炭脱色后趁热过滤,结晶,得到白色己二酸晶体。
请回答下列问题:
(1)步骤①中,烧杯的规格宜选择
A.50mL B.250mL C.500mL
(2)步骤①中,加热方式宜选择
(3)步骤②中,加入
 的目的是
的目的是(4)步骤③中,第一次趁热过滤(装置如图所示)的目的是
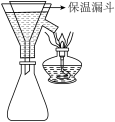
| A.还原性 | B.氧化性 | C.吸附性 | D.稳定性 |
(6)已知:己二酸在水中的溶解度与温度的关系如图所示:

您最近一年使用:0次
2024-08-21更新
|
68次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2024-2025学年高三上学期开学考试化学试题
名校
10 . 下列有关说法正确的是
| A.不同原子中,2p、3p、4p能级的轨道数相等 |
| B.同周期元素,从左到右,第一电离能依次增大 |
C.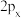 、 、 、 、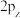 的能量不相等 的能量不相等 |
D.排布图 违反了泡利原理 违反了泡利原理 |
您最近一年使用:0次
2024-08-21更新
|
99次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2024-2025学年高三上学期开学考试化学试题



