1 . 减少 的排放、捕集并利用
的排放、捕集并利用 是我国能源领域的一个重要战略方向。
是我国能源领域的一个重要战略方向。
在 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:
反应i:
 kJ/mol
kJ/mol
反应ii:
 kJ/mol
kJ/mol
(1)反应iii: 的
的
___________ 。
(2)在 加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
(3)某温度下,向容积恒为1 L的密闭容器中通入1 mol 和5 mol
和5 mol  ,10 min后体系达到平衡,此时
,10 min后体系达到平衡,此时 的转化率为20%。
的转化率为20%。 的选择性为50%。[已知:
的选择性为50%。[已知: 的选择性:
的选择性: ]
]
①反应i的平衡常数
___________ (写出计算式即可)。
②反应ii的净速率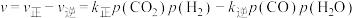 ,其中
,其中 、
、 分别为正、逆反应的速率常数,p为气体的分压。降低温度时,
分别为正、逆反应的速率常数,p为气体的分压。降低温度时,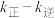
___________ (填“增大”“减小”或“不变”)。
③其他条件相同时,反应温度对 的平衡转化率和
的平衡转化率和 的选择性的影响如图甲所示,温度高于260°C时,
的选择性的影响如图甲所示,温度高于260°C时, 的平衡转化率变化的原因是
的平衡转化率变化的原因是___________ 。 的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:
的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:___________ 。
(4)利用如图所示原理去除NO:___________ ,每产生224 mL  (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为___________ mol。
 的排放、捕集并利用
的排放、捕集并利用 是我国能源领域的一个重要战略方向。
是我国能源领域的一个重要战略方向。在
 加氢合成甲醇的体系中,同时存在以下反应:
加氢合成甲醇的体系中,同时存在以下反应:反应i:

 kJ/mol
kJ/mol反应ii:

 kJ/mol
kJ/mol(1)反应iii:
 的
的
(2)在
 加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。
加氢合成甲醇的体系中,下列说法不正确的是___________(填序号)。| A.若在绝热恒容容器,反应i的平衡常数K保持不变,说明反应i、ii都已达平衡 |
| B.若气体的平均相对分子质量不变,说明反应i、ii都已达平衡 |
| C.体系达平衡后,若压缩体积,反应i平衡正向移动,反应i平衡不移动 |
| D.选用合适的催化剂可以提高甲醇在单位时间内的产量 |
(3)某温度下,向容积恒为1 L的密闭容器中通入1 mol
 和5 mol
和5 mol  ,10 min后体系达到平衡,此时
,10 min后体系达到平衡,此时 的转化率为20%。
的转化率为20%。 的选择性为50%。[已知:
的选择性为50%。[已知: 的选择性:
的选择性: ]
]①反应i的平衡常数

②反应ii的净速率
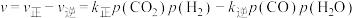 ,其中
,其中 、
、 分别为正、逆反应的速率常数,p为气体的分压。降低温度时,
分别为正、逆反应的速率常数,p为气体的分压。降低温度时,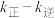
③其他条件相同时,反应温度对
 的平衡转化率和
的平衡转化率和 的选择性的影响如图甲所示,温度高于260°C时,
的选择性的影响如图甲所示,温度高于260°C时, 的平衡转化率变化的原因是
的平衡转化率变化的原因是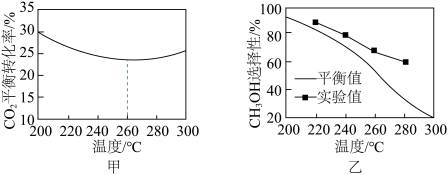
 的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:
的选择性:实验值略高于平衡值,从化学反应速率角度解释原因:(4)利用如图所示原理去除NO:
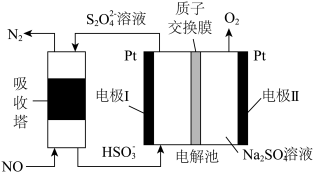
 (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为
您最近一年使用:0次
名校
2 . 常温下,向20mL 0.1 HCOOH溶液中滴加V mL 0.1
HCOOH溶液中滴加V mL 0.1 NaOH溶液,混合溶液的pH与
NaOH溶液,混合溶液的pH与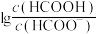 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
 HCOOH溶液中滴加V mL 0.1
HCOOH溶液中滴加V mL 0.1 NaOH溶液,混合溶液的pH与
NaOH溶液,混合溶液的pH与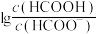 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是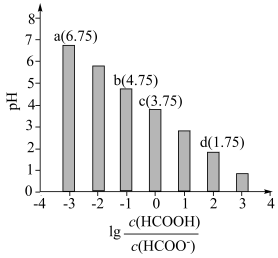
A.当V<20时,随着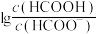 减小,水的电离程度增大 减小,水的电离程度增大 |
| B.当时V=10达到图像c点 |
| C.当V=20时,该溶液呈碱性 |
D.常温下,HCOOH的电离常数 的数量级为 的数量级为 |
您最近一年使用:0次
解题方法
3 . 近年,我国科学家利用两种不同的纳米催化剂 在室温水汽条件下实现高效
在室温水汽条件下实现高效 催化氧化
催化氧化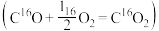 ,其反应历程中相对能量的变化如图所示(
,其反应历程中相对能量的变化如图所示( 分别代表过渡态1、过渡态2、过渡态3),下列说法正确的是
分别代表过渡态1、过渡态2、过渡态3),下列说法正确的是
 在室温水汽条件下实现高效
在室温水汽条件下实现高效 催化氧化
催化氧化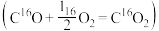 ,其反应历程中相对能量的变化如图所示(
,其反应历程中相对能量的变化如图所示( 分别代表过渡态1、过渡态2、过渡态3),下列说法正确的是
分别代表过渡态1、过渡态2、过渡态3),下列说法正确的是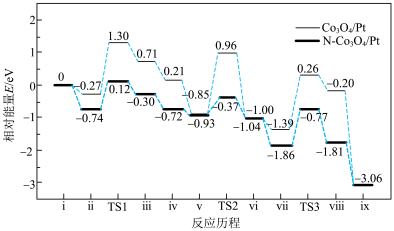
A.在该条件下,催化效果较好的催化剂是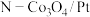 ,故使用催化剂 ,故使用催化剂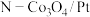 能提高反应物的转化率 能提高反应物的转化率 |
B.若利用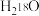 进行同位素标记实验,检测到以上反应中有 进行同位素标记实验,检测到以上反应中有 和 和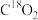 生成,说明反应过程中有 生成,说明反应过程中有 键的断裂 键的断裂 |
C.反应: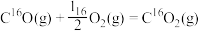 的 的 ,该反应在低温时不能自发进行 ,该反应在低温时不能自发进行 |
D.若ⅱ表示 被吸附在催化剂表面,则 被吸附在催化剂表面,则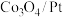 更容易吸附 更容易吸附 |
您最近一年使用:0次
解题方法
4 . 硫代硫酸钠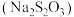 可用作分析试剂,它易溶于水、难溶于乙醇,有较强的还原性,受热、遇酸易分解,溶解度随温度升高而增大,实验室模拟工业上制备硫代硫酸钠的实验装置如图所示。回答下列问题。
可用作分析试剂,它易溶于水、难溶于乙醇,有较强的还原性,受热、遇酸易分解,溶解度随温度升高而增大,实验室模拟工业上制备硫代硫酸钠的实验装置如图所示。回答下列问题。___________ ,使用仪器d的好处是___________ ,下列各组试剂最适宜用于本实验制备 的是
的是___________ (填序号)。
A. 硫酸、
硫酸、 B.
B. 、
、 硫酸
硫酸
C. 、
、 盐酸 D.
盐酸 D. 、
、 硝酸
硝酸
(2)实验中用于配制相应溶液的蒸馏水需要先加热至沸腾,“加热至沸腾”的目的是___________ ,试剂X通常是___________ 。
(3)仪器c中反应的离子方程式为___________ ,实验中要严格控制进入仪器e中 的量,原因是
的量,原因是___________ 。
(4)待仪器C中反应完成后,将溶液转入蒸发皿中,水浴加热浓缩、冷却结晶、过滤、洗涤、干燥,洗涤晶体所用的试剂可以为___________ 。
(5)为检验制得产品的纯度,该实验小组称取5.0g产品配制成250mL。硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度。在锥形瓶中加入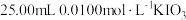 溶液,并加入过量的Kl后酸化,发生反应
溶液,并加入过量的Kl后酸化,发生反应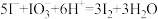 ,再加入几滴淀粉溶液,立即用所配
,再加入几滴淀粉溶液,立即用所配 溶液滴定,发生反应
溶液滴定,发生反应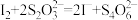 ,当达到滴定终点时,消耗
,当达到滴定终点时,消耗 溶液20.00mL,则该产品的纯度为
溶液20.00mL,则该产品的纯度为___________ (用百分数表示,保留一位小数)。
 可用作分析试剂,它易溶于水、难溶于乙醇,有较强的还原性,受热、遇酸易分解,溶解度随温度升高而增大,实验室模拟工业上制备硫代硫酸钠的实验装置如图所示。回答下列问题。
可用作分析试剂,它易溶于水、难溶于乙醇,有较强的还原性,受热、遇酸易分解,溶解度随温度升高而增大,实验室模拟工业上制备硫代硫酸钠的实验装置如图所示。回答下列问题。
 的是
的是A.
 硫酸、
硫酸、 B.
B. 、
、 硫酸
硫酸C.
 、
、 盐酸 D.
盐酸 D. 、
、 硝酸
硝酸(2)实验中用于配制相应溶液的蒸馏水需要先加热至沸腾,“加热至沸腾”的目的是
(3)仪器c中反应的离子方程式为
 的量,原因是
的量,原因是(4)待仪器C中反应完成后,将溶液转入蒸发皿中,水浴加热浓缩、冷却结晶、过滤、洗涤、干燥,洗涤晶体所用的试剂可以为
(5)为检验制得产品的纯度,该实验小组称取5.0g产品配制成250mL。硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度。在锥形瓶中加入
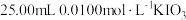 溶液,并加入过量的Kl后酸化,发生反应
溶液,并加入过量的Kl后酸化,发生反应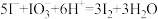 ,再加入几滴淀粉溶液,立即用所配
,再加入几滴淀粉溶液,立即用所配 溶液滴定,发生反应
溶液滴定,发生反应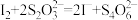 ,当达到滴定终点时,消耗
,当达到滴定终点时,消耗 溶液20.00mL,则该产品的纯度为
溶液20.00mL,则该产品的纯度为
您最近一年使用:0次
5 . 常温下,用 硫酸滴定
硫酸滴定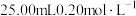 氨水溶液,所得溶液的
氨水溶液,所得溶液的 和
和 的物质的量分数
的物质的量分数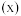 与滴加硫酸体积的关系如图所示,忽略溶液混合过程中的温度变化。(假设:氨水溶液中的含氮微粒只有
与滴加硫酸体积的关系如图所示,忽略溶液混合过程中的温度变化。(假设:氨水溶液中的含氮微粒只有 和
和 )下列说法不正确的是
)下列说法不正确的是
 硫酸滴定
硫酸滴定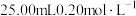 氨水溶液,所得溶液的
氨水溶液,所得溶液的 和
和 的物质的量分数
的物质的量分数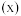 与滴加硫酸体积的关系如图所示,忽略溶液混合过程中的温度变化。(假设:氨水溶液中的含氮微粒只有
与滴加硫酸体积的关系如图所示,忽略溶液混合过程中的温度变化。(假设:氨水溶液中的含氮微粒只有 和
和 )下列说法不正确的是
)下列说法不正确的是
A.当滴入硫酸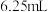 时,溶液中 时,溶液中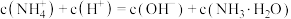 |
B.当溶液呈中性时,滴入硫酸的体积小于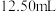 ,且此时溶液中 ,且此时溶液中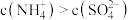 |
C.常温下, 的水解常数为 的水解常数为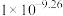 |
D.曲线②代表 点溶液中 点溶液中 |
您最近一年使用:0次
6 . 我国光伏发电并网装机容量突破3亿千瓦,连续七年稳居全球首位。采用电渗析法,以四甲基氯化铵 为原料,可合成电子工业清洗剂四甲基氢氧化铵
为原料,可合成电子工业清洗剂四甲基氢氧化铵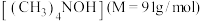 ,工作原理如图所示(气体体积均已换算成标准状况),下列说法正确的是
,工作原理如图所示(气体体积均已换算成标准状况),下列说法正确的是
 为原料,可合成电子工业清洗剂四甲基氢氧化铵
为原料,可合成电子工业清洗剂四甲基氢氧化铵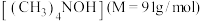 ,工作原理如图所示(气体体积均已换算成标准状况),下列说法正确的是
,工作原理如图所示(气体体积均已换算成标准状况),下列说法正确的是
| A.在光伏并网发电装置中,与a极连接的N型半导体为正极 |
B.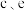 均为阳离子交换膜,d为阴离子交换膜,钠离子透过离子交换膜向阳极区移动 均为阳离子交换膜,d为阴离子交换膜,钠离子透过离子交换膜向阳极区移动 |
C.制备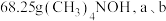 两极共产生 两极共产生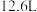 气体 气体 |
D.制备四甲基氢氧化铵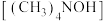 的电极反应式为 的电极反应式为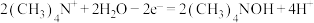 |
您最近一年使用:0次
名校
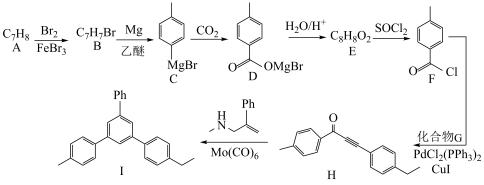
7 . 一种化合物Ⅰ的合成路线如图所示:
回答下列问题:
(1)H中官能团的名称为_______ ;H与足量 加成后的产物中手性碳的个数为
加成后的产物中手性碳的个数为_______ 。
(2) 的化学名称是
的化学名称是_______ ;其酸性比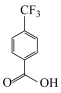 的酸性
的酸性_______ (填“强”“弱”或“无差别”)。
(3) 的反应类型为
的反应类型为___________ 。
(4)化合物G的分子式为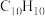 ,写出
,写出 的化学方程式:
的化学方程式:___________ 。
(5)E和乙二醇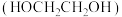 以物质的量比为2∶1完全酯化的产物有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:
以物质的量比为2∶1完全酯化的产物有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:___________ 。
①分子中含有3种不同化学环境的氢原子
②能发生银镜反应
③能发生水解反应,且 该分子水解时消耗
该分子水解时消耗
(6)参照上述合成路线,写出以苯乙炔、苯甲酸、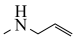 为原料制备
为原料制备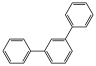 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)________ 。
回答下列问题:
(1)H中官能团的名称为
 加成后的产物中手性碳的个数为
加成后的产物中手性碳的个数为(2)
 的化学名称是
的化学名称是 的酸性
的酸性(3)
 的反应类型为
的反应类型为(4)化合物G的分子式为
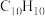 ,写出
,写出 的化学方程式:
的化学方程式:(5)E和乙二醇
 以物质的量比为2∶1完全酯化的产物有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:
以物质的量比为2∶1完全酯化的产物有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:①分子中含有3种不同化学环境的氢原子
②能发生银镜反应
③能发生水解反应,且
 该分子水解时消耗
该分子水解时消耗
(6)参照上述合成路线,写出以苯乙炔、苯甲酸、
 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
您最近一年使用:0次
2024-06-12更新
|
104次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性考试(十)理综试题-高中化学
解题方法
8 . 在 ,催化剂表面用
,催化剂表面用 选择性还原
选择性还原 ,可实现
,可实现 气体的资源化利用。涉及的反应为:
气体的资源化利用。涉及的反应为:
反应I: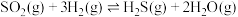
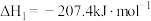
反应II: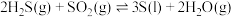
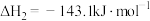
反应III:

(1)
___________  (保留整数),反应III在
(保留整数),反应III在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(2) 时,将
时,将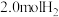 和
和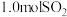 充入
充入 密闭容器中发生反应III,反应体系中气体的总压强随时间的变化如图。则:
密闭容器中发生反应III,反应体系中气体的总压强随时间的变化如图。则: 内,
内,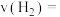
___________  ,
, 的平衡转化率为
的平衡转化率为___________ 。
② 时,反应的平衡常数
时,反应的平衡常数
___________ 。
(3)一定压强下,将 和
和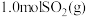 充入某密闭容器中发生反应I和II,反应进行相同时间内测得
充入某密闭容器中发生反应I和II,反应进行相同时间内测得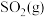 的转化率和产物中
的转化率和产物中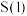 的选择性[
的选择性[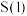 的选择性
的选择性 ]随温度变化如图所示:
]随温度变化如图所示:___________ (填“是”或“否”),理由是___________ 。
②S(1)的选择性随温度升高而减小的原因是___________ 。
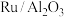 ,催化剂表面用
,催化剂表面用 选择性还原
选择性还原 ,可实现
,可实现 气体的资源化利用。涉及的反应为:
气体的资源化利用。涉及的反应为:反应I:
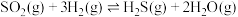
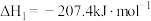
反应II:
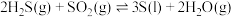
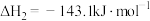
反应III:


(1)

 (保留整数),反应III在
(保留整数),反应III在(2)
 时,将
时,将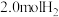 和
和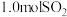 充入
充入 密闭容器中发生反应III,反应体系中气体的总压强随时间的变化如图。则:
密闭容器中发生反应III,反应体系中气体的总压强随时间的变化如图。则: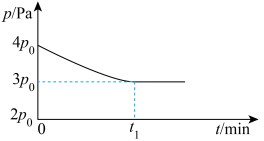
 内,
内,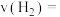
 ,
, 的平衡转化率为
的平衡转化率为②
 时,反应的平衡常数
时,反应的平衡常数
(3)一定压强下,将
 和
和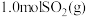 充入某密闭容器中发生反应I和II,反应进行相同时间内测得
充入某密闭容器中发生反应I和II,反应进行相同时间内测得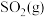 的转化率和产物中
的转化率和产物中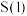 的选择性[
的选择性[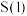 的选择性
的选择性 ]随温度变化如图所示:
]随温度变化如图所示:
②S(1)的选择性随温度升高而减小的原因是
您最近一年使用:0次
解题方法
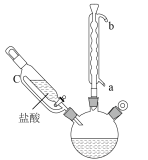
9 . NiS难溶于水,易溶于稀酸,可利用沉淀转化的原理除去镍电解液中的铜离子,NiS在潮湿的空气中可转化为磁式硫化高镍 ,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:
,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:______ 。
(2)装置图中,仪器a的名称为______ ,装置Ⅱ中的试剂为______ 。
(3)装置Ⅲ中反应的离子方程式为中。
(4)反应结束后关闭 、
、 ,在b、c处分别连接下图两个装置,打开
,在b、c处分别连接下图两个装置,打开 、
、 进行抽滤和洗涤。装置Ⅳ接在
进行抽滤和洗涤。装置Ⅳ接在______ (填“b”或“c”)处。______ (用化学方程式结合文字作答)。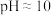 的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
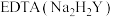 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: 。滴定达终点时消耗EDTA标准溶液VmL。
。滴定达终点时消耗EDTA标准溶液VmL。
①样品的纯度为______ %。
②滴定过程中,若氨性缓冲溶液pH过低,导致测得的产品纯度______ (填“偏低”、“偏高”或“不影响”)。
 ,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:
,从而降低除铜离子能力、实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀,回答下列问题:
(2)装置图中,仪器a的名称为
(3)装置Ⅲ中反应的离子方程式为中。
(4)反应结束后关闭
 、
、 ,在b、c处分别连接下图两个装置,打开
,在b、c处分别连接下图两个装置,打开 、
、 进行抽滤和洗涤。装置Ⅳ接在
进行抽滤和洗涤。装置Ⅳ接在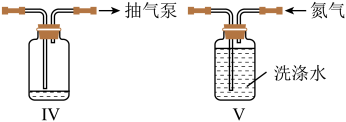

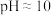 的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
的氨性缓冲溶液5mL,紫脲酸铵指示剂少许,用
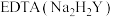 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: 。滴定达终点时消耗EDTA标准溶液VmL。
。滴定达终点时消耗EDTA标准溶液VmL。①样品的纯度为
②滴定过程中,若氨性缓冲溶液pH过低,导致测得的产品纯度
您最近一年使用:0次
解题方法
10 . 叶绿素铜钠是国家食品安全允许使用的食品添加剂,医疗领域叶绿素铜钠能止血、抗炎、促进伤口愈合。某实验小组利用茭白叶,在实验室制备叶绿素铜钠,反应原理如下:
Ⅰ.称取洗净剪碎的茭白叶10.0g(叶绿素含量为17.84%),加入少量石英砂、碳酸钙粉末,研磨。
Ⅱ.加入10mL96%乙醇继续研磨成均匀浆状,微波加热6min后抽滤。滤渣加入10mL96%乙醇,再次微波加热、浸提、抽滤,将两次滤液合并。
Ⅲ.滤液装入三颈烧瓶,加入硫酸酸化至pH=5,加入硫酸铜晶体,搅拌至硫酸铜晶体溶解后,再加入盐酸调节溶液pH至2~3,搅拌加热半小时以上。
Ⅳ.冷却后向混合物中加入适量蒸馏水,静置后过滤、洗涤、干燥,得到叶绿素铜。
Ⅴ.……
Ⅵ.将叶绿素铜酸放入烧杯中,保温80℃,逐滴加入2%氢氧化钠溶液至pH为10,过滤,滤液经操作X,烘干即得成品1.026g。
已知:
1.茭白叶研磨过程中会释放有机酸,有机酸产生的氢离子会代替叶绿素中的镁离子,使叶绿素变质。
2.
回答下列问题:
(1)仪器C的名称是___________ ,冷却水应从___________ (填“a”或“b”)口流出。
(2)步骤Ⅰ加入碳酸钙粉末的主要作用是___________ 。
(3)步骤Ⅲ中加入硫酸酸化至pH=5的目的是___________ (结合离子方程式和化学平衡移动原理说明)。
(4)步骤Ⅳ向混合物中加入适量蒸馏水的目的是___________ 。
(5)步骤Ⅴ的操作为:将叶绿素铜与50%乙醇混合,加入___________ (填标号,下同)溶液,加热15min,再加入___________ 溶液,加热至有墨绿色物质浮起,过滤、洗涤、干燥,得到叶绿素铜酸。
A.稀 B.稀
B.稀 C.NaOH D.KOH
C.NaOH D.KOH
(6)步骤Ⅵ中操作X的名称为___________ 。
(7)本实验的产率为___________ 。

Ⅰ.称取洗净剪碎的茭白叶10.0g(叶绿素含量为17.84%),加入少量石英砂、碳酸钙粉末,研磨。
Ⅱ.加入10mL96%乙醇继续研磨成均匀浆状,微波加热6min后抽滤。滤渣加入10mL96%乙醇,再次微波加热、浸提、抽滤,将两次滤液合并。
Ⅲ.滤液装入三颈烧瓶,加入硫酸酸化至pH=5,加入硫酸铜晶体,搅拌至硫酸铜晶体溶解后,再加入盐酸调节溶液pH至2~3,搅拌加热半小时以上。
Ⅳ.冷却后向混合物中加入适量蒸馏水,静置后过滤、洗涤、干燥,得到叶绿素铜。
Ⅴ.……
Ⅵ.将叶绿素铜酸放入烧杯中,保温80℃,逐滴加入2%氢氧化钠溶液至pH为10,过滤,滤液经操作X,烘干即得成品1.026g。
已知:
1.茭白叶研磨过程中会释放有机酸,有机酸产生的氢离子会代替叶绿素中的镁离子,使叶绿素变质。
2.
| 物质 | 相对分子质量 | 部分性质 |
| 叶绿素 | 892 | 蓝绿色固体,不溶于水,易溶于有机溶剂,对热不稳定,最佳提取温度约为80℃ |
| 叶绿素铜 | 932 | 绿色固体,不溶于水和50%乙醇 |
| 叶绿素铜酸 | 640 | 墨绿色固体,不溶于水 |
| 叶绿素铜钠 | 684 | 墨绿色固体,易溶于水,水溶液透明,受热较稳定 |
(1)仪器C的名称是
(2)步骤Ⅰ加入碳酸钙粉末的主要作用是
(3)步骤Ⅲ中加入硫酸酸化至pH=5的目的是
(4)步骤Ⅳ向混合物中加入适量蒸馏水的目的是
(5)步骤Ⅴ的操作为:将叶绿素铜与50%乙醇混合,加入
A.稀
 B.稀
B.稀 C.NaOH D.KOH
C.NaOH D.KOH(6)步骤Ⅵ中操作X的名称为
(7)本实验的产率为
您最近一年使用:0次



