1 . 无水三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧化。实验室利用反应
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧化。实验室利用反应 制取
制取 的
的 (俗称光气)有毒,遇水发生水解,实验所需装置如图所示。
(俗称光气)有毒,遇水发生水解,实验所需装置如图所示。
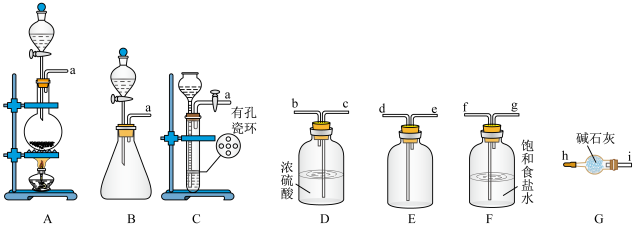
(1)上述装置的正确连接顺序为___________ (填字母,按气流方向从左到右)。
(2)装置A中所盛放的试剂是___________ ,装置A中竖直长玻璃管的作用是___________ 。装置D中n瓶的作用是___________ 。实验过程中为了避免装置A中长玻璃管中液面上升,可以采用的方法为___________ (填序号)。
①对m处导管进行加热 ②将m处导管加粗 ③持续通入氮气
(3)装置E中发生反应的离子方程式为___________ 。无水 的作用是
的作用是___________ 。
(4)已知 分子中各原子均满足最外层8电子稳定结构,则1mol
分子中各原子均满足最外层8电子稳定结构,则1mol 含有
含有 键的个数为
键的个数为___________ ( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(5) 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为___________ 。哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。则
___________ (填“能”或“不能”)催化双氧水分解。
 )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧化。实验室利用反应
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧化。实验室利用反应 制取
制取 的
的 (俗称光气)有毒,遇水发生水解,实验所需装置如图所示。
(俗称光气)有毒,遇水发生水解,实验所需装置如图所示。
(1)上述装置的正确连接顺序为
(2)装置A中所盛放的试剂是
①对m处导管进行加热 ②将m处导管加粗 ③持续通入氮气
(3)装置E中发生反应的离子方程式为
 的作用是
的作用是(4)已知
 分子中各原子均满足最外层8电子稳定结构,则1mol
分子中各原子均满足最外层8电子稳定结构,则1mol 含有
含有 键的个数为
键的个数为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(5)
 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
您最近一年使用:0次
2 . 亚稍酰氯(NOCl,熔点为-64.5℃,沸点为-5.5℃)是一种红褐色液体或黄色气体,遇水反应生成一种氢化物和两种氧化物,可用于合成清洁剂、触媒剂及中间体等。某学习小组在实验室中用Cl2和NO制备NOCl,请回答下列问题:
(1)原料气NO和Cl2的制备。________ 。实验室制备NO的反应的离子方程式为____________ 。
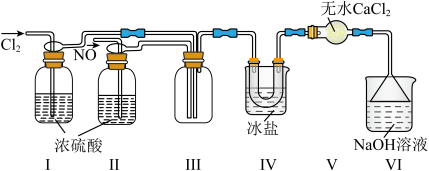
②实验室制备Cl2,可选择图中的装置_______ (填标号);制备并收集干燥的Cl2的装置连接顺序:_________ (按气流方向,用小写字母表示)。
(2)利用制得的NO和Cl2制备亚硝酰氯(NOCl),装置如图所示。_______ ,在装置I、Ⅱ选择通入气体时,应该先通入_______ ,原因是____________ 。
②装置Ⅳ的作用是___________ ;若无装置Ⅴ,则装置Ⅳ中NOCl可能发生反应的化学方程式为_______________ 。
③查阅资料知,王水是浓硝酸与浓盐酸的混合酸,一定条件下该混合酸可自身反应生成亚硝酰氯、氯气和水,该反应的化学方程式为______________ 。
(3)装置Ⅵ中倒置漏斗的作用为______ ,装置Ⅵ中发生反应的离子方程式为__________ 。
(1)原料气NO和Cl2的制备。
②实验室制备Cl2,可选择图中的装置
(2)利用制得的NO和Cl2制备亚硝酰氯(NOCl),装置如图所示。
②装置Ⅳ的作用是
③查阅资料知,王水是浓硝酸与浓盐酸的混合酸,一定条件下该混合酸可自身反应生成亚硝酰氯、氯气和水,该反应的化学方程式为
(3)装置Ⅵ中倒置漏斗的作用为
您最近一年使用:0次
名校
3 . 羟基氧化铁 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
 .产品制备及产率计算
.产品制备及产率计算
①制备晶种:称取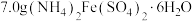 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至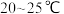 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加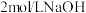 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
②氧化过程:称取足量 ,加入上述溶液,于
,加入上述溶液,于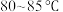 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。
③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用 试纸检验溶液
试纸检验溶液 的操作为
的操作为___________ 。
(2)①中观察到沉淀的颜色变为___________ 色时,证明已经成功制备晶种。
(3)②氧化过程中,发生反应的离子方程式为___________ 。
(4)抽滤装置如图,仪器c的作用为___________ ,和普通过滤相比,抽滤的优点有过滤速度更快和___________ 。 .产品纯度测定
.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。 ,
,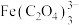 不与稀
不与稀 溶液反应。
溶液反应。
(5)铁黄溶于 标准液的离子方程式为
标准液的离子方程式为___________ 。
(6) 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为___________ (列出计算式,不需化简)。
(7)若 溶液过量,会使测定结果
溶液过量,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。(已知草酸的电离平衡常数: )
)
 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下: .产品制备及产率计算
.产品制备及产率计算①制备晶种:称取
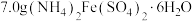 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至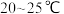 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加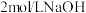 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。②氧化过程:称取足量
 ,加入上述溶液,于
,加入上述溶液,于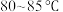 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用
 试纸检验溶液
试纸检验溶液 的操作为
的操作为(2)①中观察到沉淀的颜色变为
(3)②氧化过程中,发生反应的离子方程式为
(4)抽滤装置如图,仪器c的作用为
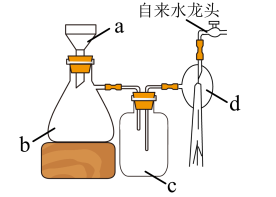
 .产品纯度测定
.产品纯度测定铁黄纯度可以通过产品的耗酸量确定。

 ,
,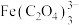 不与稀
不与稀 溶液反应。
溶液反应。(5)铁黄溶于
 标准液的离子方程式为
标准液的离子方程式为(6)
 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为(7)若
 溶液过量,会使测定结果
溶液过量,会使测定结果 )
)
您最近一年使用:0次
7日内更新
|
367次组卷
|
3卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
名校
4 . 一种利用废铜渣(主要成分为 ,及少量的
,及少量的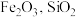 等杂质)制备超细铜粉的流程如下:
等杂质)制备超细铜粉的流程如下:
 ,及少量的
,及少量的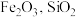 等杂质)制备超细铜粉的流程如下:
等杂质)制备超细铜粉的流程如下:
A.“酸浸”所得滤渣的主要成分为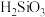 |
B.向“沉铁”后的滤液中加入乙醇,析出的深蓝色晶体为 |
C.“沉铜”过程中发生了氧化还原反应, 是还原剂 是还原剂 |
D.“转化”后的滤液中含有的阳离子为 和 和 |
您最近一年使用:0次
7日内更新
|
558次组卷
|
4卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
名校
5 . 标准状况下,将SO2和Cl2组成的混合气体amol通入200mL Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是
Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是
 Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是
Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是| A.0.06 | B.0.07 | C.0.08 | D.0.09 |
您最近一年使用:0次
名校
6 . 宏观辨识与微观探析是化学学科核心素养之一,下列反应方程式书写正确的是
A.用饱和 溶液吸收少量氯气: 溶液吸收少量氯气: |
B.向 溶液中通入少量氯气: 溶液中通入少量氯气: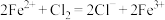 |
C.制备 时白色沉淀会快速变为灰绿色最后变为红褐色的原因: 时白色沉淀会快速变为灰绿色最后变为红褐色的原因: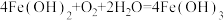 |
D.用丙烯腈电合成己二腈,在阳极发生的电极反应: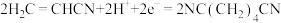 |
您最近一年使用:0次
2024-05-23更新
|
93次组卷
|
2卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试题(五)
名校
解题方法
7 . 铟(In)是制造半导体、电光源等的重要原料。从铜冶炼过程中产生的铟砷烟灰(主要含有 、
、 )中提取铟的工艺方法如下:
)中提取铟的工艺方法如下: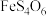 为强电解质;
为强电解质;
② 为磷酸二异辛酯,密度为
为磷酸二异辛酯,密度为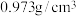 ,其在酸性溶液中可萃取三价金属离子;
,其在酸性溶液中可萃取三价金属离子;
③ 。
。
回答下列问题:
(1)滤渣的主要成分除 外还有
外还有___________ 、___________ (填化学式);“氧化酸浸”过程中, 中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:
中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:___________ 。
(2)“还原铁”时反应的离子方程式为___________ 。
(3)“萃取除铁”时,用 的
的 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是___________ (用平衡移动原理解释);反萃取时萃余液应从分液漏斗的___________ (填“下口放出”或“上口倒出”)。
(4)“萃取”过程中也可用酸(用 表示)作萃取剂,使
表示)作萃取剂,使 进入有机相,发生反应:
进入有机相,发生反应: ,平衡常数为
,平衡常数为 。已知
。已知 与萃取率
与萃取率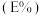 的关系符合公式:
的关系符合公式: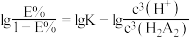 。当
。当 时,萃取率为
时,萃取率为 ,若将萃取率提升到
,若将萃取率提升到 ,应调节溶液的
,应调节溶液的
___________ (已知 ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)整个工艺流程中,可循环利用的物质是___________ 。
(6)2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。铜铟硫 量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系
量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系 的晶胞结构如图所示,晶胞中In和
的晶胞结构如图所示,晶胞中In和 未标明,用
未标明,用 或者
或者 代替。
代替。 位于由
位于由 构成的
构成的___________ (填“四面体空隙”、“六面体空隙”或“八面体空隙”)中。
 、
、 )中提取铟的工艺方法如下:
)中提取铟的工艺方法如下: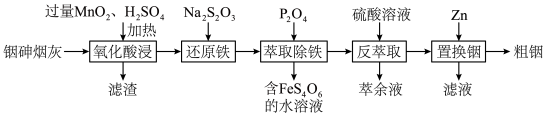
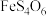 为强电解质;
为强电解质;②
 为磷酸二异辛酯,密度为
为磷酸二异辛酯,密度为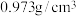 ,其在酸性溶液中可萃取三价金属离子;
,其在酸性溶液中可萃取三价金属离子;③
 。
。回答下列问题:
(1)滤渣的主要成分除
 外还有
外还有 中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:
中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:(2)“还原铁”时反应的离子方程式为
(3)“萃取除铁”时,用
 的
的 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是(4)“萃取”过程中也可用酸(用
 表示)作萃取剂,使
表示)作萃取剂,使 进入有机相,发生反应:
进入有机相,发生反应: ,平衡常数为
,平衡常数为 。已知
。已知 与萃取率
与萃取率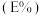 的关系符合公式:
的关系符合公式: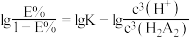 。当
。当 时,萃取率为
时,萃取率为 ,若将萃取率提升到
,若将萃取率提升到 ,应调节溶液的
,应调节溶液的
 ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。(5)整个工艺流程中,可循环利用的物质是
(6)2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。铜铟硫
 量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系
量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系 的晶胞结构如图所示,晶胞中In和
的晶胞结构如图所示,晶胞中In和 未标明,用
未标明,用 或者
或者 代替。
代替。 位于由
位于由 构成的
构成的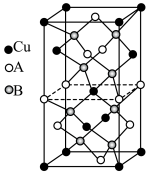
您最近一年使用:0次
解题方法
8 . 红矾钠(重铬酸钠: )是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿(
)是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿( ,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题:
,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题: 转化为
转化为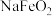 和
和 。
。
②“浸取”时铁元素以 形式存在。
形式存在。
(1)写出“焙烧”时 被氧化的化学方程式:
被氧化的化学方程式:_______ 。
(2)为了加快浸取速率可采取的措施有_______ (请写出两种方法)。
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分的浓度 时认为已除尽。
时认为已除尽。_______ ,滤渣的主要成分有_______ 。
(4)“酸化”时,不可以将硫酸改为盐酸(HCl),原因是(用离子方程式表示)_______ 。
(5)“冷却结晶”所得母液中,除 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有_______ (用化学式表示)。
(6) 的三种结构:①
的三种结构:①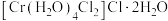 、②
、②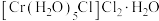 、③
、③ ,下列说法错误的是_______。
,下列说法错误的是_______。
 )是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿(
)是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿( ,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题:
,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题: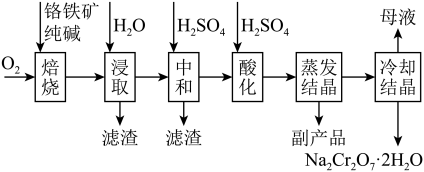
 转化为
转化为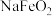 和
和 。
。②“浸取”时铁元素以
 形式存在。
形式存在。(1)写出“焙烧”时
 被氧化的化学方程式:
被氧化的化学方程式:(2)为了加快浸取速率可采取的措施有
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分的浓度
 时认为已除尽。
时认为已除尽。
(4)“酸化”时,不可以将硫酸改为盐酸(HCl),原因是(用离子方程式表示)
(5)“冷却结晶”所得母液中,除
 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有(6)
 的三种结构:①
的三种结构:①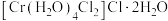 、②
、②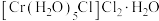 、③
、③ ,下列说法错误的是_______。
,下列说法错误的是_______。A.①中配合离子空间结构为 或 或 (已略去位于正八面体中心的 (已略去位于正八面体中心的 ) ) |
B.②③中 的配位数都是6 的配位数都是6 |
| C.②中存在的作用力有离子键、共价键、配位键和氢键等 |
D.等物质的量浓度、等体积的①②③溶液中, 的物质的量相等 的物质的量相等 |
您最近一年使用:0次
名校
解题方法
9 . 红磷可用于制备半导体化合物,还可以用于制造火柴、烟火,以及三氯化磷等。
Ⅰ.研究小组以无水甲苯为溶剂, (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。
实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。 的作用是
的作用是___________ 。
(2)先小火加热控温100℃一段时间,打开活塞___________ ,达到除水的目的。再升温至120℃左右,打开活塞___________ ,达到分离收集甲苯的目的。
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。___________ 。用氩气赶走空气的目的是___________ 。
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是___________ 。
Ⅱ.该实验所需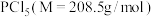 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:
步骤Ⅰ:取 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;
步骤Ⅱ:取 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入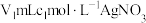 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀( 可溶于稀硝酸);
可溶于稀硝酸);
步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用 溶液滴定过量的
溶液滴定过量的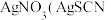 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去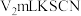 溶液。
溶液。
(5)产品中 的质量分数为
的质量分数为___________  ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会___________ (填“偏大”“偏小”或“不变”)。
Ⅰ.研究小组以无水甲苯为溶剂,
 (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。
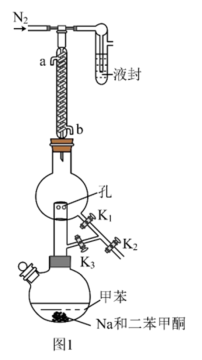
 的作用是
的作用是(2)先小火加热控温100℃一段时间,打开活塞
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。
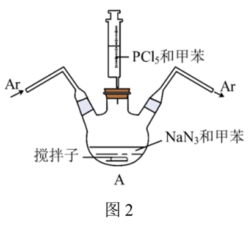
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是
Ⅱ.该实验所需
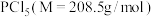 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:步骤Ⅰ:取
 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;步骤Ⅱ:取
 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入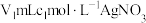 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀( 可溶于稀硝酸);
可溶于稀硝酸);步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用
 溶液滴定过量的
溶液滴定过量的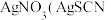 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去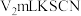 溶液。
溶液。(5)产品中
 的质量分数为
的质量分数为 ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会
您最近一年使用:0次
10 . 在工业流程题中常使用 作为沉淀剂沉淀Fe2+/Mn2+/Co2+等金属离子,为了证实这一结论,对
作为沉淀剂沉淀Fe2+/Mn2+/Co2+等金属离子,为了证实这一结论,对 与Mn+的反应情况进行了以下探究:
与Mn+的反应情况进行了以下探究:
已知:①Ca2++2 =CaCO3↓+CO2↑+H2O K1=5×104
=CaCO3↓+CO2↑+H2O K1=5×104
②Ca2++2 =Ca(OH)2↓+2CO2↑ K2=1×10-10
=Ca(OH)2↓+2CO2↑ K2=1×10-10
③Cu2++2 =CuCO3↓+CO2↑+H2O K3=8×106
=CuCO3↓+CO2↑+H2O K3=8×106
④Cu2++2 =Cu(OH)2↓+2CO2↑ K4=3×104
=Cu(OH)2↓+2CO2↑ K4=3×104
下列关于该探究实验的叙述正确的是
 作为沉淀剂沉淀Fe2+/Mn2+/Co2+等金属离子,为了证实这一结论,对
作为沉淀剂沉淀Fe2+/Mn2+/Co2+等金属离子,为了证实这一结论,对 与Mn+的反应情况进行了以下探究:
与Mn+的反应情况进行了以下探究:| 操作 | 现象 | |
| 1 | 0.5mol·L-1CaCl2溶液与NaHCO3溶液混合 | 产生气泡,生成白色沉淀 |
| 2 | 0.5mol·L-1CuCl2溶液与NaHCO3溶液混合 | 产生气泡,生成蓝色沉淀 |
| 3 | 0.5mol·L-1FeCl3溶液与NaHCO3溶液混合 | 产生大量气泡,生成红褐色沉淀 |
| 4 | 取2中的蓝色沉淀加热并将产物依次通过无水CuSO4和澄清石灰水 | 无水CuSO4变蓝,澄清石灰水变浑浊 |
 =CaCO3↓+CO2↑+H2O K1=5×104
=CaCO3↓+CO2↑+H2O K1=5×104②Ca2++2
 =Ca(OH)2↓+2CO2↑ K2=1×10-10
=Ca(OH)2↓+2CO2↑ K2=1×10-10③Cu2++2
 =CuCO3↓+CO2↑+H2O K3=8×106
=CuCO3↓+CO2↑+H2O K3=8×106④Cu2++2
 =Cu(OH)2↓+2CO2↑ K4=3×104
=Cu(OH)2↓+2CO2↑ K4=3×104下列关于该探究实验的叙述正确的是
| A.实验1生成的沉淀为Ca(OH)2 |
| B.实验2生成的沉淀为Cu(OH)2 |
C. 与M2+反应生成MCO3沉淀的离子方程式为M2++ 与M2+反应生成MCO3沉淀的离子方程式为M2++ =MCO3↓+H+ =MCO3↓+H+ |
D.实验3发生反应的离子方程式为Fe3++3 =Fe(OH)3↓+3CO2↑ =Fe(OH)3↓+3CO2↑ |
您最近一年使用:0次



