名校
解题方法
1 . 重铬酸钾是一种重要的化工原料,可由铬铁矿(主要成分为 ,还含有硅、铝的氧化物等杂质)制备,流程如图所示:
,还含有硅、铝的氧化物等杂质)制备,流程如图所示: 主要以
主要以 形式存在,加入酸会转为
形式存在,加入酸会转为 。
。
Ⅱ.有关物质的溶解度如图所示:______ (任写一条)。
(2)步骤①中主要反应为: ,上述反应配平后
,上述反应配平后 与
与 的系数比为
的系数比为______ 。
(3)滤渣1中含量最多的金属元素是______ ,滤渣2的主要成分是Y及含硅杂质。向滤液1通入过量 得到Y的离子方程式为
得到Y的离子方程式为______ 。
(4)步骤④将滤液2的pH调小的原因是______ (结合离子方程式和文字表述说明)。
(5)向“滤液3”中加入适量KCl,经过操作X后得到 固体。操作X为:
固体。操作X为:______ ,过滤、洗涤、干燥。
(6)某工厂用448kg铬铁矿粉( 的含量为80%)制备
的含量为80%)制备 ,最终得到产品182.4kg,则
,最终得到产品182.4kg,则 的产率为
的产率为______ %。
 ,还含有硅、铝的氧化物等杂质)制备,流程如图所示:
,还含有硅、铝的氧化物等杂质)制备,流程如图所示:
 主要以
主要以 形式存在,加入酸会转为
形式存在,加入酸会转为 。
。Ⅱ.有关物质的溶解度如图所示:

(2)步骤①中主要反应为:
 ,上述反应配平后
,上述反应配平后 与
与 的系数比为
的系数比为(3)滤渣1中含量最多的金属元素是
 得到Y的离子方程式为
得到Y的离子方程式为(4)步骤④将滤液2的pH调小的原因是
(5)向“滤液3”中加入适量KCl,经过操作X后得到
 固体。操作X为:
固体。操作X为:(6)某工厂用448kg铬铁矿粉(
 的含量为80%)制备
的含量为80%)制备 ,最终得到产品182.4kg,则
,最终得到产品182.4kg,则 的产率为
的产率为
您最近一年使用:0次
名校
2 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.0.1mol 含有电子数为 含有电子数为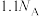 |
B.6.4gCu与0.1molS充分反应,转移电子数为 |
C.常温下,2.7g铝粉与足量浓硝酸反应,转移电子数为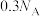 |
D.1L 氨水中含有 氨水中含有 和 和 的数目之和为 的数目之和为 |
您最近一年使用:0次
解题方法
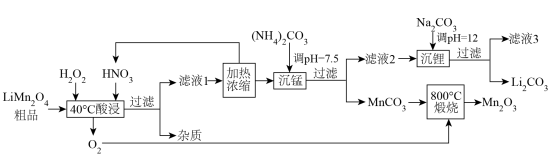
3 . 利用硝酸、过氧化氢对废弃锂电池中的正极材料LiMn2O4进行处理,回收Li、Mn元素,工艺流程如下:
(1)通过仪器分析可知LiMn2O4晶体中锰元素由 、
、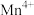 构成,它们的个数比为
构成,它们的个数比为___________ 。
(2)为了提高“酸浸”的效率,可采取的方法有___________ (答出2条)。“滤液1”的主要溶质有LiNO3、 ,写出“酸浸”时发生反应的离子方程式
,写出“酸浸”时发生反应的离子方程式___________ 。
(3)在“酸浸”时,若用盐酸替代硝酸,可能产生的不良影响是___________ ,请评价若流程中缺少“加热浓缩”步骤后工艺的优缺点___________ (优点和缺点各写一条)。
(4)“沉锂”试剂不选用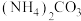 的原因可能是
的原因可能是___________ (写出一条)。
(5)写出“800℃煅烧” 时发生反应的化学方程式
时发生反应的化学方程式___________ 。
(6)若“沉锂”前“滤液2”中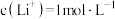 ,取1L该溶液加入等体积Na2CO3溶液充分反应后溶液中
,取1L该溶液加入等体积Na2CO3溶液充分反应后溶液中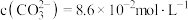 ,则该实验中锂离子的沉淀率为
,则该实验中锂离子的沉淀率为___________ %(已知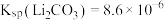 ,混合后溶液体积变化忽略不计)。
,混合后溶液体积变化忽略不计)。
(1)通过仪器分析可知LiMn2O4晶体中锰元素由
 、
、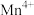 构成,它们的个数比为
构成,它们的个数比为(2)为了提高“酸浸”的效率,可采取的方法有
 ,写出“酸浸”时发生反应的离子方程式
,写出“酸浸”时发生反应的离子方程式(3)在“酸浸”时,若用盐酸替代硝酸,可能产生的不良影响是
(4)“沉锂”试剂不选用
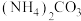 的原因可能是
的原因可能是(5)写出“800℃煅烧”
 时发生反应的化学方程式
时发生反应的化学方程式(6)若“沉锂”前“滤液2”中
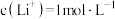 ,取1L该溶液加入等体积Na2CO3溶液充分反应后溶液中
,取1L该溶液加入等体积Na2CO3溶液充分反应后溶液中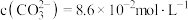 ,则该实验中锂离子的沉淀率为
,则该实验中锂离子的沉淀率为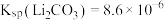 ,混合后溶液体积变化忽略不计)。
,混合后溶液体积变化忽略不计)。
您最近一年使用:0次
名校
4 . 钇是稀土元素之一。我国蕴藏着丰富的钇矿石(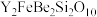 ,其中Y为+3价),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
,其中Y为+3价),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
ii. 、
、 形成氢氧化物沉淀时的pH如下表:
形成氢氧化物沉淀时的pH如下表:
(1)钇矿石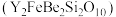 用氧化物的形式可表示为
用氧化物的形式可表示为________ 。
(2)将钇矿石与NaOH共熔的化学方程式补充完整:_____
________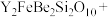 ________
________ ________
________ ________
________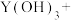 ________
________ ________
________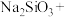 ________
________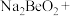 ________
________
(3)试剂1应加入过量的________ (填名称),滤渣1的主要成分是________ (填化学式)。
(4)“系列操作1”为除去BeCl,溶液中的杂质 ,请选择合理步骤并排序;
,请选择合理步骤并排序;________ (填序号)。
a.加入适量的盐酸 b.通入过量的 c.过滤 d.加入过量的NaOH溶液
c.过滤 d.加入过量的NaOH溶液
e.加入过量的氨水 f.洗涤
(5)为使 沉淀完全,用氨水调节
沉淀完全,用氨水调节 时,a应控制在
时,a应控制在________ 范围内;继续加氨水调节 发生反应的离子方程式为
发生反应的离子方程式为________ ;检验 是否沉淀完全的操作是
是否沉淀完全的操作是________ 。
(6)常见的由 固体生产Be的工业方法有两种:①电解法:电解
固体生产Be的工业方法有两种:①电解法:电解 混合熔融盐制备Be;②热还原法:熔融条件下,钾还原
混合熔融盐制备Be;②热还原法:熔融条件下,钾还原 制备Be。以上两种方法你认为哪种更好并说明理由:
制备Be。以上两种方法你认为哪种更好并说明理由:________ (合理即可)。
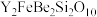 ,其中Y为+3价),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
,其中Y为+3价),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。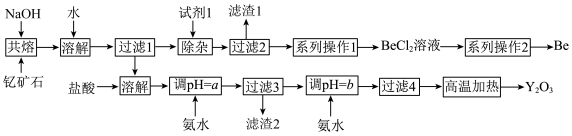
ii.
 、
、 形成氢氧化物沉淀时的pH如下表:
形成氢氧化物沉淀时的pH如下表:离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| 2.1 | 3.1 |
| 6.0 | 8.3 |
(1)钇矿石
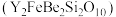 用氧化物的形式可表示为
用氧化物的形式可表示为(2)将钇矿石与NaOH共熔的化学方程式补充完整:
________
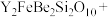 ________
________ ________
________ ________
________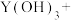 ________
________ ________
________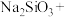 ________
________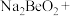 ________
________
(3)试剂1应加入过量的
(4)“系列操作1”为除去BeCl,溶液中的杂质
 ,请选择合理步骤并排序;
,请选择合理步骤并排序;a.加入适量的盐酸 b.通入过量的
 c.过滤 d.加入过量的NaOH溶液
c.过滤 d.加入过量的NaOH溶液e.加入过量的氨水 f.洗涤
(5)为使
 沉淀完全,用氨水调节
沉淀完全,用氨水调节 时,a应控制在
时,a应控制在 发生反应的离子方程式为
发生反应的离子方程式为 是否沉淀完全的操作是
是否沉淀完全的操作是(6)常见的由
 固体生产Be的工业方法有两种:①电解法:电解
固体生产Be的工业方法有两种:①电解法:电解 混合熔融盐制备Be;②热还原法:熔融条件下,钾还原
混合熔融盐制备Be;②热还原法:熔融条件下,钾还原 制备Be。以上两种方法你认为哪种更好并说明理由:
制备Be。以上两种方法你认为哪种更好并说明理由:
您最近一年使用:0次
名校
5 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.1.8g甲基 中含有的中子数目为 中含有的中子数目为 |
B.常温常压下,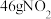 与 与 的混合气体共含 的混合气体共含 个氧原子 个氧原子 |
C.1mol蔗糖完全水解生成的葡萄糖的分子数目为 |
| D.电解精炼铜时,阳极质量每减少64g,电路中转移2mol电子 |
您最近一年使用:0次
解题方法
6 . 电解精炼铜的阳极泥主要成分为 、
、 、FeS、
、FeS、 ,工业生产从其中提取银和硒的流程如图所示:
,工业生产从其中提取银和硒的流程如图所示:
① 、
、 、
、 难溶于稀硫酸。
难溶于稀硫酸。
②常温下, 易与
易与 形成配离子:
形成配离子: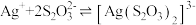 ,
,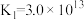 。
。
回答下列问题:
(1)阳极泥中Cu元素的化合价是____ ,如果将阳极泥用足量稀硫酸酸浸,浸取液所含阳离子为_______ (填化学式)。
(2)在室温条件下,加入稀硫酸和 “分铜”,有较多的
“分铜”,有较多的 产生,其原因可能是
产生,其原因可能是______ ,“分铜”时,加入氯化钠的主要目的是_______ 。
(3)经测定烟气的主要成分为 、
、 ,“分硒”时发生反应的离子方程式为
,“分硒”时发生反应的离子方程式为______ 。
(4)“分银”时发生的反应为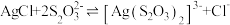 ,该反应的平衡常数
,该反应的平衡常数
____ [已知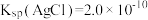 ]。
]。
(5)“还原”时, 没有参与氧化还原过程,“滤液2”中主要含有
没有参与氧化还原过程,“滤液2”中主要含有 。调节溶液酸碱性时所加试剂X是
。调节溶液酸碱性时所加试剂X是____ (填“酸”或“碱”)溶液;若制得1mol Ag,理论上消耗
____ mol。
 、
、 、FeS、
、FeS、 ,工业生产从其中提取银和硒的流程如图所示:
,工业生产从其中提取银和硒的流程如图所示: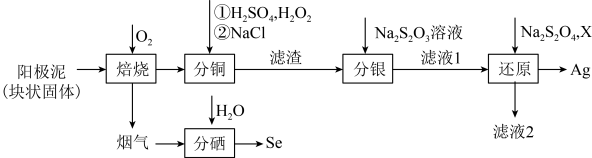
①
 、
、 、
、 难溶于稀硫酸。
难溶于稀硫酸。②常温下,
 易与
易与 形成配离子:
形成配离子: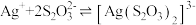 ,
,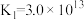 。
。回答下列问题:
(1)阳极泥中Cu元素的化合价是
(2)在室温条件下,加入稀硫酸和
 “分铜”,有较多的
“分铜”,有较多的 产生,其原因可能是
产生,其原因可能是(3)经测定烟气的主要成分为
 、
、 ,“分硒”时发生反应的离子方程式为
,“分硒”时发生反应的离子方程式为(4)“分银”时发生的反应为
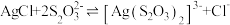 ,该反应的平衡常数
,该反应的平衡常数
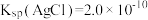 ]。
]。(5)“还原”时,
 没有参与氧化还原过程,“滤液2”中主要含有
没有参与氧化还原过程,“滤液2”中主要含有 。调节溶液酸碱性时所加试剂X是
。调节溶液酸碱性时所加试剂X是
您最近一年使用:0次
解题方法
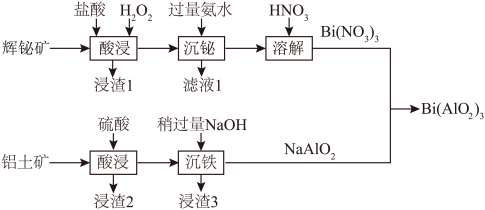
7 . 铝酸铋[Bi(AlO2)3]是一种能够有效调理胃肠功能、促进疾病恢复的常见药物,常用辉铋矿(主要成分为Bi2S3,还含少量Cu2S和Ag2O)和铝土矿(主要成分为Al2O3,还含少量Fe2O3和SiO2)利用如下流程制取:
② BiCl3易溶于水,易水解,Bi(OH)3不溶于水和碱。
回答下列问题:
(1)辉铋矿“酸浸”过程中,需要控制温度不超过50℃的原因是_______ 。
(2)辉铋矿“酸浸”时S元素转化为单质硫,浸渣1的成分为_______ 。“酸浸”时Bi2S3转化的离子方程式为_______ 。
(3)“沉铋”时氨水稍过量的目的是_______ ;“沉铁”时稍过量的NaOH能否用氨水代替:_______ (填“能”或“否”)。
(4)Bi(NO3)3溶液和NaAlO2溶液混合前,Bi(NO3)3溶液中往往含少量硝酸,NaAlO2溶液中往往含少量NaOH,其目的是_______ 。
(5)Bi(NO3)3溶液和NaAlO2溶液混合充分反应,写出制取Bi(AlO2)3的化学方程式_______ ,利用1 kg含77.1% Bi2S3的辉铋矿与足量铝土矿作用制得868.5 g Bi(AlO2)3,则铝酸铋的产率为_______ 。
② BiCl3易溶于水,易水解,Bi(OH)3不溶于水和碱。
回答下列问题:
(1)辉铋矿“酸浸”过程中,需要控制温度不超过50℃的原因是
(2)辉铋矿“酸浸”时S元素转化为单质硫,浸渣1的成分为
(3)“沉铋”时氨水稍过量的目的是
(4)Bi(NO3)3溶液和NaAlO2溶液混合前,Bi(NO3)3溶液中往往含少量硝酸,NaAlO2溶液中往往含少量NaOH,其目的是
(5)Bi(NO3)3溶液和NaAlO2溶液混合充分反应,写出制取Bi(AlO2)3的化学方程式
您最近一年使用:0次
名校
解题方法
8 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: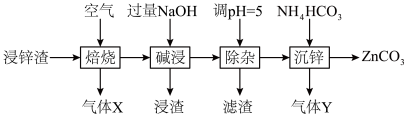
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):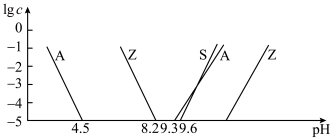
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-05-17更新
|
207次组卷
|
2卷引用:2024届四川省射洪中学校高三下学期二模理综试题-高中化学
名校
解题方法
9 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.46.0gC2H6O完全燃烧,有5NA个C-H断裂 |
| B.25℃时,1LpH=8的CH3COONa溶液中水电离出的OH-数目为10-8NA |
| C.铅酸蓄电池中,当正极理论上增加3.2g时,电路中通过的电子数目为0.1NA |
| D.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数分别为NA、3NA |
您最近一年使用:0次
解题方法
10 .  可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯
可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯 的工艺流程如图所示。
的工艺流程如图所示。 存在;
存在;
②常温下,部分物质溶度积如下:
回答下列问题:
(1)常温下,为提高酸浸效率,通常采用的措施是___________ (举2例)。
(2)加入碳酸钙调pH=4的目的是___________ ,此时 (0.10mol/L)是否会沉淀
(0.10mol/L)是否会沉淀___________ (通过计算说明)。
(3)“沉渣3”的主要成分是___________ (填化学式)。“滤液4”中除含 、
、 、
、 、
、 外,还含有较多的
外,还含有较多的___________ (填离子符号)。
(4)向“酸溶”后的溶液中加入NaOH和NaClO,发生反应的化学方程式是___________ 。
(5)工艺流程中使用 去除
去除 。研究表明,也可在加热条件下使用
。研究表明,也可在加热条件下使用 去除
去除 ,生成等物质的量的
,生成等物质的量的 、S混合沉淀以及
、S混合沉淀以及 ,该反应的离子方程式是
,该反应的离子方程式是___________ 。
 可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯
可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯 的工艺流程如图所示。
的工艺流程如图所示。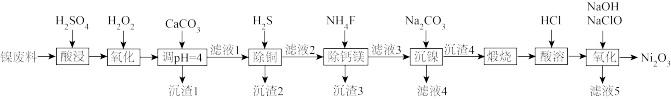
 存在;
存在;②常温下,部分物质溶度积如下:
 |  |  |  | |
 |  |  | 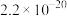 | 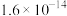 |
(1)常温下,为提高酸浸效率,通常采用的措施是
(2)加入碳酸钙调pH=4的目的是
 (0.10mol/L)是否会沉淀
(0.10mol/L)是否会沉淀(3)“沉渣3”的主要成分是
 、
、 、
、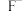 、
、 外,还含有较多的
外,还含有较多的(4)向“酸溶”后的溶液中加入NaOH和NaClO,发生反应的化学方程式是
(5)工艺流程中使用
 去除
去除 。研究表明,也可在加热条件下使用
。研究表明,也可在加热条件下使用 去除
去除 ,生成等物质的量的
,生成等物质的量的 、S混合沉淀以及
、S混合沉淀以及 ,该反应的离子方程式是
,该反应的离子方程式是
您最近一年使用:0次



