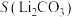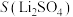解题方法
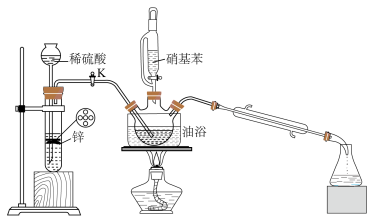
1 . 苯胺( ),沸点为184℃,有碱性,易被氧化,微溶于水,易溶于乙醚等有机物,广泛应用于医药和染料行业。实验室用硝基苯与H2反应制备苯胺的反应原理为:
),沸点为184℃,有碱性,易被氧化,微溶于水,易溶于乙醚等有机物,广泛应用于医药和染料行业。实验室用硝基苯与H2反应制备苯胺的反应原理为: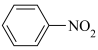 +3H2
+3H2
 +2H2O,实验装置如图所示(部分夹持装置省略)。
+2H2O,实验装置如图所示(部分夹持装置省略)。
已知: +HCl
+HCl
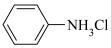 (苯胺盐酸盐,易溶于水)
(苯胺盐酸盐,易溶于水)
(1)试管中发生反应的离子方程式为
(2)实验时,须先打开K,通一段时间H2的原因是
(3)实验制得苯胺粗品中含有少量硝基苯,某同学设计如下流程提纯苯胺、回收硝基苯。
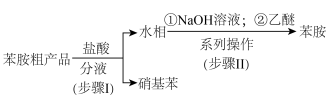
③“步骤Ⅱ”中,加入乙醚的作用是
A.浓硫酸 B.碱石灰 C.无水MgSO4 D.P2O5
您最近半年使用:0次
2 . 短周期主族元素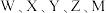 的原子序数依次增大,元素
的原子序数依次增大,元素 位于同一周期,且元素
位于同一周期,且元素 能组成红棕色的大气污染物,金属元素M的单质与冷水反应缓慢,但可与沸水迅速发生置换反应生成W的单质。下列有关说法错误的是
能组成红棕色的大气污染物,金属元素M的单质与冷水反应缓慢,但可与沸水迅速发生置换反应生成W的单质。下列有关说法错误的是
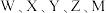 的原子序数依次增大,元素
的原子序数依次增大,元素 位于同一周期,且元素
位于同一周期,且元素 能组成红棕色的大气污染物,金属元素M的单质与冷水反应缓慢,但可与沸水迅速发生置换反应生成W的单质。下列有关说法错误的是
能组成红棕色的大气污染物,金属元素M的单质与冷水反应缓慢,但可与沸水迅速发生置换反应生成W的单质。下列有关说法错误的是A.简单离子半径: |
B.简单氢化物的还原性: |
C.由 三种元素组成的化合物的水溶液可能呈碱性 三种元素组成的化合物的水溶液可能呈碱性 |
D.M的氯化物的电子式为 |
您最近半年使用:0次
3 .  是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含
是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含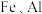 及其化合物、
及其化合物、 等杂质),生产
等杂质),生产 的工艺流程如下:
的工艺流程如下: )时的
)时的 如下表:
如下表:
② 溶液用水稀释后可生成
溶液用水稀释后可生成 沉淀。
沉淀。
(1)“酸浸”时提高浸取率的措施有___________ (写出两条)。
(2)滤渣I的主要成分是___________ (填化学式)。
(3)操作 为调节溶液的
为调节溶液的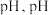 的最佳范围是
的最佳范围是___________ ,加入的物质X可以是___________ ( (填字母标号)。
A. B.
B.  C.
C.  D.
D.  溶液
溶液
(4)往滤液 中加入食盐并通入
中加入食盐并通入 可生成
可生成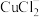 ,反应I的离子方程式为
,反应I的离子方程式为___________ ;在反应I中加入食盐并加热的目的是___________ 。
(5)实验室可以使用铜电极电解饱和食盐水得到 ,阳极的电极反应式为
,阳极的电极反应式为___________ 。
 是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含
是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含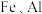 及其化合物、
及其化合物、 等杂质),生产
等杂质),生产 的工艺流程如下:
的工艺流程如下:
 )时的
)时的 如下表:
如下表:| 物质 |  |  |  |
开始沉淀时的 | 1.6 | 3.2 | 5.2 |
完全沉淀时的 | 3.1 | 4.7 | 6.7 |
 溶液用水稀释后可生成
溶液用水稀释后可生成 沉淀。
沉淀。(1)“酸浸”时提高浸取率的措施有
(2)滤渣I的主要成分是
(3)操作
 为调节溶液的
为调节溶液的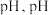 的最佳范围是
的最佳范围是A.
 B.
B.  C.
C.  D.
D.  溶液
溶液(4)往滤液
 中加入食盐并通入
中加入食盐并通入 可生成
可生成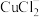 ,反应I的离子方程式为
,反应I的离子方程式为(5)实验室可以使用铜电极电解饱和食盐水得到
 ,阳极的电极反应式为
,阳极的电极反应式为
您最近半年使用:0次
4 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.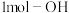 (羟基)与 (羟基)与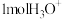 所含的电子数均为 所含的电子数均为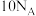 |
B.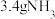 中含有 中含有 的数目为 的数目为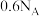 |
C.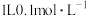 醋酸溶液中氢原子的数目为 醋酸溶液中氢原子的数目为 |
D.反应 中,每消耗 中,每消耗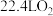 ,转移电子数目为 ,转移电子数目为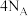 |
您最近半年使用:0次
解题方法
5 . 能正确表示下列反应的离子方程式为
A. 溶于NH4Cl溶液: 溶于NH4Cl溶液: |
B.纯碱溶液中加入足量稀硫酸: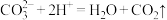 |
C.Na2S溶液中通入足量SO2: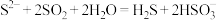 |
D.等体积等浓度的明矾溶液和 溶液混合: 溶液混合: |
您最近半年使用:0次
6 . NA为阿伏加德罗常数的值,下列叙述正确的是
A. 溶液中 溶液中 数目是NA 数目是NA |
B.标准状况下,11.2L C2H5OH中含 数目为0.5NA 数目为0.5NA |
| C.2.3g钠用铝箔包裹与足量水反应,生成H2的分子数大于0.05NA |
D.将1mol Br2溶于水形成的溶液中, 、 、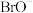 、HBrO个数之和为2NA 、HBrO个数之和为2NA |
您最近半年使用:0次
7 . 乙二胺四乙酸铁钠(化学式可用 表示,摩尔质量为
表示,摩尔质量为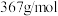 )可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
)可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
Ⅰ. 晶体制备
晶体制备
②快速搅拌条件下,向其中滴加氨水至过量,过滤并洗涤沉淀3次;
③将上述滤渣转移到三颈瓶中,保持80℃加热,边搅拌边逐滴滴加乙二胺四乙酸( )和碳酸钠溶液,调节
)和碳酸钠溶液,调节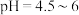 ,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积
,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积 ,冷却结晶得到土黄色高纯的
,冷却结晶得到土黄色高纯的 晶体。
晶体。
(1)步骤①盐酸过量的目的:一是作反应物,二是_______ 。
(2)写出上述颜色变为深棕色所发生离子反应方程式_______ 。
(3)滴加氨水时,滴加速率不宜过快且快速搅拌,其原因是_______ 。
(4)冷却水应从_______ (填“a”或“b”)口通入,仪器m的名称为_______ ;步骤③中宜采取的加热方式为_______ ;分离产品采取“趁热减压过滤”,趁热的目的是_______ 。
Ⅱ.纯度分析
准确称取20.00g产物放入 烧杯,加入
烧杯,加入 无氧蒸馏水和
无氧蒸馏水和 硫酸(
硫酸( ),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用
),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用 容量瓶定容。快速移取
容量瓶定容。快速移取 溶液至
溶液至 锥形瓶中,加入
锥形瓶中,加入
 混酸以掩蔽生成的
混酸以掩蔽生成的 的黄色,用
的黄色,用
 (
( )标准溶液平行滴定3次,平均消耗标准液
)标准溶液平行滴定3次,平均消耗标准液 。
。
(5) 标液应盛装在
标液应盛装在_______ (填“无色透明”或“棕色透明”)滴定管,滴定终点的现象为_______ 。
(6)上述 的纯度为
的纯度为_______ (保留4位有效数字)。
 表示,摩尔质量为
表示,摩尔质量为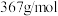 )可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
)可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:Ⅰ.
 晶体制备
晶体制备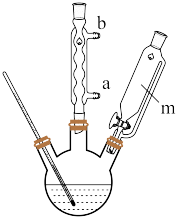
②快速搅拌条件下,向其中滴加氨水至过量,过滤并洗涤沉淀3次;
③将上述滤渣转移到三颈瓶中,保持80℃加热,边搅拌边逐滴滴加乙二胺四乙酸(
 )和碳酸钠溶液,调节
)和碳酸钠溶液,调节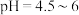 ,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积
,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积 ,冷却结晶得到土黄色高纯的
,冷却结晶得到土黄色高纯的 晶体。
晶体。(1)步骤①盐酸过量的目的:一是作反应物,二是
(2)写出上述颜色变为深棕色所发生离子反应方程式
(3)滴加氨水时,滴加速率不宜过快且快速搅拌,其原因是
(4)冷却水应从
Ⅱ.纯度分析
准确称取20.00g产物放入
 烧杯,加入
烧杯,加入 无氧蒸馏水和
无氧蒸馏水和 硫酸(
硫酸( ),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用
),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用 容量瓶定容。快速移取
容量瓶定容。快速移取 溶液至
溶液至 锥形瓶中,加入
锥形瓶中,加入
 混酸以掩蔽生成的
混酸以掩蔽生成的 的黄色,用
的黄色,用
 (
( )标准溶液平行滴定3次,平均消耗标准液
)标准溶液平行滴定3次,平均消耗标准液 。
。(5)
 标液应盛装在
标液应盛装在(6)上述
 的纯度为
的纯度为
您最近半年使用:0次
解题方法
8 . 碳酸锂是制备锂电池的重要原料。一种由α—锂辉石(主要成分可用 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下: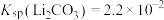 ,各离子沉淀pH范围:
,各离子沉淀pH范围:
回答下列问题:
(1)“煅烧”过程中 转化为
转化为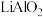 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式_______ 。
(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是_______ ;“调节pH”步骤应当控制的pH范围为_______ ,
(3)写出“除锰”过程中的离子反应方程式_______ 。若“除钙”后滤液中Li+浓度为0.2mol/L,则该步骤后 浓度应该低于
浓度应该低于_______ mol/L。
(4)已知 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:
“沉锂”后应该选择_______ ℃(选填“20”、“50”和“80”)蒸馏水洗涤,写出检验沉淀是否洗涤干净的操作_______ 。
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是_______ 。将碳酸锂与 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式_______ 。
 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
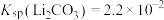 ,各离子沉淀pH范围:
,各离子沉淀pH范围:离子 |
|
|
|
|
开始沉淀pH | 7.6 | 2.7 | 3.8 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 5.2 | 9.8 |
(1)“煅烧”过程中
 转化为
转化为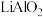 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是
(3)写出“除锰”过程中的离子反应方程式
 浓度应该低于
浓度应该低于(4)已知
 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:T/℃ | 20 | 50 | 80 |
| 1.33 | 1.10 | 0.85 |
| 34.2 | 32.5 | 30.7 |
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是
 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式
您最近半年使用:0次
9 . 已知 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A. 白磷( 白磷( )和甲烷均含有 )和甲烷均含有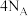 个共价键 个共价键 |
B.电解精炼铜,阴极增重12.8g,理论上转移的电子为 |
C.标况下,  含有的氧原子数目为 含有的氧原子数目为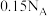 |
D.  溶液中, 溶液中,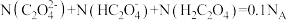 |
您最近半年使用:0次
10 . I.材料与生活、生产息息相关,目前使用的材料主要有:金属材料、传统无机非金属材料、新型无机非金属材料、高分子材料、复合材料等。
(1)硅酸盐材料是重要的传统无机非金属材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于传统硅酸盐产品的是_______ (填写序号)
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于_______ (填“纯净物”或“混合物”)。制造玻璃的原料_______ 、_______ 、_______ 。雕花玻璃的花纹是利用氢氟酸对普通玻璃中的二氧化硅的腐蚀作用而制成的,写出该反应的化学方程式_______ 。
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的_______ 反应;已知氮化硅中硅元素的化合价为+4价,则氮化硅的化学式为_______ 。
Ⅱ.目前,汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(4)请写出上述反应的化学方程式:_______ 。(需配平)
(5)分析上述反应_______ (是或否)为氧化还原反应。如果是,指出反应中的氧化剂和还原剂,如果不是,说明原因_______ 。
(1)硅酸盐材料是重要的传统无机非金属材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于传统硅酸盐产品的是
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的
Ⅱ.目前,汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(4)请写出上述反应的化学方程式:
(5)分析上述反应
您最近半年使用:0次