1 . 磷酸铁锂前驱体磷酸铁是一种重要的化工原料,被广泛用于汽车电池。用浓硫酸浸取钛铁矿(主要成分为 ),得到含
),得到含 的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:
的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:___________ 。
(2)先加入磷酸,再加入NaOH,调节pH约为2,生成磷酸铁沉淀。若 ,会导致
,会导致___________ ;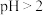 ,会导致
,会导致___________ 。
(3)经陈化、过滤后,所得滤液除少量磷酸铁外还含有的主要成分是___________ 。将滤液收集用于溶解步骤,其目的是___________ (答出两条即可)。
(4)在该流程中,以 、
、 、
、 和NaOH为反应物制得水合磷酸铁
和NaOH为反应物制得水合磷酸铁 总反应的离子方程式为
总反应的离子方程式为___________ 。
(5)煅烧水合磷酸铁过程中的TG(热重)及DSC(反映体系热量变化况,数值已省略)曲线如下图。样品在50~120℃有少量失重,可能是样品吸潮引起的少量游离水的损失(0.7%左右),从120℃开始有明显的失重,到200℃时失重达19.98%,则x值为___________ 。 为正交晶系结构,其晶胞参数为
为正交晶系结构,其晶胞参数为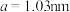 、
、 、
、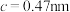 ,
, 。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为
。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ),得到含
),得到含 的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:
的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下: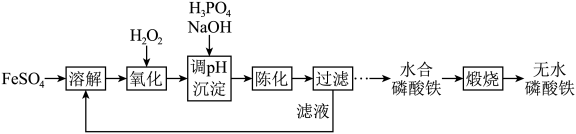
(2)先加入磷酸,再加入NaOH,调节pH约为2,生成磷酸铁沉淀。若
 ,会导致
,会导致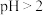 ,会导致
,会导致(3)经陈化、过滤后,所得滤液除少量磷酸铁外还含有的主要成分是
(4)在该流程中,以
 、
、 、
、 和NaOH为反应物制得水合磷酸铁
和NaOH为反应物制得水合磷酸铁 总反应的离子方程式为
总反应的离子方程式为(5)煅烧水合磷酸铁过程中的TG(热重)及DSC(反映体系热量变化况,数值已省略)曲线如下图。样品在50~120℃有少量失重,可能是样品吸潮引起的少量游离水的损失(0.7%左右),从120℃开始有明显的失重,到200℃时失重达19.98%,则x值为

 为正交晶系结构,其晶胞参数为
为正交晶系结构,其晶胞参数为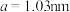 、
、 、
、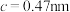 ,
, 。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为
。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。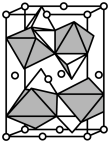
您最近半年使用:0次
今日更新
|
2次组卷
|
2卷引用:2024届河南省平许济洛四市高三下学期第四次质量检测理科综合试题-高中化学
名校
解题方法
2 . 硫脲[CS(NH2)2]在药物制备、金属矿物浮选等方面有广泛应用。实验室可通过先制备Ca(HS)2,然后Ca(HS)2再与CaCN2合成CS(NH2)2实验装置(夹持及加热装置略)如图所示。回答下列问题:
(1)仪器a的名称是___________ ,装置B中饱和NaHS溶液的作用是___________ 。装置C的作用为___________ 。
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是___________ ;然后关闭K1,打开K2,待A中反应结束后关闭K2。
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是___________ 。待D中反应结束后,关闭K3,打开K1,通入一段时间N2,目的是___________ 。
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴___________ 溶液(填化学式),溶液变为红色,则可证明。
(5)装置E中CuSO4溶液的作用是___________ (用离子方程式表示)。
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为___________ (用含m、c、V的代数式表示)。
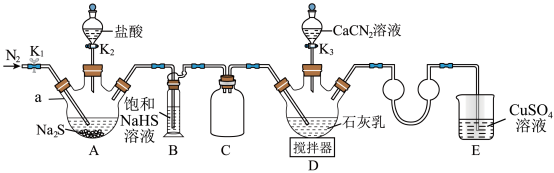
(1)仪器a的名称是
(2)检查装置气密性后加入药品,打开K1,通入一段时间N2,目的是
(3)撤走搅拌器,水浴加热装置D,打开K3,在80℃条件下合成硫脲,控制温度在80°C的原因是
(4)设计实验证明反应过程中硫脲发生异构化生成了NH4SCN;取少量粗产品于试管中,加入适量蒸馏水溶解,再加入几滴
(5)装置E中CuSO4溶液的作用是
(6)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取m g产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用c mol/L酸性KMnO4标准溶液滴定,滴定至终点时消耗标准溶液V mL(已知滴定时,硫脲转化为CO2、N2和
 ,假设杂质不参与反应)。则样品中硫脲的质量分数为
,假设杂质不参与反应)。则样品中硫脲的质量分数为
您最近半年使用:0次
7日内更新
|
162次组卷
|
3卷引用:河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题
名校
3 . 甲酸甲酯常用作杀菌剂、熏蒸剂和烟草处理剂,可由甲酸和甲醇反应制得。 为阿伏加德罗常数的值。下列有关说法正确的是
为阿伏加德罗常数的值。下列有关说法正确的是
 为阿伏加德罗常数的值。下列有关说法正确的是
为阿伏加德罗常数的值。下列有关说法正确的是A.pH=3的甲酸溶液中氢离子数目为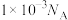 |
B.23g甲酸和8g甲醇中所含的氢原子数目均为 |
C.50g质量分数为64%的甲醇水溶液中含有σ键数目为 |
D.甲醇燃料电池中,每消耗22.4L(标准状况)甲醇,转移电子数目为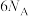 |
您最近半年使用:0次
7日内更新
|
47次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题
4 . 已知反应 ,
, 为阿伏加德罗常数的值,若生成22.4L
为阿伏加德罗常数的值,若生成22.4L (标况),下列说法错误的是
(标况),下列说法错误的是
 ,
, 为阿伏加德罗常数的值,若生成22.4L
为阿伏加德罗常数的值,若生成22.4L (标况),下列说法错误的是
(标况),下列说法错误的是A.转移的电子数目为 |
B. 是由非极性共价键形成的非极性分子 是由非极性共价键形成的非极性分子 |
C.参与反应的 含有孤电子对数为 含有孤电子对数为 |
| D.生成的还原产物质量为56g |
您最近半年使用:0次
5 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.标准状况下,22.4L乙烯含有的 键数目为 键数目为 |
B.58g正丁烷和异丁烷的混合物中共价键数目为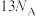 |
C.1mol基态碳原子核外电子占据的原子轨道数目为 |
D.12g金刚石含碳碳单键的数目为 |
您最近半年使用:0次
6 . 下列化学用语表示正确的是
A. 分子的空间填充模型: 分子的空间填充模型: |
B.基态 的价层电子轨道表示式: 的价层电子轨道表示式: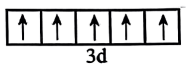 |
C. 的价层电子对互斥模型(VSEPR)模型: 的价层电子对互斥模型(VSEPR)模型: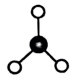 |
D.用原子轨道描述氢原子形成氢分子的过程: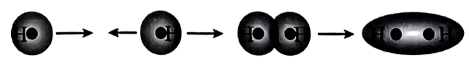 |
您最近半年使用:0次
7 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.78g苯中含有的碳碳双键数目为 |
B.1 L 0.5 mol⋅L  水溶液中含有的H原子个数为 水溶液中含有的H原子个数为 |
C.标准状况下,22.4 L苯乙烯最多可与 个 个 发生加成反应 发生加成反应 |
D.标准状况下,22.4 L由甲烷和乙烯组成的混合气体中含有的H原子数为 |
您最近半年使用:0次
8 . 有关X、Y、Z、W四种元素的描述如下: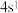
①基态 的离子结构示意图为
的离子结构示意图为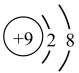
②基态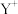 的轨道表示式为
的轨道表示式为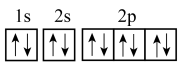
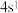
④基态W原子有3个电子层,其电子式为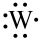
| A.金属性:Z<Y | B.X与W的最高正价相同 |
| C.YX的熔点高于YW的 | D.上述四种元素对应的单质的晶体类型有3种 |
您最近半年使用:0次
解题方法
9 . 下列化学用语表述正确的是
A.异戊烷的键线式: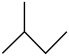 | B.乙基的电子式: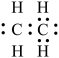 |
C. 的空间填充模型: 的空间填充模型: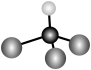 | D.丙炔的分子式: |
您最近半年使用:0次
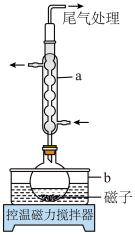
10 . 碘酸钙[ ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:
Ⅰ.将一定质量的 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用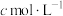 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
(1)仪器a的名称为___________ ,b中应盛放的最佳传热介质是___________ 。
(2)步骤Ⅰ中反应生成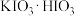 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:___________ 。反应过程中,在烧瓶瓶颈或仪器a下口处可能会看到___________ (填物质名称)析出,其原因是___________ 。
(3)步骤Ⅱ“一系列操作”包括静置、___________ 、洗涤、干燥,其中洗涤所用较佳试剂为___________ (填“水”或“乙醇”)。
(4)碘酸钙粗晶纯度为___________ %(用含a、c、V的代数式表示),下列情况导致产品纯度测定结果偏低的是___________ (填字母)。
A.所配待测溶液中含有 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数
C.盛放 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
 ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:Ⅰ.将一定质量的
 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1
 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL
 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用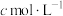 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
(1)仪器a的名称为
(2)步骤Ⅰ中反应生成
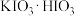 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:(3)步骤Ⅱ“一系列操作”包括静置、
(4)碘酸钙粗晶纯度为
A.所配待测溶液中含有
 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数C.盛放
 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
您最近半年使用:0次



