1 . 中国饮食文化博大精深,各个地区都有各自的特色菜肴,下列有关说法正确的是
|
|
| A.东坡肉:五花肉富含油脂,油脂属于高分子 | B.麻辣小龙虾:龙虾肉富含蛋白质,蛋白质一定含有H、C、N、O、S、P元素 |
|
|
| C.长沙臭豆腐:制作豆腐时需要使用石膏,石膏属于硫酸盐 | D.藜蒿炒腊肉:藜蒿的主要成分为纤维素,纤维素与淀粉互为同分异构体 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
2 .  无色、有刺激性气味,常温常压下为液态,沸点57.5℃。利用
无色、有刺激性气味,常温常压下为液态,沸点57.5℃。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co属于元素周期表___________ 区(填“s”“p”或“d”),基态Co原子核外电子共有___________ 种不同的空间运动状态。
(2)已知烧渣是LiCl、 和
和 的混合物,则“焙烧”时发生反应的化学方程式为
的混合物,则“焙烧”时发生反应的化学方程式为___________ 。
(3)鉴别洗净的“滤饼3”和固体 常用的实验方法名称是
常用的实验方法名称是___________ 。
(4)常温下,已知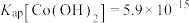 ,钴离子沉淀完全时
,钴离子沉淀完全时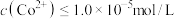 ,则“沉钴”时应控制pH≥
,则“沉钴”时应控制pH≥___________ 。(已知: ,结果保留两位小数)
,结果保留两位小数)
(5) 极易水解,生成中间体
极易水解,生成中间体 (
( )和第一步水解产物
)和第一步水解产物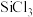 (OH)的机理如下:
(OH)的机理如下: 的离子方程式:
的离子方程式:___________ ;
② 比
比 易水解的原因可能是
易水解的原因可能是___________ (答一点即可)。
(6)已知 与
与 分子结构相似,与
分子结构相似,与 互溶,极易水解。选择合适仪器并组装蒸馏装置对
互溶,极易水解。选择合适仪器并组装蒸馏装置对 、
、 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧___________ (填序号),先馏出的物质为___________ 。
 无色、有刺激性气味,常温常压下为液态,沸点57.5℃。利用
无色、有刺激性气味,常温常压下为液态,沸点57.5℃。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: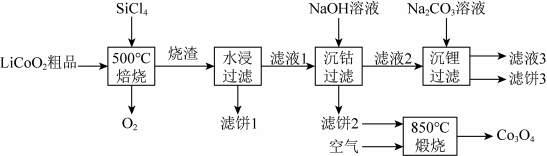
(1)Co属于元素周期表
(2)已知烧渣是LiCl、
 和
和 的混合物,则“焙烧”时发生反应的化学方程式为
的混合物,则“焙烧”时发生反应的化学方程式为(3)鉴别洗净的“滤饼3”和固体
 常用的实验方法名称是
常用的实验方法名称是(4)常温下,已知
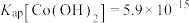 ,钴离子沉淀完全时
,钴离子沉淀完全时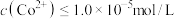 ,则“沉钴”时应控制pH≥
,则“沉钴”时应控制pH≥ ,结果保留两位小数)
,结果保留两位小数)(5)
 极易水解,生成中间体
极易水解,生成中间体 (
( )和第一步水解产物
)和第一步水解产物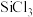 (OH)的机理如下:
(OH)的机理如下: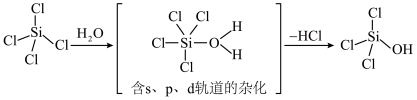
 的离子方程式:
的离子方程式:②
 比
比 易水解的原因可能是
易水解的原因可能是(6)已知
 与
与 分子结构相似,与
分子结构相似,与 互溶,极易水解。选择合适仪器并组装蒸馏装置对
互溶,极易水解。选择合适仪器并组装蒸馏装置对 、
、 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧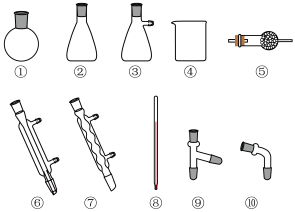
您最近半年使用:0次
名校
3 . 氯化氰 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为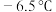 ,沸点为
,沸点为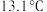 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。
(1)D装置中盛放 的仪器名称为
的仪器名称为_______ ,检验A装置气密性的方法是_______ 。
(2)A装置中发生反应生成 的离子方程式为
的离子方程式为_______ , 的作用是
的作用是_______ 。
(3)B、C装置中盛放的试剂相同,其作用是_______ 。F装置的作用是降低温度,其中干冰起作用的原因是_______ 。
(4)在 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为_______ ,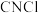 的电子式为
的电子式为_______ 。
(5)上述实验中, 完全反应时收集到
完全反应时收集到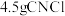 ,则产率为
,则产率为_______ %(保留2位小数)。
 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为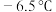 ,沸点为
,沸点为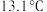 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。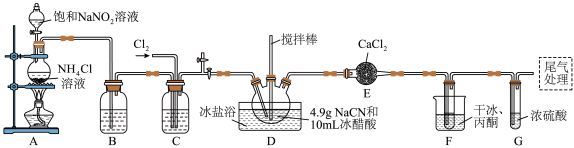
(1)D装置中盛放
 的仪器名称为
的仪器名称为(2)A装置中发生反应生成
 的离子方程式为
的离子方程式为 的作用是
的作用是(3)B、C装置中盛放的试剂相同,其作用是
(4)在
 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为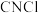 的电子式为
的电子式为(5)上述实验中,
 完全反应时收集到
完全反应时收集到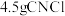 ,则产率为
,则产率为
您最近半年使用:0次
解题方法
4 . 氮化钛(TiN)是一种金黄色固体,熔点高、硬度大、且具有较高的导电性和超导性,可用于制备高温结构材料和超导材料。某实验小组以二氧化钛固体( )为原料制备TiN,实验装置如下图所示,夹持仪器已略去。回答下列问题:
)为原料制备TiN,实验装置如下图所示,夹持仪器已略去。回答下列问题:___________ 。
(2)已知在800℃时,装置C中反应生成TiN、 和
和 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(3)装置D的主要作用是___________ 。
(4)实验中部分操作如下:
①反应前,称取 样品;②打开装置A中仪器a的旋塞;
样品;②打开装置A中仪器a的旋塞;
③关闭装置A中仪器a的旋塞;④打开管式炉加热开关,加热至800℃左右;
⑤关闭管式炉加热开关,待装置冷却;⑥反应后,称得瓷舟中固体质量为 。
。
正确的操作顺序为:①→___________ →⑥(填标号)。
(5)经测定该方法制备的TiN纯度不高,原因可能是___________ 。
(6)TiN的晶胞结构如图所示,其晶胞参数为0.423nm,设 表示阿伏加德罗常数的值,则该晶体的密度为
表示阿伏加德罗常数的值,则该晶体的密度为___________  。(列出计算式)
。(列出计算式)
 )为原料制备TiN,实验装置如下图所示,夹持仪器已略去。回答下列问题:
)为原料制备TiN,实验装置如下图所示,夹持仪器已略去。回答下列问题:
(2)已知在800℃时,装置C中反应生成TiN、
 和
和 ,则该反应的化学方程式为
,则该反应的化学方程式为(3)装置D的主要作用是
(4)实验中部分操作如下:
①反应前,称取
 样品;②打开装置A中仪器a的旋塞;
样品;②打开装置A中仪器a的旋塞;③关闭装置A中仪器a的旋塞;④打开管式炉加热开关,加热至800℃左右;
⑤关闭管式炉加热开关,待装置冷却;⑥反应后,称得瓷舟中固体质量为
 。
。正确的操作顺序为:①→
(5)经测定该方法制备的TiN纯度不高,原因可能是
(6)TiN的晶胞结构如图所示,其晶胞参数为0.423nm,设
 表示阿伏加德罗常数的值,则该晶体的密度为
表示阿伏加德罗常数的值,则该晶体的密度为 。(列出计算式)
。(列出计算式)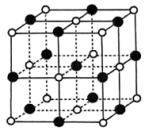
您最近半年使用:0次
5 . 在含 (过二硫酸根)和
(过二硫酸根)和 的溶液中,发生反应:
的溶液中,发生反应: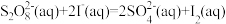 ,其分解机理及反应过程中的能量变化如图所示:
,其分解机理及反应过程中的能量变化如图所示:
 (过二硫酸根)和
(过二硫酸根)和 的溶液中,发生反应:
的溶液中,发生反应: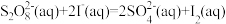 ,其分解机理及反应过程中的能量变化如图所示:
,其分解机理及反应过程中的能量变化如图所示:
| A.步骤②决定总反应的速率 |
| B.步骤①是吸热过程,步骤②是放热过程 |
C.由反应机理可以看出, 是中间产物 是中间产物 |
| D.反应中S元素不参与电子转移 |
您最近半年使用:0次
名校
解题方法
6 . 钼 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;
②钼酸铵 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。
(1)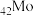 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为__________ 。
(2)“焙烧”中 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:________________ 。
(3)下列说法正确的是__________(填标号)。
(4) 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。
(5)经过结晶、过滤、洗涤、干燥等操作得到 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为__________ 。
(6) 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为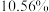 )通过该工艺最终得到
)通过该工艺最终得到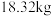 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为__________  。(保留一位小数,产率=
。(保留一位小数,产率=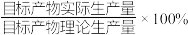 )
)
(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为__________ , 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为__________
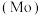 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。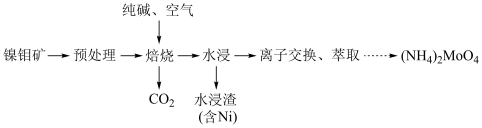
 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;②钼酸铵
 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。(1)
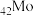 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为(2)“焙烧”中
 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:(3)下列说法正确的是__________(填标号)。
A.电负性: |
B.离子半径: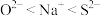 |
C.第一电离能: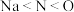 |
D.基态 中成对电子数与未成对电子数之比为 中成对电子数与未成对电子数之比为 |
(4)
 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。| A.分子间作用力 | B.金属键 |
| C.共价键 | D.离子键 |
(5)经过结晶、过滤、洗涤、干燥等操作得到
 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为(6)
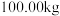 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为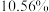 )通过该工艺最终得到
)通过该工艺最终得到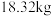 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为 。(保留一位小数,产率=
。(保留一位小数,产率=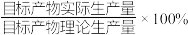 )
)(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在
 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为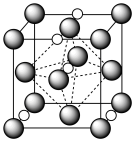
您最近半年使用:0次
7日内更新
|
59次组卷
|
2卷引用:2024届山西省晋城市高三下学期第三次模拟考试理科综合试题-高中化学
名校
7 . 焦亚硫酸钠 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
I.焦亚硫酸钠的制备
实验室制备少量 的装置如图所示。
的装置如图所示。 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、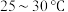 干燥,可获得
干燥,可获得 固体。
固体。
(1) 的VSEPR模型名称为
的VSEPR模型名称为__________ 。
(2)控制反应温度在 左右的原因是
左右的原因是_____________ 。
(3)装置 的作用是
的作用是__________ 。
(4)工业上亦可用 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:_______________ 。
(5)因为 具有
具有_________ 性,所以产品 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是_____________ 。
Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数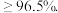 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为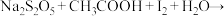
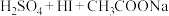 (未配平),
(未配平), 。
。
准确称取 样品,快速置于预先加入
样品,快速置于预先加入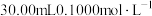 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。
(6)滴定终点的现象是_____________ 。
(7)该样品中焦亚硫酸钠的质量分数为__________  ,
,__________ (填“是”或“不是”)优质品。
 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:I.焦亚硫酸钠的制备
实验室制备少量
 的装置如图所示。
的装置如图所示。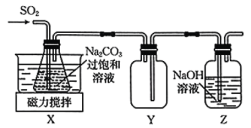
 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、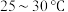 干燥,可获得
干燥,可获得 固体。
固体。(1)
 的VSEPR模型名称为
的VSEPR模型名称为(2)控制反应温度在
 左右的原因是
左右的原因是(3)装置
 的作用是
的作用是(4)工业上亦可用
 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:(5)因为
 具有
具有 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数
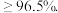 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为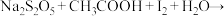
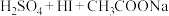 (未配平),
(未配平), 。
。准确称取
 样品,快速置于预先加入
样品,快速置于预先加入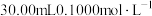 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。(6)滴定终点的现象是
(7)该样品中焦亚硫酸钠的质量分数为
 ,
,
您最近半年使用:0次
7日内更新
|
52次组卷
|
2卷引用:2024届山西省晋城市高三下学期第三次模拟考试理科综合试题-高中化学
名校
解题方法
8 . 某钒矿石的主要成分为 、
、 、
、 和
和 。一种从该矿石中提钒的工艺流程如下:
。一种从该矿石中提钒的工艺流程如下: 具有较强的氧化性,能被
具有较强的氧化性,能被 、乙醇、草酸和酒石酸还原为
、乙醇、草酸和酒石酸还原为 。
。
Ⅱ.萃取剂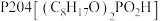 对V(Ⅳ)中的
对V(Ⅳ)中的 有很强的萃取能力,对Fe(Ⅱ)、Fe(Ⅲ)、Al(Ⅲ)和其他V(Ⅳ)微粒无萃取能力。萃取
有很强的萃取能力,对Fe(Ⅱ)、Fe(Ⅲ)、Al(Ⅲ)和其他V(Ⅳ)微粒无萃取能力。萃取 的平衡为
的平衡为
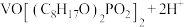 。回答下列问题:
。回答下列问题:
(1)“氯化焙烧”时气体与矿料逆流而行,目的是___________ 。该步操作中 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(2)“还原”时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)“操作X”为___________ ;试剂y为___________ (填化学式)。
(4)室温下,随着pH和浓度的变化,V(Ⅳ)微粒的区位优势图如图1。以氧化物的性质为分类依据, 物质类别为
物质类别为___________ 。“调pH”时,调节 的目的是
的目的是___________ ;N点存在平衡:
 ,其平衡常数的数值为
,其平衡常数的数值为___________ 。 表示阿伏加德罗常数的值,则该晶体密度为
表示阿伏加德罗常数的值,则该晶体密度为___________  (列出计算式即可)。
(列出计算式即可)。
 、
、 、
、 和
和 。一种从该矿石中提钒的工艺流程如下:
。一种从该矿石中提钒的工艺流程如下: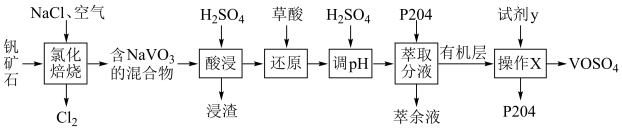
 具有较强的氧化性,能被
具有较强的氧化性,能被 、乙醇、草酸和酒石酸还原为
、乙醇、草酸和酒石酸还原为 。
。Ⅱ.萃取剂
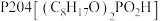 对V(Ⅳ)中的
对V(Ⅳ)中的 有很强的萃取能力,对Fe(Ⅱ)、Fe(Ⅲ)、Al(Ⅲ)和其他V(Ⅳ)微粒无萃取能力。萃取
有很强的萃取能力,对Fe(Ⅱ)、Fe(Ⅲ)、Al(Ⅲ)和其他V(Ⅳ)微粒无萃取能力。萃取 的平衡为
的平衡为
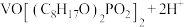 。回答下列问题:
。回答下列问题:(1)“氯化焙烧”时气体与矿料逆流而行,目的是
 发生反应的化学方程式为
发生反应的化学方程式为(2)“还原”时,
 发生反应的离子方程式为
发生反应的离子方程式为(3)“操作X”为
(4)室温下,随着pH和浓度的变化,V(Ⅳ)微粒的区位优势图如图1。以氧化物的性质为分类依据,
 物质类别为
物质类别为 的目的是
的目的是
 ,其平衡常数的数值为
,其平衡常数的数值为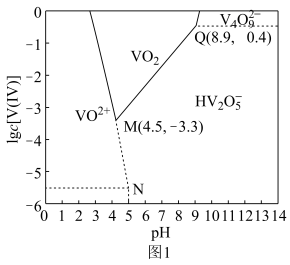
 表示阿伏加德罗常数的值,则该晶体密度为
表示阿伏加德罗常数的值,则该晶体密度为 (列出计算式即可)。
(列出计算式即可)。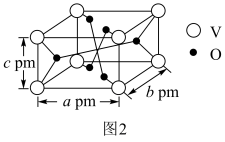
您最近半年使用:0次
名校
9 . 不列有关实验操作,现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 两支试管各盛有4mL | 加入 草酸溶液的试管中溶液紫色消失更快 草酸溶液的试管中溶液紫色消失更快 | 其他条件相同,反应物浓度越大,反应速率越快 |
| B | 向 | 溶液分层,上层呈橙红色 | 氧化性: |
| C | 向含相同浓度的KBr、KI混合溶液中依次加入少量氯水和 | 溶液分层,下层呈紫红色 | 氧化性: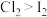 , , |
| D | 向脱脂棉上滴加蒸馏水和浓硫酸,反应后,再滴入少量新制氢氧化铜,加热 | 有砖红色沉淀产生 | 纤维素水解产物有醛基 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
10 . A~G的转化关系如图1所示(部分产物略去),其中E为红棕色气体,G为单质。常温下,将Al片浸在不同质量分数的C溶液中,经过相同时间的腐蚀后,Al片的质量损失情况如图2所示。
(1)写出下列物质的化学式:A___________ 、E___________ 。
(2)反应④、⑤的化学方程式:④___________ 、⑤___________ 。
(3)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为___________ 。
(4)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是___________ mL。
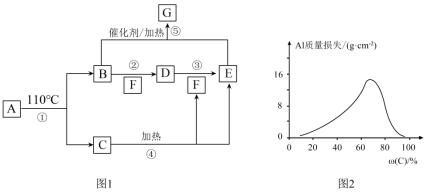
(1)写出下列物质的化学式:A
(2)反应④、⑤的化学方程式:④
(3)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为
(4)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是
您最近半年使用:0次





 酸性高锰酸钾溶液,分别加入2mL
酸性高锰酸钾溶液,分别加入2mL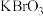 溶液中通入少量氯气,然后再加入少量苯,振荡,静置
溶液中通入少量氯气,然后再加入少量苯,振荡,静置

