名校
解题方法
1 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: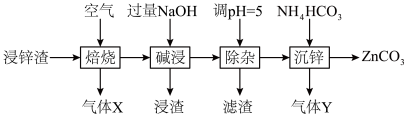
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):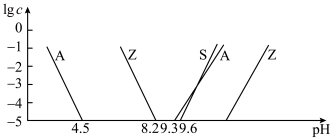
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近半年使用:0次
昨日更新
|
102次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题
名校
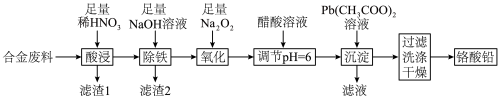
2 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
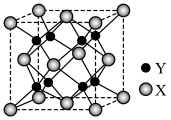
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近半年使用:0次
7日内更新
|
25次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
名校
解题方法
3 . 一种含Pt催化剂催化甲烷中的碳氢键活化的反应机理如图所示。下列有关说法正确的是
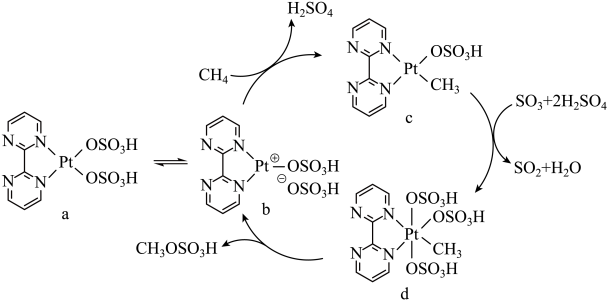
| A.SO2和SO3都是极性分子 | B.SO3是中间产物 |
| C.c→d的反应是氧化还原反应 | D.催化循环中Pt的配位数不改变 |
您最近半年使用:0次
7日内更新
|
34次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
名校
4 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.3.2g  、 、 混合气体所含质子的数目为 混合气体所含质子的数目为 |
B.25℃,101kPa下,56L 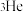 所含中子的数目为 所含中子的数目为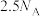 |
C.1L pH=1的 溶液中所含 溶液中所含 数目为 数目为 |
D.0.1mol环己烷(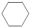 )中所含σ键数目为 )中所含σ键数目为 |
您最近半年使用:0次
5 . NA为阿伏伽德罗常数的值。下列说法正确的是
| A.100ml18mol/L的浓硫酸与足量Cu粉加热反应,产生SO2分子数为0.9NA |
| B.0.5mol/L的亚硫酸钠溶液中氧原子数为1.5NA |
| C.1molH2与足量的I2反应,体系中所含有的气体分子数为2NA |
| D.标况下,2.24LSO3中,所含的氧原子总数为0.3NA |
您最近半年使用:0次
解题方法
6 . Ⅰ.为观察亚硫酸钠和浓硫酸的反应现象并探究 与
与 之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:______ 。
(2)该实验过程中空气会对实验造成干扰,滴加浓硫酸之前应进行的操作是____________ 。
(3)装置 产生的现象是
产生的现象是_________________________ ,其中 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为________________________ ,体现了的
______ 性。
(4) 溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为
溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为 ,请写出脱硫(
,请写出脱硫( )反应的离子方程式:
)反应的离子方程式:____________ 。
Ⅱ.我国国家标准规定葡萄酒中的最大使用量为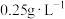 。该小组测定某干白葡萄酒中的含量(以游离计),将
。该小组测定某干白葡萄酒中的含量(以游离计),将 葡萄酒和足量盐酸共热,使全部逸出并与
葡萄酒和足量盐酸共热,使全部逸出并与 完全反应,除去过量的
完全反应,除去过量的 后,与
后,与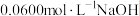 标准溶液反应,恰好消耗
标准溶液反应,恰好消耗 溶液
溶液 ,请回答:
,请回答:
(5)该葡萄酒中 的含量为
的含量为______  ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是________________________ 。
 与
与 之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
(2)该实验过程中空气会对实验造成干扰,滴加浓硫酸之前应进行的操作是
(3)装置
 产生的现象是
产生的现象是 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为
(4)
 溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为
溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为 ,请写出脱硫(
,请写出脱硫( )反应的离子方程式:
)反应的离子方程式:Ⅱ.我国国家标准规定葡萄酒中的最大使用量为
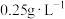 。该小组测定某干白葡萄酒中的含量(以游离计),将
。该小组测定某干白葡萄酒中的含量(以游离计),将 葡萄酒和足量盐酸共热,使全部逸出并与
葡萄酒和足量盐酸共热,使全部逸出并与 完全反应,除去过量的
完全反应,除去过量的 后,与
后,与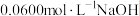 标准溶液反应,恰好消耗
标准溶液反应,恰好消耗 溶液
溶液 ,请回答:
,请回答:(5)该葡萄酒中
 的含量为
的含量为 ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是
您最近半年使用:0次
解题方法
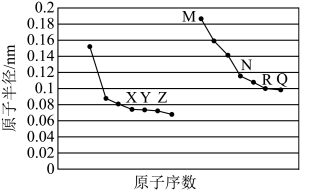
7 . 如图所示是部分短周期元素原子半径与原子序数的关系,回答下列问题: 在周期表中的位置是
在周期表中的位置是____________________ 。
(2) 、
、 的最高价氧化物对应的水化物中,酸性较强的物质是
的最高价氧化物对应的水化物中,酸性较强的物质是______ (填化学式)。
(3)用电子式表示化合物 的形成过程
的形成过程________________________ 。
(4)在溶液中,元素 、
、 、
、 形成的某化合物与
形成的某化合物与 的最高价氧化物对应的水化合物稀溶液之间反应既能产生无色刺激性气味气体,又能产生淡黄色沉淀,请写出发生反应的离子方程式
的最高价氧化物对应的水化合物稀溶液之间反应既能产生无色刺激性气味气体,又能产生淡黄色沉淀,请写出发生反应的离子方程式_______________ 。
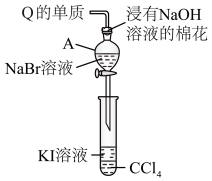
(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答: 与
与 的氧化性强弱:通入一定量
的氧化性强弱:通入一定量 的单质,充分反应后,将
的单质,充分反应后,将 中液体滴入试管内,取下试管,充分振荡、静置,可观察到
中液体滴入试管内,取下试管,充分振荡、静置,可观察到____________________ ;
该实验必须控制加入的 单质的量,否则得不出
单质的量,否则得不出 的氧化性比
的氧化性比 强。理由是
强。理由是______ 。
 在周期表中的位置是
在周期表中的位置是(2)
 、
、 的最高价氧化物对应的水化物中,酸性较强的物质是
的最高价氧化物对应的水化物中,酸性较强的物质是(3)用电子式表示化合物
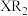 的形成过程
的形成过程(4)在溶液中,元素
 、
、 、
、 形成的某化合物与
形成的某化合物与 的最高价氧化物对应的水化合物稀溶液之间反应既能产生无色刺激性气味气体,又能产生淡黄色沉淀,请写出发生反应的离子方程式
的最高价氧化物对应的水化合物稀溶液之间反应既能产生无色刺激性气味气体,又能产生淡黄色沉淀,请写出发生反应的离子方程式(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答:
 与
与 的氧化性强弱:通入一定量
的氧化性强弱:通入一定量 的单质,充分反应后,将
的单质,充分反应后,将 中液体滴入试管内,取下试管,充分振荡、静置,可观察到
中液体滴入试管内,取下试管,充分振荡、静置,可观察到该实验必须控制加入的
 单质的量,否则得不出
单质的量,否则得不出 的氧化性比
的氧化性比 强。理由是
强。理由是
您最近半年使用:0次
解题方法
8 . 下列有关 的说法中正确的是
的说法中正确的是
 的说法中正确的是
的说法中正确的是A. 能与水反应生成硝酸,在反应中 能与水反应生成硝酸,在反应中 只是还原剂 只是还原剂 |
B.除去 中混有的 中混有的 ,可将混合气体通过水,将 ,可将混合气体通过水,将 溶解 溶解 |
C. 与溴蒸气的鉴别可用 与溴蒸气的鉴别可用 溶液,溶于 溶液,溶于 溶液得无色溶液的是 溶液得无色溶液的是 ,得橙色溶液的为溴蒸气 ,得橙色溶液的为溴蒸气 |
D.在 与水的反应中氧化剂与还原剂的质量之比为 与水的反应中氧化剂与还原剂的质量之比为 |
您最近半年使用:0次
解题方法
9 . 下列有关化学用语表述正确的是
A.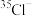 和 和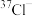 的离子结构示意图均可以表示为 的离子结构示意图均可以表示为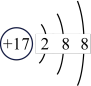 |
B. 的结构式: 的结构式: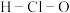 |
C. 的电子式: 的电子式: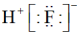 |
D.质子数为92、中子数为146的 原子: 原子: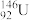 |
您最近半年使用:0次
解题方法
10 . V2O5广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备V2O5的工艺流程如下: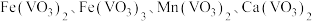 ;“酸浸”后钒以
;“酸浸”后钒以 形式存在,“中和、还原”后钒以VO2+形式存在。
形式存在,“中和、还原”后钒以VO2+形式存在。
ii.有机溶剂P204对四价钒VO2+具有高选择性,且萃取Fe3+而不萃取Fe2+。
iii.多钒酸铵微溶于冷水,易溶于热水。
iv。该工艺条件下,溶液中金属离子(浓度均为 )开始沉淀和完全沉淀的pH如下表所示:
)开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“破碎”的目的是___________ 。
(2)“中和、还原”时, 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
(3)洗涤多钒酸铵时要用冰水洗涤,目的是___________ 。
(4)“氧化”时,每消耗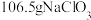 (本身被还原为NaCl),可得到
(本身被还原为NaCl),可得到
___________ mol。
(5)流程中可循环使用的物质有___________ 。
(6)“萃取”分离后,所得“水相”中含有丰富的金属资源,经三道工序可回收 溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整(可供选用的试剂:
溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整(可供选用的试剂: 溶液、
溶液、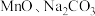 溶液、
溶液、 溶液)。
溶液)。
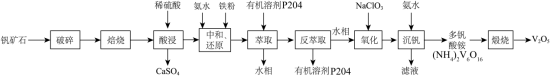
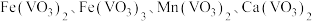 ;“酸浸”后钒以
;“酸浸”后钒以 形式存在,“中和、还原”后钒以VO2+形式存在。
形式存在,“中和、还原”后钒以VO2+形式存在。ii.有机溶剂P204对四价钒VO2+具有高选择性,且萃取Fe3+而不萃取Fe2+。
iii.多钒酸铵微溶于冷水,易溶于热水。
iv。该工艺条件下,溶液中金属离子(浓度均为
 )开始沉淀和完全沉淀的pH如下表所示:
)开始沉淀和完全沉淀的pH如下表所示:| 金属离子 | Fe3+ | Fe2+ | Ca2+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 11.9 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 13.9 | 10.1 |
(1)“破碎”的目的是
(2)“中和、还原”时,
 参与反应的离子方程式为
参与反应的离子方程式为(3)洗涤多钒酸铵时要用冰水洗涤,目的是
(4)“氧化”时,每消耗
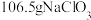 (本身被还原为NaCl),可得到
(本身被还原为NaCl),可得到
(5)流程中可循环使用的物质有
(6)“萃取”分离后,所得“水相”中含有丰富的金属资源,经三道工序可回收
 溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整(可供选用的试剂:
溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整(可供选用的试剂: 溶液、
溶液、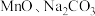 溶液、
溶液、 溶液)。
溶液)。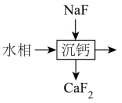
您最近半年使用:0次



