名校
1 . 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑保存试剂的容器)
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制100mL一定物质的量浓度的NaCl溶液 | 胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水NaCl固体 |
| B | 制备Fe(OH)3胶体 | 烧杯 | 饱和FeCl3溶液、NaOH溶液 |
| C | 探究Na2SO3样品是否变质 | 胶头滴管、试管 | 待测样品、蒸馏水、BaCl2溶液 |
| D | 检验钠在氧气中充分燃烧的产物 | 试管、酒精灯、胶头滴管 | 待测产物、蒸馏水、木条 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-10更新
|
303次组卷
|
2卷引用:山东省济南市2022-2023学年高一上学期期末考试化学试题
名校
2 . 氯碱工业的产物可用于制取“84”消毒液的主要成份次氯酸钠。
I.常温下,将 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
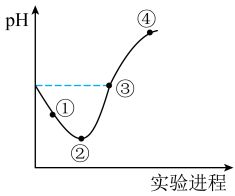
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
(2)③点所示溶液中:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);
(3)比较水的电离程度:曲线③点处___________ 曲线②点处。
II.探究发现 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
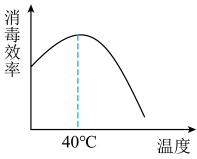
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因_______ 。
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中 的含量。
的含量。
其实验步骤为:称取工业烧碱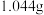 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的 )
)
(5)上述实验步骤中需要用到的全部定量仪器有:___________ 。
(6)计算该样品中 的质量分数为
的质量分数为___________ 。(用小数表示,保留至小数点后第3位)
(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
I.常温下,将
 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
A.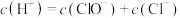 | B. |
C.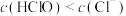 | D.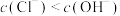 |
(2)③点所示溶液中:

 (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);(3)比较水的电离程度:曲线③点处
II.探究发现
 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中
 的含量。
的含量。其实验步骤为:称取工业烧碱
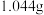 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的 )
)(5)上述实验步骤中需要用到的全部定量仪器有:
(6)计算该样品中
 的质量分数为
的质量分数为(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
| A.工业烧碱已发生潮解 | B.滴定时往锥形瓶中加水 |
| C.配制的待测液敞口放置时间过长 | D.滴定管水洗后未用标准盐酸润洗 |
您最近一年使用:0次
3 . 某 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
(1)样品中物质的量之比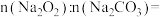
___________ 。
(2)盐酸的物质的量浓度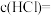
___________ 。
 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积/mL | 100.0 | 100.0 | 100.0 | 100.0 |
| 样品质量/g | 2.62 | 3.93 | 5.24 | 6.55 |
| 气体总体积/mL | 448 | 560 | 448 | 560 |
(1)样品中物质的量之比
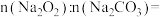
(2)盐酸的物质的量浓度
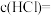
您最近一年使用:0次
4 . 对于某些离子或物质成分的检验及推断正确的是
| A.用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,说明原溶液中有Na+,可能有K+ |
| B.加入碳酸钾溶液产生白色沉淀,再加盐酸白色沉淀消失,推断溶液中含有Ca2+ |
| C.将Na2O2样品中加入稀盐酸,有气体产生,可推断Na2O2已变质 |
D.加入盐酸后有气体逸出,此气体能使澄清石灰水变浑浊,可判定溶液中只含有CO |
您最近一年使用:0次
5 . Ⅰ.高铁酸钾(K2FeO4) 是一种高效、无毒的强氧化剂,常温下为紫色固体,微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体。稳定性随pH的下降而减弱,酸性条件下易分解。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
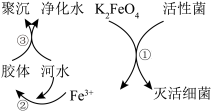
Ⅱ.K2FeO4的净水原理如图所示:
(2)下列说法错误的是___________
(3)写出K2FeO4与水反应的化学方程式___________ 。
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
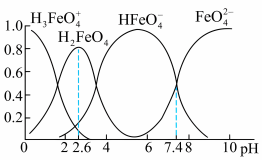
(4)①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②写出在此条件下,反应的离子方程式:___________ ;每生成39.6g K2FeO4,转移的电子数目为___________ ;
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而___________ (填“增强”、“减弱”或“不变”);
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:___________ ;
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:___________ 。
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:___________ (写出计算过程)。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
| A.铁粉具有还原性,可防止食物氧化变质 | B.高铁酸钾能溶于水,可作氧化剂 |
| C.氢氧化铁胶体具有碱性,可用于净水 | D.纯铁无杂质,可用作建筑材料 |
Ⅱ.K2FeO4的净水原理如图所示:

(2)下列说法错误的是___________
| A.K2FeO4中铁元素显+6价 |
| B.过程①中K2FeO4被细菌还原 |
| C.过程②中的Fe(OH)3胶体粒子带正电荷 |
| D.过程③中聚沉是由于胶体发生了渗析 |
(3)写出K2FeO4与水反应的化学方程式
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

(4)①为获得尽可能纯净的高铁酸盐,pH应控制在
②写出在此条件下,反应的离子方程式:
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
| 实验编号 | 反应试剂 | 实验现象 |
| Ⅰ | Cl2、FeCl3和少量KOH | 无明显现象 |
| Ⅱ | Cl2、FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Cl2、Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO
 + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
您最近一年使用:0次
6 . 某化学小组欲测定一份长期放置的补铁药品(有效成分是琥珀酸亚铁,化学式为FeC4H4O4)是否已变质,实验如下:
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色;
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色,再滴入3滴H2O2溶液,溶液红色加深;
Ⅲ.准确量取I中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g;
Ⅳ.再准确量取I中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)I中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4_______ HCl(填“>”或“<”)。
(2)用离子方程式解释II中实验现象产生的原因:_______ 、Fe3++3SCN-=Fe(SCN)3。
(3)IV中发生反应的离子方程式为_______ 。
(4)该补铁药中琥珀酸亚铁变质程度为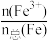 ×100%=
×100%=_______ (保留3位有效数字)。
(5)IV中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是_______ 。
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色;
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色,再滴入3滴H2O2溶液,溶液红色加深;
Ⅲ.准确量取I中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g;
Ⅳ.再准确量取I中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)I中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4
(2)用离子方程式解释II中实验现象产生的原因:
(3)IV中发生反应的离子方程式为
(4)该补铁药中琥珀酸亚铁变质程度为
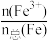 ×100%=
×100%=(5)IV中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是
您最近一年使用:0次
2023-08-26更新
|
169次组卷
|
5卷引用:作业(十九) 铁及其化合物之间的转化关系
名校
解题方法
7 . 下列关于铁及其化合物的说法正确的是
A.将 样品溶于稀 样品溶于稀 后,滴加 后,滴加 溶液,观察溶液是否变红,可以检验 溶液,观察溶液是否变红,可以检验 晶体是否已氧化变质 晶体是否已氧化变质 |
B.浓氨水中滴加 饱和溶液可制得 饱和溶液可制得 胶体 胶体 |
C.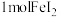 与足量氯气反应时转移的电子数为 与足量氯气反应时转移的电子数为 |
D.水溶液中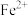 、 、 、 、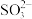 、 、 不能大量共存 不能大量共存 |
您最近一年使用:0次
2020-09-08更新
|
1077次组卷
|
3卷引用:人教版(2019)高一必修第一册 第三章素养检测
解题方法
8 . 铁和氯是高中阶段重要的化学元素,请阅读下列信息,回答问题:
Ⅰ.绘制价类图(化合价-物质类别)是学习元素化合物性质的重要方法,如图是铁元素的价类二维图。
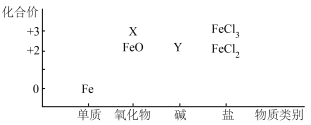
请回答下列问题:
(1)X、Y的化学式分别为___________ 、___________ 。
(2)FeO属于___________ (填“酸性”或“碱性”)氧化物,能与___________ (填试剂名称)反应生成FeCl2;从铁元素的价态分析,FeO与具有强氧化性的硝酸发生反应的氧化产物是___________ (填化学式)。
(3)FeCl3溶液能与铜片、NaOH溶液、KI溶液和KSCN溶液等发生反应,写出其中一个能体现Fe3+的氧化性的离子方程式___________ 。
Ⅱ.某品牌“84”消毒液包装上的说明如下图:
回答下列问题:
(4)该消毒液与洁厕灵同时使用会产生氯气,写出反应的离子方程式___________ 。
(5)理论上,一瓶上述“84”消毒液能从空气中吸收标准状况下___________ LCO2而变质(保留1位小数)。(已知:NaClO+CO2+H2O=NaHCO3+HClO)
Ⅰ.绘制价类图(化合价-物质类别)是学习元素化合物性质的重要方法,如图是铁元素的价类二维图。

请回答下列问题:
(1)X、Y的化学式分别为
(2)FeO属于
(3)FeCl3溶液能与铜片、NaOH溶液、KI溶液和KSCN溶液等发生反应,写出其中一个能体现Fe3+的氧化性的离子方程式
Ⅱ.某品牌“84”消毒液包装上的说明如下图:
| 84消毒液 有效成分:NaClO 规格:1000mL 质量分数:14.9% 物质的量浓度:2.2mol/L | 注意事项: 1.本品对棉织品有漂白脱色作用,有腐蚀性。 2.密封保存,请勿与洁厕灵同时使用。 3.保质期为一年。 |
(4)该消毒液与洁厕灵同时使用会产生氯气,写出反应的离子方程式
(5)理论上,一瓶上述“84”消毒液能从空气中吸收标准状况下
您最近一年使用:0次
名校
9 . I.神舟十九号载人航天飞船运载火箭用偏二甲肼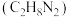 作燃料,四氧化二氮
作燃料,四氧化二氮 作推进剂,点燃后两者反应生成3种常见无污染物质。已知:常温下,
作推进剂,点燃后两者反应生成3种常见无污染物质。已知:常温下, 为无色液体,易溶于水;
为无色液体,易溶于水; 有剧毒,熔点为
有剧毒,熔点为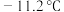 ,沸点为21.2℃,设NA为阿伏伽德罗常数的值。
,沸点为21.2℃,设NA为阿伏伽德罗常数的值。
(1)写出 和
和 发生反应的化学方程式:
发生反应的化学方程式:___________ 。
(2)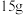
 中含有的N原子数为
中含有的N原子数为________ ,与_______ g 中含有的N原子数相同。
中含有的N原子数相同。
(3)将 a%的
a%的 水溶液跟
水溶液跟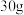 b%的
b%的 水溶液混合,得到的溶液密度为
水溶液混合,得到的溶液密度为 ,设
,设 的摩尔质量为
的摩尔质量为 ,则混合后溶液的物质的量浓度为
,则混合后溶液的物质的量浓度为___________ 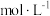 (用含字母的式子表示)。
(用含字母的式子表示)。
Ⅱ.化学工业为医疗等提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。某同学购买了一瓶“84”消毒液,部分标签如图所示。
净含量:1000 mL 密度:1.19 g·cm-3主要成分:25%NaClO
注意事项:密封保存,易吸收空气中的CO2变质,稀释100倍(体积比)后使用,回答下列问题:
(4)该同学取100 mL该“84”消毒液稀释后用于消毒(假设稀释后溶液密度为1 g·cm-3),稀释后的溶液中c(Na+)=___________ mol·L-1(保留一位有效数字)。
(5)“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中 使消毒杀菌能力增强,产物中有小苏打,请用离子方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用离子方程式说明原因:___________ 。一瓶“84”消毒液最多能吸收空气中___________ L CO2(标准状况下)。
(6)该同学参阅“84”消毒液的配方,欲用NaClO固体配制480 mL 0.2 mol·L-1的消毒液。
①需要的仪器有托盘天平、烧杯、玻璃棒、量筒、______ 。
②需要用托盘天平称量的NaClO固体质量为______ g。
③下列关于容量瓶的使用操作,正确的是______ 。 反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有
反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有 生成,该反应的化学方程式是
生成,该反应的化学方程式是________ 。
(8)下列操作可能导致所配溶液浓度偏低的是______ (填字母)。
A.移液时,未洗涤烧杯和玻璃棒B.溶解后未经冷却就移液
C.移液时,有少量液体溅出D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
(9)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO的有效氯含量为______ (计算结果保留两位小数)。
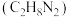 作燃料,四氧化二氮
作燃料,四氧化二氮 作推进剂,点燃后两者反应生成3种常见无污染物质。已知:常温下,
作推进剂,点燃后两者反应生成3种常见无污染物质。已知:常温下, 为无色液体,易溶于水;
为无色液体,易溶于水; 有剧毒,熔点为
有剧毒,熔点为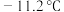 ,沸点为21.2℃,设NA为阿伏伽德罗常数的值。
,沸点为21.2℃,设NA为阿伏伽德罗常数的值。(1)写出
 和
和 发生反应的化学方程式:
发生反应的化学方程式:(2)
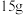
 中含有的N原子数为
中含有的N原子数为 中含有的N原子数相同。
中含有的N原子数相同。(3)将
 a%的
a%的 水溶液跟
水溶液跟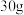 b%的
b%的 水溶液混合,得到的溶液密度为
水溶液混合,得到的溶液密度为 ,设
,设 的摩尔质量为
的摩尔质量为 ,则混合后溶液的物质的量浓度为
,则混合后溶液的物质的量浓度为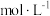 (用含字母的式子表示)。
(用含字母的式子表示)。Ⅱ.化学工业为医疗等提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。某同学购买了一瓶“84”消毒液,部分标签如图所示。
净含量:1000 mL 密度:1.19 g·cm-3主要成分:25%NaClO
注意事项:密封保存,易吸收空气中的CO2变质,稀释100倍(体积比)后使用,回答下列问题:
(4)该同学取100 mL该“84”消毒液稀释后用于消毒(假设稀释后溶液密度为1 g·cm-3),稀释后的溶液中c(Na+)=
(5)“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中
 使消毒杀菌能力增强,产物中有小苏打,请用离子方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用离子方程式说明原因:(6)该同学参阅“84”消毒液的配方,欲用NaClO固体配制480 mL 0.2 mol·L-1的消毒液。
①需要的仪器有托盘天平、烧杯、玻璃棒、量筒、
②需要用托盘天平称量的NaClO固体质量为
③下列关于容量瓶的使用操作,正确的是
A. B.
B. C.
C. D.
D.
 反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有
反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有 生成,该反应的化学方程式是
生成,该反应的化学方程式是(8)下列操作可能导致所配溶液浓度偏低的是
A.移液时,未洗涤烧杯和玻璃棒B.溶解后未经冷却就移液
C.移液时,有少量液体溅出D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
(9)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO的有效氯含量为
您最近一年使用:0次
10 . Ⅰ.钠是典型的金属元素,钠的化合物具有广泛的用途。请回答以下问题:
(1)15.6g 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中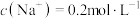 ,则X的摩尔质量为
,则X的摩尔质量为______ 。
(2) 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: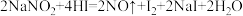 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为______ 。标况下,每生成11.2L的NO气体,转移的电子数约为______ 个。
(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO______  (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为______ (填字母序号)。
A. B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClO
Ⅱ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为______ 。
(5)流程中可循环利用的物质为______ (填化学式)。
(6)产品分析:把5.8g含有少量NaCl杂质的 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为______ (用百分数表示,保留到小数点后1位)。
(1)15.6g
 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中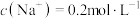 ,则X的摩尔质量为
,则X的摩尔质量为(2)
 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: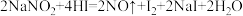 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与
 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为A.
 B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClOⅡ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为
(5)流程中可循环利用的物质为
(6)产品分析:把5.8g含有少量NaCl杂质的
 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为
您最近一年使用:0次



