名校
1 . 三草酸合铁( )酸钾晶体
)酸钾晶体 (
( ),
), 时在水中溶解度为
时在水中溶解度为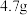 ,
, 时溶解度为
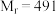
时溶解度为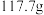 ,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备
,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备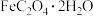 (夹持装置略去),后续再制取三草酸合铁(
(夹持装置略去),后续再制取三草酸合铁( )酸钾晶体。
)酸钾晶体。
实验一: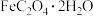 晶体的制备
晶体的制备
(1)打开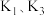 和
和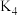 ,关闭
,关闭 ,向装置
,向装置 中加入稍过量的稀硫酸。
中加入稍过量的稀硫酸。
① 中盛放
中盛放 溶液的仪器名称为
溶液的仪器名称为___________ 。
②A中有气体产生,该气体的作用是___________ 。
(2)收集 并验纯后,打开
并验纯后,打开 ,关闭
,关闭___________ ,让A中浅绿色溶液流入 中,以生成
中,以生成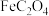 ,并分离得
,并分离得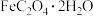 晶体。
晶体。
实验二:三草酸合铁( )酸钾晶体的制备
)酸钾晶体的制备
(3)将实验一得到的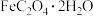 溶于水,加入
溶于水,加入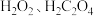 和
和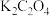 ,酒精灯微热并不断搅拌,反应制得
,酒精灯微热并不断搅拌,反应制得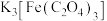 ,冷却、过滤、洗涤、干燥。
,冷却、过滤、洗涤、干燥。
①写出该反应的化学方程式:___________ 。
②“微热、搅拌”过程中,温度不宜过高的原因是___________ 。
③过滤后需用___________ 洗涤,其优点是___________ 。
(4)产品纯度的测定
常温下,取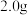 三草酸合铁(Ⅲ)酸钾晶体溶于水配制成
三草酸合铁(Ⅲ)酸钾晶体溶于水配制成 绿色溶液,取出25.00mL,用
绿色溶液,取出25.00mL,用 的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。
的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。
①滴定终点的判断依据是___________ 。
②该三草酸合铁( )酸钾晶体的纯度为
)酸钾晶体的纯度为___________ (保留三位有效数字)。
 )酸钾晶体
)酸钾晶体 (
( ),
), 时在水中溶解度为
时在水中溶解度为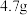 ,
, 时溶解度为
时溶解度为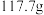 ,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备
,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备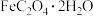 (夹持装置略去),后续再制取三草酸合铁(
(夹持装置略去),后续再制取三草酸合铁( )酸钾晶体。
)酸钾晶体。
实验一:
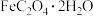 晶体的制备
晶体的制备(1)打开
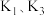 和
和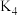 ,关闭
,关闭 ,向装置
,向装置 中加入稍过量的稀硫酸。
中加入稍过量的稀硫酸。①
 中盛放
中盛放 溶液的仪器名称为
溶液的仪器名称为②A中有气体产生,该气体的作用是
(2)收集
 并验纯后,打开
并验纯后,打开 ,关闭
,关闭 中,以生成
中,以生成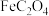 ,并分离得
,并分离得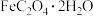 晶体。
晶体。实验二:三草酸合铁(
 )酸钾晶体的制备
)酸钾晶体的制备(3)将实验一得到的
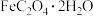 溶于水,加入
溶于水,加入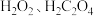 和
和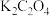 ,酒精灯微热并不断搅拌,反应制得
,酒精灯微热并不断搅拌,反应制得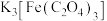 ,冷却、过滤、洗涤、干燥。
,冷却、过滤、洗涤、干燥。①写出该反应的化学方程式:
②“微热、搅拌”过程中,温度不宜过高的原因是
③过滤后需用
(4)产品纯度的测定
常温下,取
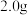 三草酸合铁(Ⅲ)酸钾晶体溶于水配制成
三草酸合铁(Ⅲ)酸钾晶体溶于水配制成 绿色溶液,取出25.00mL,用
绿色溶液,取出25.00mL,用 的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。
的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。①滴定终点的判断依据是
②该三草酸合铁(
 )酸钾晶体的纯度为
)酸钾晶体的纯度为
您最近一年使用:0次
名校
2 . 化学与生产、生活密切相关。回答下列问题:
I.家庭厨卫中有许多中学化学常见的物质,括号内为厨卫用品的主要成分。
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面( );⑤发酵粉(
);⑤发酵粉( 和明矾);⑥“84”消毒液(NaClO);⑦洁厕灵(HCl)。
和明矾);⑥“84”消毒液(NaClO);⑦洁厕灵(HCl)。
(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是___________ 。
(2)②③的主要成分可以归为一类物质,其分类的依据是___________(填字母)。
(3)写出过量⑦和④反应的离子方程式:___________ 。
(4)“84”消毒液和洁厕灵不能混合使用,用离子方程式解释其原因:___________ 。
(5)某同学用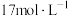 的浓硫酸配制480mL
的浓硫酸配制480mL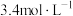 的稀硫酸用于增强“84”消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强“84”消毒液的消毒能力,需取用浓硫酸的体积为___________ mL。
Ⅱ.汽车安全气囊内装有 等物质。
等物质。
(6)当汽车发生严重碰撞时,引发 分解:
分解: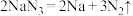 ,
, 的电子式为
的电子式为___________ ,若安全气囊内有65g ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为___________ L,产生的Na立即与 发生置换反应生成
发生置换反应生成 ,其中氧化剂和还原剂的物质的量之比是
,其中氧化剂和还原剂的物质的量之比是___________ 。
I.家庭厨卫中有许多中学化学常见的物质,括号内为厨卫用品的主要成分。
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面(
 );⑤发酵粉(
);⑤发酵粉( 和明矾);⑥“84”消毒液(NaClO);⑦洁厕灵(HCl)。
和明矾);⑥“84”消毒液(NaClO);⑦洁厕灵(HCl)。(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是
(2)②③的主要成分可以归为一类物质,其分类的依据是___________(填字母)。
| A.两种物质都是非电解质 | B.两种物质都是电解质 |
| C.两种物质都是氧化物 | D.两种物质都是含碳化合物 |
(3)写出过量⑦和④反应的离子方程式:
(4)“84”消毒液和洁厕灵不能混合使用,用离子方程式解释其原因:
(5)某同学用
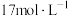 的浓硫酸配制480mL
的浓硫酸配制480mL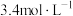 的稀硫酸用于增强“84”消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强“84”消毒液的消毒能力,需取用浓硫酸的体积为Ⅱ.汽车安全气囊内装有
 等物质。
等物质。(6)当汽车发生严重碰撞时,引发
 分解:
分解: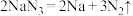 ,
, 的电子式为
的电子式为 ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为 发生置换反应生成
发生置换反应生成 ,其中氧化剂和还原剂的物质的量之比是
,其中氧化剂和还原剂的物质的量之比是
您最近一年使用:0次
名校
解题方法
3 . 钼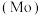 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;
②钼酸铵 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。
(1)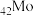 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为__________ 。
(2)“焙烧”中 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:________________ 。
(3)下列说法正确的是__________(填标号)。
(4)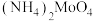 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。
(5)经过结晶、过滤、洗涤、干燥等操作得到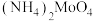 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为__________ 。
(6)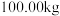 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为 )通过该工艺最终得到
)通过该工艺最终得到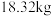 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为__________  。(保留一位小数,产率=
。(保留一位小数,产率=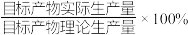 )
)
(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为__________ , 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为__________
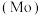 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。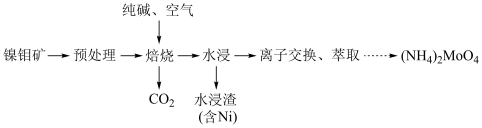
 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;②钼酸铵
 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。(1)
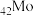 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为(2)“焙烧”中
 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:(3)下列说法正确的是__________(填标号)。
A.电负性: |
B.离子半径: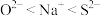 |
C.第一电离能: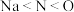 |
D.基态 中成对电子数与未成对电子数之比为 中成对电子数与未成对电子数之比为 |
(4)
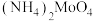 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。| A.分子间作用力 | B.金属键 |
| C.共价键 | D.离子键 |
(5)经过结晶、过滤、洗涤、干燥等操作得到
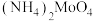 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为(6)
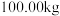 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为 )通过该工艺最终得到
)通过该工艺最终得到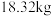 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为 。(保留一位小数,产率=
。(保留一位小数,产率=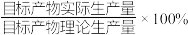 )
)(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在
 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为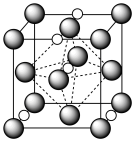
您最近一年使用:0次
昨日更新
|
130次组卷
|
3卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
解题方法
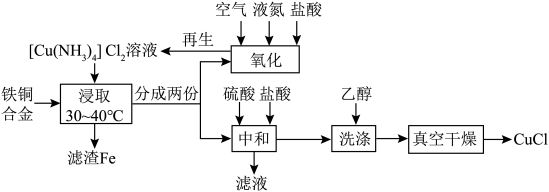
4 . CuCl为白色固体,难溶于水和乙醇,潮湿时易被氧化,常用作催化剂、杀菌剂、媒染剂、脱色剂。以废弃铁铜合金为原料制备CuCl的流程如图所示: ;②常温下,
;②常温下, 。
。
请回答下列问题:
(1)用再生液“浸取”铁铜合金不需要额外加热的原因可能为________ ;该阶段被氧化的铜元素与被还原的铜元素的质量之比为________ 。
(2)“氧化”阶段中最适宜的投料比为________ (填字母)。
a. b.
b. c.
c. d.
d.
(3)“中和”阶段的离子方程式为________ 。
(4)为了防止CuCl被氧化,上述流程中采取的两个措施是________ 。
(5)“中和”阶段会有部分铜元素被氧化。为了综合利用滤渣Fe和滤液,以提高CuCl的产率,试简述其方案:________ 。
(6)常温下, 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应的平衡常数为K,
,其反应的平衡常数为K, 的平衡常数为
的平衡常数为________ (用含K的代数式表示)。
 ;②常温下,
;②常温下, 。
。请回答下列问题:
(1)用再生液“浸取”铁铜合金不需要额外加热的原因可能为
(2)“氧化”阶段中最适宜的投料比为
a.
 b.
b. c.
c. d.
d.
(3)“中和”阶段的离子方程式为
(4)为了防止CuCl被氧化,上述流程中采取的两个措施是
(5)“中和”阶段会有部分铜元素被氧化。为了综合利用滤渣Fe和滤液,以提高CuCl的产率,试简述其方案:
(6)常温下,
 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应的平衡常数为K,
,其反应的平衡常数为K, 的平衡常数为
的平衡常数为
您最近一年使用:0次
名校
5 . 以高铅硫化锌原矿[主要含有ZnS,含有少量PbS、 、
、 、FeS、
、FeS、 (氧化铟)等]为原料制备单质Zn的工艺流程如图所示:
(氧化铟)等]为原料制备单质Zn的工艺流程如图所示: 。
。
②电解液浓度过大会导致溶液黏度变大,离子迁移速率低,电解效率低。
回答下列问题:
(1)“沸腾焙烧”的目的是______ ;其中杂质FeS充分焙烧产生大量废气,废气中主要成分的空间结构为______ 。
(2)“滤渣Ⅰ”的主要成分为______ 。
(3)“除铁”时 转化为FeOOH的离子方程式为
转化为FeOOH的离子方程式为______ 。
(4)“电解”硫酸锌溶液制备Zn的化学方程式为______ ,工业所需电解液浓度为40~60 的理由是
的理由是______ ,可用______ 光谱证明阴极析出的固体为Zn。
 、
、 、FeS、
、FeS、 (氧化铟)等]为原料制备单质Zn的工艺流程如图所示:
(氧化铟)等]为原料制备单质Zn的工艺流程如图所示:
 。
。②电解液浓度过大会导致溶液黏度变大,离子迁移速率低,电解效率低。
回答下列问题:
(1)“沸腾焙烧”的目的是
(2)“滤渣Ⅰ”的主要成分为
(3)“除铁”时
 转化为FeOOH的离子方程式为
转化为FeOOH的离子方程式为(4)“电解”硫酸锌溶液制备Zn的化学方程式为
 的理由是
的理由是
您最近一年使用:0次
名校
解题方法
6 . BaTiO3,被用作陶瓷电容器的介电材料、麦克风和其他传感器的压电材料。以含钛炉渣(主要成分是TiO2,含少量Fe2O3、CaO、SiO2等)为原料制备BaTiO3的流程如下:
回答下列问题:
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
(2)“还原”中发生反应的离子方程式为________ 。若省去“还原”工艺,则________ 。
(3)设计实验检验滤液1中是否含有Fe2+:________ 。
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为________ ,“焙烧”发生反应的化学方程式为________ 。
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为______ pm、______ pm。(用含 、
、 的代数式表示)
的代数式表示)
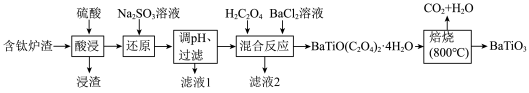
| 金属离子 | TiO2+ | Fe2+ | Fe3+ |
| 开始沉淀的pH | 0.5 | 6.3 | 1.5 |
| 完全沉淀的pH | 2.5 | 8.3 | 2.8 |
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
| A.[Xe]6s2 | B.[Xe]6s1 | C.[Xe]6s16p1 | D.[Xe]6s0p2 |
(2)“还原”中发生反应的离子方程式为
(3)设计实验检验滤液1中是否含有Fe2+:
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为
 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为 、
、 的代数式表示)
的代数式表示)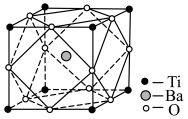
您最近一年使用:0次
解题方法
7 . 某小组同学探究Mg与 溶液的反应。
溶液的反应。
已知:i.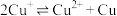
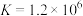
ⅱ.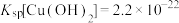
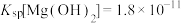
ⅲ. 为无色、
为无色、 为黄色
为黄色
实验I:将长约15cm打磨光亮的镁条放入2mL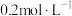
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:
(1)第一阶段析出红色固体发生反应的离子方程式是______ 。
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因______ 。
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是______ 。
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是______ 。
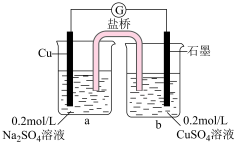
③小组同学采用电化学装置进行验证。______ 。从而证明了甲同学的猜想。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是______ 。
实验Ⅱ:改用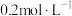
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
(5)经验证蓝色沉淀为 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是______ (填序号)。
a.反应放热,促使 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀
b.存在平衡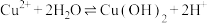 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀
c.由于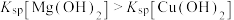 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀
(6)综上所述,影响Mg与 溶液反应的影响因素是
溶液反应的影响因素是______ 。
 溶液的反应。
溶液的反应。已知:i.
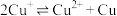
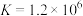
ⅱ.
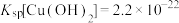
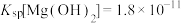
ⅲ.
 为无色、
为无色、 为黄色
为黄色实验I:将长约15cm打磨光亮的镁条放入2mL
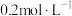
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:| 时间 | 第一阶段 0~1min | 第二阶段 1~8min | 第三阶段 8~25min | 第四阶段 25min~18h |
| 实验现象 | 镁条表面出现红色固体,伴有大量气体产生 | 仍然伴有大量气体,溶液变为淡蓝色,试管底部有蓝色沉淀产生 | 气体量不断减少,沉淀变为黄色 | 沉淀变为橙色,红色铜几乎不可见 |
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是
③小组同学采用电化学装置进行验证。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是
实验Ⅱ:改用
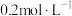
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。(5)经验证蓝色沉淀为
 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是a.反应放热,促使
 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀b.存在平衡
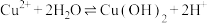 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀c.由于
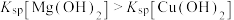 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀(6)综上所述,影响Mg与
 溶液反应的影响因素是
溶液反应的影响因素是
您最近一年使用:0次
解题方法
8 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□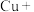 □
□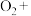 □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应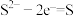 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
 | 向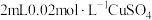 溶液中加入 溶液中加入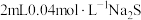 溶液 溶液 | 产生黑色固体 |
 | 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为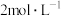 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
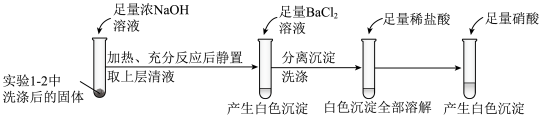
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
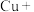 □
□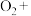 □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
| 序号 | 实验方案 | 实验现象 | |
| 3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
| 3-2 | a: 溶液 溶液b: 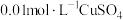 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
| 3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 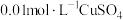 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
| 3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 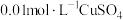 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
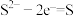 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近一年使用:0次
解题方法
9 . 3-硝基苯甲酰氯(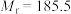 )能用于制染料和有机合成,一种实验室制备原理如图所示:
)能用于制染料和有机合成,一种实验室制备原理如图所示: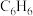 、
、 的沸点分别为80℃、78.6℃;②
的沸点分别为80℃、78.6℃;② 和3-硝基苯甲酰氯均易与水反应。
和3-硝基苯甲酰氯均易与水反应。
实验步骤:
ⅰ.在三颈烧瓶中加入3-硝基苯甲酸26.72g( )、50 mL
)、50 mL (0.42 mol)和200 mL无水苯;
(0.42 mol)和200 mL无水苯;
ⅱ.加热至80~85℃搅拌回流5h;
ⅲ.反应完毕,减压回收 和
和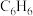 ,冷却,析出黄色晶体;
,冷却,析出黄色晶体;
ⅳ.抽滤、洗涤、干燥、提纯,得22.26g产品。
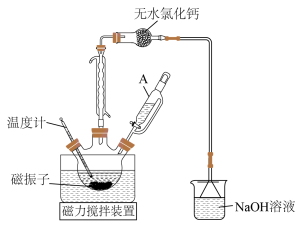
(1)三颈烧瓶洗涤干净后,组装仪器前必须进行的操作是____________ ;相对普通分液漏斗,仪器A的主要优点是____________ 。
(2)本实验中,需要加入一定量的苯,其目的是____________ 。
(3)无水氯化钙______ (填“能”或“不能”)用碱石灰代替,其原因是____________ 。
(4)磁振子起到的两个作用是____________ 。
(5)抽滤装置如图所示,抽滤的先后操作顺序为a→c→b→d→g→______ (填字母)。
e.取下抽滤瓶上的橡皮管f.关闭抽气泵g.洗涤h.确认抽干
(6)本实验3-硝基苯甲酰氯的产率为______ %。
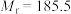 )能用于制染料和有机合成,一种实验室制备原理如图所示:
)能用于制染料和有机合成,一种实验室制备原理如图所示: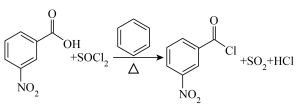
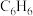 、
、 的沸点分别为80℃、78.6℃;②
的沸点分别为80℃、78.6℃;② 和3-硝基苯甲酰氯均易与水反应。
和3-硝基苯甲酰氯均易与水反应。实验步骤:
ⅰ.在三颈烧瓶中加入3-硝基苯甲酸26.72g(
 )、50 mL
)、50 mL (0.42 mol)和200 mL无水苯;
(0.42 mol)和200 mL无水苯;ⅱ.加热至80~85℃搅拌回流5h;
ⅲ.反应完毕,减压回收
 和
和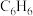 ,冷却,析出黄色晶体;
,冷却,析出黄色晶体;ⅳ.抽滤、洗涤、干燥、提纯,得22.26g产品。
(1)三颈烧瓶洗涤干净后,组装仪器前必须进行的操作是
(2)本实验中,需要加入一定量的苯,其目的是
(3)无水氯化钙
(4)磁振子起到的两个作用是
(5)抽滤装置如图所示,抽滤的先后操作顺序为a→c→b→d→g→
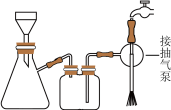
e.取下抽滤瓶上的橡皮管f.关闭抽气泵g.洗涤h.确认抽干
(6)本实验3-硝基苯甲酰氯的产率为
您最近一年使用:0次
名校
解题方法
10 . 锌电解阳极泥(主要成分为 和
和 ,还有少量锰铅氧化物
,还有少量锰铅氧化物 和
和 )是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题:
)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题: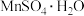 易溶于水,不溶于乙醇
易溶于水,不溶于乙醇
②在较高温度及酸性催化条件下,葡萄糖能发生如图反应: 时
时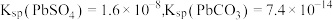
(1)已知 中
中 为
为 价,
价, 为
为 价和
价和 价,该氧化物中
价,该氧化物中 价和
价和 价
价 的物质的量之比为
的物质的量之比为_______ 。
(2)“还原酸浸”过程中主要反应的离子方程式为_______ ,该过程中实际葡萄糖加入量远大于理论需要量,其原因是_______ 。
(3)整个流程中可循环利用的物质是_______ (填名称)。获得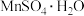 晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是
晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是_______ 。
(4)书写相关反应的离子方程式,并通过计算说明 时,可用
时,可用 溶液将“滤渣1”中的
溶液将“滤渣1”中的 完全转化为
完全转化为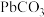 的原因
的原因_______ 。
(5)通过氢电极增压法可制得单质锌,装置如图1所示。电解池工作时总反应的离子方程式为_______ 。 和
和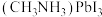 作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。
作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。
① 和
和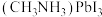 中
中 与
与 之间、
之间、 与
与 之间的离子键成分的百分数大小比较及解释
之间的离子键成分的百分数大小比较及解释_______ 。
②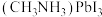 晶胞结构如图2所示,其中
晶胞结构如图2所示,其中 代表
代表 。当
。当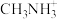 位于晶胞的体心时,
位于晶胞的体心时, 于晶胞的
于晶胞的_______ 位置(填“顶点”“面心”“棱心”或“晶胞内”)。
 和
和 ,还有少量锰铅氧化物
,还有少量锰铅氧化物 和
和 )是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题:
)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题: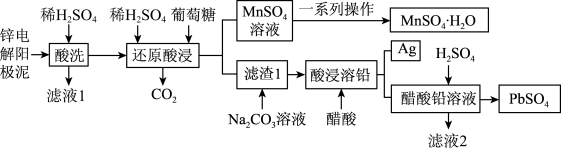
 易溶于水,不溶于乙醇
易溶于水,不溶于乙醇②在较高温度及酸性催化条件下,葡萄糖能发生如图反应:
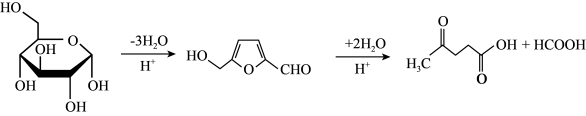
 时
时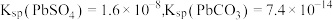
(1)已知
 中
中 为
为 价,
价, 为
为 价和
价和 价,该氧化物中
价,该氧化物中 价和
价和 价
价 的物质的量之比为
的物质的量之比为(2)“还原酸浸”过程中主要反应的离子方程式为
(3)整个流程中可循环利用的物质是
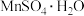 晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是
晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是(4)书写相关反应的离子方程式,并通过计算说明
 时,可用
时,可用 溶液将“滤渣1”中的
溶液将“滤渣1”中的 完全转化为
完全转化为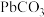 的原因
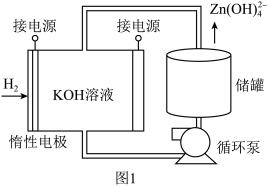
的原因(5)通过氢电极增压法可制得单质锌,装置如图1所示。电解池工作时总反应的离子方程式为
 和
和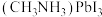 作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。
作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。①
 和
和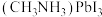 中
中 与
与 之间、
之间、 与
与 之间的离子键成分的百分数大小比较及解释
之间的离子键成分的百分数大小比较及解释②
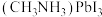 晶胞结构如图2所示,其中
晶胞结构如图2所示,其中 代表
代表 。当
。当 位于晶胞的体心时,
位于晶胞的体心时, 于晶胞的
于晶胞的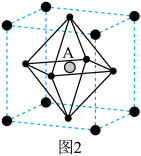
您最近一年使用:0次
7日内更新
|
88次组卷
|
2卷引用:新疆乌鲁木齐地区2024年高三下学期第三次质量监测化学试题




