名校
解题方法
1 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4装置如图所示,夹持、加热等装置略。
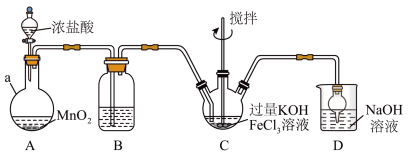
(1)A中发生反应的化学方程式为______ 。
(2)C中反应为放热反应,而反应温度需控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是_____ 。
(3)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
(4)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备K2FeO4装置如图所示,夹持、加热等装置略。

(1)A中发生反应的化学方程式为
(2)C中反应为放热反应,而反应温度需控制在0~5℃,采用的控温方法为
(3)写出C中总反应的离子方程式:
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。(4)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
解题方法
2 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 测定硫酸铜晶体中结晶水的含量 | 加热盛有硫酸铜晶体的蒸发皿,待固体全部呈白色后将蒸发皿放置在铁架台上冷却,再称重 |
| B | 检验Fe(NO3)2中是否混有Fe(NO3)3 | 取样品于试管中,滴加稀硫酸溶解,再滴加几滴KSCN溶液 |
| C | 探究Na2SO3固体样品是否变质 | 取少量待测样品溶于蒸馏水,再加入足量BaCl2溶液 |
| D | 验证Na2CO3溶液中同时存在K+ | 利用焰色试验,透过蓝色钴玻璃后,发现火焰呈紫色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 下列方案设计、现象和结论有不正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 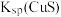 和 和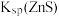 的比较 的比较 | 向含有ZnS的悬浊液中滴入少量的 溶液 溶液 | 出现黑色沉淀,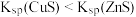 |
| B | 比较水分子、氨分子与铜离子结合能力强弱 | 取适量硫酸铜粉末溶于水,再向溶液中加入足量浓氨水 | 硫酸铜粉末溶解后显蓝色,加足量浓氨水后得到深蓝色溶液,则氨分子结合铜离子能力强于水分子 |
| C |  固体样品是否变质 固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液 溶液 | 若有白色沉淀产生,则样品已经变质 |
| D |  和 和 的 的 大小 大小 | 用pH试纸分别测  溶液和 溶液和 溶液的pH 溶液的pH | 若 则说明 则说明 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 氨基甲酸铵是一种白色固体,易水解,是工业上生产尿素的副产物,可以用于药物合成。实验室向四氯化碳中通入干燥的二氧化碳和氨气制取氨基甲酸铵固体,实验装置如下图,反应的化学方程式为 。
。
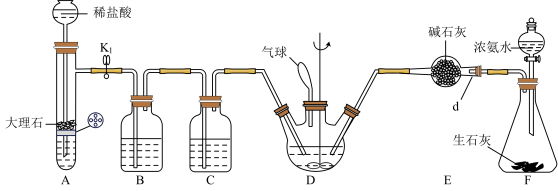
回答下列问题:
(1)仪器d的名称为
___________ ;装置F中发生反应的化学方程式为
___________ 。
(2)装置B中盛放的试剂为
___________ 。
(3)装置D中气球的作用是
___________ 。
(4)反应过程中需要将装置D放入冰水浴中,原因是
___________ 。
(5)氨基甲酸铵易水解,在潮湿的空气中发生水解反应生成碳酸氢铵的化学方程式为
________ 。
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品
 ,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为
,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为
 。则样品中氨基甲酸铵的物质的量分数为
。则样品中氨基甲酸铵的物质的量分数为
___________ 。(碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)。
 。
。
回答下列问题:
(1)仪器d的名称为
(2)装置B中盛放的试剂为
(3)装置D中气球的作用是
(4)反应过程中需要将装置D放入冰水浴中,原因是
(5)氨基甲酸铵易水解,在潮湿的空气中发生水解反应生成碳酸氢铵的化学方程式为
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品
 ,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为
,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为 。则样品中氨基甲酸铵的物质的量分数为
。则样品中氨基甲酸铵的物质的量分数为
您最近一年使用:0次
名校
解题方法
5 . 根据下列实验操作和现象,得出实验结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 常温下,将铝片分别插入浓硫酸和稀硫酸中,前者无明显现象,后者产生气泡 | 浓硫酸的氧化性比稀硫酸的弱 |
| B | 取少量 样品溶于水,加入 样品溶于水,加入 溶液,再加入足量盐酸,产生白色沉淀 溶液,再加入足量盐酸,产生白色沉淀 | 原样品已变质 |
| C | 将酸性 溶液滴入甲苯中,振荡,溶液颜色变浅 溶液滴入甲苯中,振荡,溶液颜色变浅 | 甲苯萃取了 |
| D | 将饱和溴水逐滴加入加到苯酚溶液中,边滴边振荡,最终产生白色沉淀 | 酚羟基活化了苯环 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 常温下,根据下列实验操作和现象得出的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 分别测量浓度均为0.1mol·L-1Na2CO3溶液和Na[Al(OH)4]溶液的pH,后者pH更大 | Al(OH) 比CO 比CO 更容易结合H+ 更容易结合H+ |
| B | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,出现白色沉淀 | 亚硫酸钠样品已变质 |
| C | 将盐酸滴入Na2CO3溶液产生无色气体,将产生的气体直接通入Na2SiO3溶液, | 非金属性:Cl>C>Si |
| D | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
7 . 下列实验操作或实验方案,能达到目的的是
选项 | 实验操作或实验方案 | 目的 |
A | 向有MnO2固体的圆底烧瓶中加入浓盐酸,产生的气体依次通过饱和食盐水和浓硫酸 | 制取并纯化氯气 |
B | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 | 检验Na2SO3固体是否变质 |
C | 用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝 | 证明该气体为Cl2 |
D | 将NaOH待测液滴在湿润的pH试纸上,与标准比色卡对照 | 测定NaOH溶液的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 为探索工业废料的再利用,某化学兴趣小组用含有铝、铁和铜等合金废料制取纯碱、氧化铝和绿矾(FeSO4·7H2O),其工艺流程如下图。
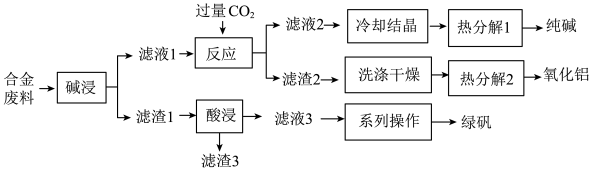
请回答下列问题:
(1)写出“碱浸”中发生反应的化学方程式_______ ,滤渣2的主要成分是_______ (填化学式)。
(2)写出“酸浸”中发生反应的离子方程式_______ ,滤渣3的主要成分是_______ (填化学式)。
(3)写出“热分解1”的化学方程式为_______ ,纯碱在生产生活中的一种用途是_______ 。
(4)该工艺流程中,可循环的物质是_______ (填化学式)。
(5)绿矾可用作补铁剂,长期放置易被氧化而变质。为了探究某绿矾样品是否已变质和变质的程度,该小组同学将样品溶于水,制成待测液,进行如下实验。

请回答下列问题:
(1)写出“碱浸”中发生反应的化学方程式
(2)写出“酸浸”中发生反应的离子方程式
(3)写出“热分解1”的化学方程式为
(4)该工艺流程中,可循环的物质是
(5)绿矾可用作补铁剂,长期放置易被氧化而变质。为了探究某绿矾样品是否已变质和变质的程度,该小组同学将样品溶于水,制成待测液,进行如下实验。
| 实验步骤 | 实验现象 | 结论或方程式 |
| 步骤一:取待测液于试管中,向其中滴加KSCN溶液 | ① | 待测液含有Fe3+。 |
| 步骤二:另取待测液于试管中,向其中滴加② | ③ | 待测液含有Fe2+。 |
| 实验结论:该绿矾样品是部分变质的。 | ||
您最近一年使用:0次
名校
解题方法
9 . 氧钒(IV)碱式碳酸铵化学式为(NH4)5[(VO)6(CO3)4(OH)9]•10H2O,它是制备热敏材料VO2的原料,已知VO2+在酸性条件下易被氧化,氧钒(IV)碱式碳酸铵的制备流程如图:
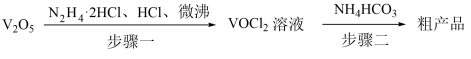
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能_______ ;生成VOCl2的同时,还生成一种无色无污染的气体,该反应的化学方程式为_______ 。
(2)步骤二可在如图装置中进行。

①接口的连接顺序为a→_______ 。
②实验开始时,先关闭K2,打开K1,当_______ 时(写实验现象),再关闭K1,打开K2,充分反应,静置,得到固体。
(3)测定产品纯度
称取mg样品用稀硫酸溶解后,加入50.0mL0.02mol•L-1KMnO4溶液,VO2+转化成VO ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
①滴定至反应终点的现象为_______ ;
②样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为_______ %;
③下列情况会导致产品纯度偏大的是_______ (填标号)。
A.Na2SO3溶液部分变质
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
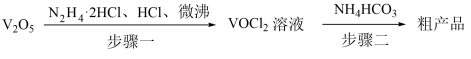
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能
(2)步骤二可在如图装置中进行。

①接口的连接顺序为a→
②实验开始时,先关闭K2,打开K1,当
(3)测定产品纯度
称取mg样品用稀硫酸溶解后,加入50.0mL0.02mol•L-1KMnO4溶液,VO2+转化成VO
 ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。①滴定至反应终点的现象为
②样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为
③下列情况会导致产品纯度偏大的是
A.Na2SO3溶液部分变质
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
您最近一年使用:0次
2023-06-18更新
|
375次组卷
|
3卷引用:安徽省合肥一六八中学2023届高三下学期最后一卷理科综合化学试题
名校
10 . 锶(Sr)和镁位于同主族,锶比镁更活泼,锶与氮气在加热条件下反应产生氮化锶,已知氮化锶遇水剧烈反应。某同学设计如下两种不同装置制备氮化锶(Sr3N2式量:290.8)。

方案I:上图1是用饱和氯化铵溶液和亚硝酸钠溶液制备氮气来制取氮化锶。
(1)仪器A的名称是___________ 。
(2)实验时先点燃___________ 处酒精灯(填“B”或“C”),一段时间后,再点燃另一只酒精灯。
方案II:上图2是直接利用氮气样品来制取氮化锶。
已知:①所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质;
②醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力,连苯三酚碱性溶液能定量吸收O2。
(3)装置F、G、H盛装的试剂分别是___________ (填代号)。
a.浓硫酸 b.连苯三酚碱性溶液 c.醋酸二氨合亚铜溶液
(4)方案I和方案II装置设计存在相同的缺陷,可能会导致产品变质,提出改进措施为:_____ 。
(5)产品纯度的测定:称取0.8000g方案I中所得产品,加入干燥的三颈瓶中,加入蒸馏水,并通入足量水蒸气,将产生的氨全部蒸出,用20.00mL1.00mol/L的盐酸标准溶液完全吸收,再用1.00mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00mLNaOH溶液。
①若用酚酞作指示剂,滴定终点的现象是___________ ;
②则产品纯度为___________ (计算结果保留4位有效数字);
③若氨没有完全蒸出,则会导致产品纯度___________ (填“偏大”、“偏小”或“不影响”)。

方案I:上图1是用饱和氯化铵溶液和亚硝酸钠溶液制备氮气来制取氮化锶。
(1)仪器A的名称是
(2)实验时先点燃
方案II:上图2是直接利用氮气样品来制取氮化锶。
已知:①所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质;
②醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力,连苯三酚碱性溶液能定量吸收O2。
(3)装置F、G、H盛装的试剂分别是
a.浓硫酸 b.连苯三酚碱性溶液 c.醋酸二氨合亚铜溶液
(4)方案I和方案II装置设计存在相同的缺陷,可能会导致产品变质,提出改进措施为:
(5)产品纯度的测定:称取0.8000g方案I中所得产品,加入干燥的三颈瓶中,加入蒸馏水,并通入足量水蒸气,将产生的氨全部蒸出,用20.00mL1.00mol/L的盐酸标准溶液完全吸收,再用1.00mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00mLNaOH溶液。
①若用酚酞作指示剂,滴定终点的现象是
②则产品纯度为
③若氨没有完全蒸出,则会导致产品纯度
您最近一年使用:0次



