名校
1 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中 而变质。为了测定过氧化钠的纯度,称取ag样品并设计如图装置来测定过氧化钠的质量分数。
而变质。为了测定过氧化钠的纯度,称取ag样品并设计如图装置来测定过氧化钠的质量分数。
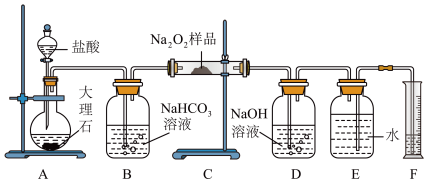
(1)将仪器连接好以后,必须进行的第一步操作是___________ 。
(2)装置C中发生反应的化学方程式为___________ 、___________ 。
(3)D中NaOH溶液的作用为___________ 。
(4)实验结束时,读取实验中生成气体的体积时,不合理的是___________ 。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.读取量筒中水的体积时,应使视线与凹液面的最低点相平
(5)读出量筒内水的体积后,折算成标准状况下氧气的体积为 ,则样品中过氧化钠的质量分数为
,则样品中过氧化钠的质量分数为___________ 。
 而变质。为了测定过氧化钠的纯度,称取ag样品并设计如图装置来测定过氧化钠的质量分数。
而变质。为了测定过氧化钠的纯度,称取ag样品并设计如图装置来测定过氧化钠的质量分数。
(1)将仪器连接好以后,必须进行的第一步操作是
(2)装置C中发生反应的化学方程式为
(3)D中NaOH溶液的作用为
(4)实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.读取量筒中水的体积时,应使视线与凹液面的最低点相平
(5)读出量筒内水的体积后,折算成标准状况下氧气的体积为
 ,则样品中过氧化钠的质量分数为
,则样品中过氧化钠的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 高铁酸盐是优良的多功能水处理剂。
 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在
溶液,难溶于有机物;在 、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。
。
某实验小组以次氯酸盐和铁盐为原料制备少量高铁酸钾 并测定产品纯度。
并测定产品纯度。
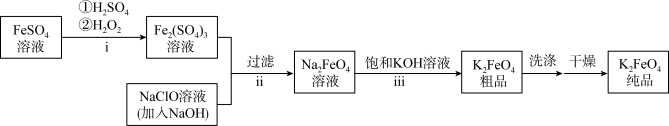
(一)根据上图回答下列问题:
(1)i中反应的离子方程式是___________ ;
(2)检验 溶液中是否含有
溶液中是否含有 的离子方程式
的离子方程式___________ ;
(3)将ii中反应的离子方程式补充完整:_______
___________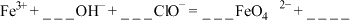 +___________
+___________
(4)iii中反应说明溶解度:
___________  (填“>”或“<”);
(填“>”或“<”);
(5)反应iii中 必须过量的原因是
必须过量的原因是___________ 。
(二)制备 强碱性饱和溶液:
强碱性饱和溶液:
①将 溶液加入仪器b中,冷水浴冷却,通入
溶液加入仪器b中,冷水浴冷却,通入 搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。
搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。

②将所得饱和 倒入烧杯并置于冷水浴中,分几次加入
倒入烧杯并置于冷水浴中,分几次加入 固体并不断傥拌,过滤,得
固体并不断傥拌,过滤,得 强碱性饱和溶液。
强碱性饱和溶液。
(6)仪器a的名称为___________ ,该仪器的作用是___________ ;仪器b的名称为___________ 。
(7)写出甲装置中反应的离子方程式___________ 。
(8)石灰乳的作用是___________ 。
(9)反应过程中用冷水浴冷却的原因是___________ 。
(三)合成
①将 溶液,在冷水浴中分批加入(二)中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即
溶液,在冷水浴中分批加入(二)中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即 )。
)。
②离心分离除去 水解得到的
水解得到的 胶体,留上层清液(深紫红色)。
胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入 饱和溶液
饱和溶液 ,冰水浴保持
,冰水浴保持 ,过滤,得
,过滤,得 (相对分子质量为198)粗产品。
(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品。
(10)用异丙醇洗涤的目的是___________ 。
(四) 产品纯度的测定
产品纯度的测定
准确称取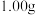 制得的晶体,配成
制得的晶体,配成 溶液,准确量取
溶液,准确量取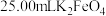 溶液放入锥形瓶,
溶液放入锥形瓶,
①加入足量 和
和 溶液,振荡,再加入稀硫酸酸化后得
溶液,振荡,再加入稀硫酸酸化后得 和
和 ,
,
②滴入几滴二苯胺磺酸钠作指示剂,用 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液
标准溶液 。
。
(11)加入 标准溶液后反应的离子方程式为
标准溶液后反应的离子方程式为___________ ;
(12)用根据以上数据,样品中 的质量分数为
的质量分数为___________ 。
(13)若 标准溶液部分变质,会使测定结果
标准溶液部分变质,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在
溶液,难溶于有机物;在 、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。
。某实验小组以次氯酸盐和铁盐为原料制备少量高铁酸钾
 并测定产品纯度。
并测定产品纯度。
(一)根据上图回答下列问题:
(1)i中反应的离子方程式是
(2)检验
 溶液中是否含有
溶液中是否含有 的离子方程式
的离子方程式(3)将ii中反应的离子方程式补充完整:
___________
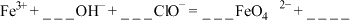 +___________
+___________(4)iii中反应说明溶解度:

 (填“>”或“<”);
(填“>”或“<”);(5)反应iii中
 必须过量的原因是
必须过量的原因是(二)制备
 强碱性饱和溶液:
强碱性饱和溶液:①将
 溶液加入仪器b中,冷水浴冷却,通入
溶液加入仪器b中,冷水浴冷却,通入 搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。
搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。
②将所得饱和
 倒入烧杯并置于冷水浴中,分几次加入
倒入烧杯并置于冷水浴中,分几次加入 固体并不断傥拌,过滤,得
固体并不断傥拌,过滤,得 强碱性饱和溶液。
强碱性饱和溶液。(6)仪器a的名称为
(7)写出甲装置中反应的离子方程式
(8)石灰乳的作用是
(9)反应过程中用冷水浴冷却的原因是
(三)合成

①将
 溶液,在冷水浴中分批加入(二)中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即
溶液,在冷水浴中分批加入(二)中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即 )。
)。②离心分离除去
 水解得到的
水解得到的 胶体,留上层清液(深紫红色)。
胶体,留上层清液(深紫红色)。③向②的上层清液中缓慢加入
 饱和溶液
饱和溶液 ,冰水浴保持
,冰水浴保持 ,过滤,得
,过滤,得 (相对分子质量为198)粗产品。
(相对分子质量为198)粗产品。④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品。
(10)用异丙醇洗涤的目的是
(四)
 产品纯度的测定
产品纯度的测定准确称取
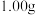 制得的晶体,配成
制得的晶体,配成 溶液,准确量取
溶液,准确量取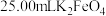 溶液放入锥形瓶,
溶液放入锥形瓶,①加入足量
 和
和 溶液,振荡,再加入稀硫酸酸化后得
溶液,振荡,再加入稀硫酸酸化后得 和
和 ,
,②滴入几滴二苯胺磺酸钠作指示剂,用
 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液
标准溶液 。
。(11)加入
 标准溶液后反应的离子方程式为
标准溶液后反应的离子方程式为(12)用根据以上数据,样品中
 的质量分数为
的质量分数为(13)若
 标准溶液部分变质,会使测定结果
标准溶液部分变质,会使测定结果
您最近一年使用:0次
名校
解题方法
3 . 钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。 是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备
是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备 (夹持装置略去)。
(夹持装置略去)。
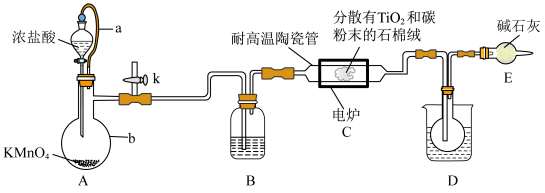
已知:HCl与 不发生反应;装置C中除生成
不发生反应;装置C中除生成 外,同时还生成一种有毒气态氧化物和少量副产物
外,同时还生成一种有毒气态氧化物和少量副产物 ,其它相关信息如表所示:
,其它相关信息如表所示:
请回答下列问题:
(1)装置A中导管a的作用为_______ ,装置B中所盛试剂为_______ 。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:_______ →_______ →b→_______ →_______ →_______ 。
(3)陶瓷管加热至900℃,管中主要发生的化学反应方程式为_______ 。
(4)欲分离D装置中收集的液态混合物,所采用的操作名称是_______ 。
(5)下列说法不正确的是_______ 。
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉线载体是为了增大气体与 、碳粉的接触面积,以加快反应速率
、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使 变质
变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(6) 可制备纳米
可制备纳米 :以
:以 为载体,用
为载体,用 和水蒸气反应生成
和水蒸气反应生成 ,再控制温度生成纳米
,再控制温度生成纳米 ,测定纳米
,测定纳米 组成,方法如下:
组成,方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到 ,再用足量铝将
,再用足量铝将 还原为
还原为 过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得待测液。
过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol/L的 标准溶液滴定,将
标准溶液滴定,将 氧化为
氧化为 ,三次滴定消耗标准溶液的平均值为24.00mL。
,三次滴定消耗标准溶液的平均值为24.00mL。
①滴定终点的判断方法是_______ 。
②通过分析、计算,该样品的组成为_______ 。
 是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备
是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备 (夹持装置略去)。
(夹持装置略去)。
已知:HCl与
 不发生反应;装置C中除生成
不发生反应;装置C中除生成 外,同时还生成一种有毒气态氧化物和少量副产物
外,同时还生成一种有毒气态氧化物和少量副产物 ,其它相关信息如表所示:
,其它相关信息如表所示:| 熔点/℃ | 沸点/℃ | 密度 | 水溶性 | |
 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置A中导管a的作用为
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:
(3)陶瓷管加热至900℃,管中主要发生的化学反应方程式为
(4)欲分离D装置中收集的液态混合物,所采用的操作名称是
(5)下列说法不正确的是
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉线载体是为了增大气体与
 、碳粉的接触面积,以加快反应速率
、碳粉的接触面积,以加快反应速率C.装置D中的烧杯中可加入冰水,便于收集到纯的液态

D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使
 变质
变质E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(6)
 可制备纳米
可制备纳米 :以
:以 为载体,用
为载体,用 和水蒸气反应生成
和水蒸气反应生成 ,再控制温度生成纳米
,再控制温度生成纳米 ,测定纳米
,测定纳米 组成,方法如下:
组成,方法如下:步骤一:取样品2.100g用稀硫酸充分溶解得到
 ,再用足量铝将
,再用足量铝将 还原为
还原为 过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得待测液。
过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得待测液。步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol/L的
 标准溶液滴定,将
标准溶液滴定,将 氧化为
氧化为 ,三次滴定消耗标准溶液的平均值为24.00mL。
,三次滴定消耗标准溶液的平均值为24.00mL。①滴定终点的判断方法是
②通过分析、计算,该样品的组成为
您最近一年使用:0次
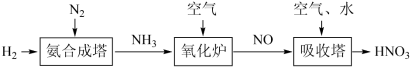
4 . I.空气中的氮氧化物主要来源:化石燃料燃烧、工业制硝酸尾气、汽车尾气。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:________ 。
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
II.铁器时代是人类发展史中一个极为重要的时代,铁及其化合物在人类的生产、生活中都起了巨大的作用。
(3)长期放置的FeSO4溶液易被氧化而变质,实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是_______ (用离子方程式表示)。
(4)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液 溶液I
溶液I  沉淀II
沉淀II  Fe2O3
Fe2O3
①H2O2溶液的作用是______ 。
②写出由“溶液I”到“沉淀II”反应的离子方程式:______ 。
③“操作III”的名称为_______ 。
(5)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g;将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g,按图示连接好装置进行实验。______ (填标号);重复上述操作步骤,直至装置A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量装置A f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=_____ (列出计算式即可)。
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成
 和
和 ,其离子方程式为
,其离子方程式为II.铁器时代是人类发展史中一个极为重要的时代,铁及其化合物在人类的生产、生活中都起了巨大的作用。
(3)长期放置的FeSO4溶液易被氧化而变质,实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是
(4)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液
 溶液I
溶液I  沉淀II
沉淀II  Fe2O3
Fe2O3①H2O2溶液的作用是
②写出由“溶液I”到“沉淀II”反应的离子方程式:
③“操作III”的名称为
(5)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g;将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g,按图示连接好装置进行实验。
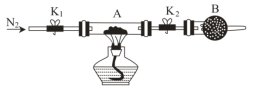
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量装置A f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=
您最近一年使用:0次
5 . 对于某些离子或物质成分的检验及推断正确的是
| A.用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,说明原溶液中有Na+,可能有K+ |
| B.加入碳酸钾溶液产生白色沉淀,再加盐酸白色沉淀消失,推断溶液中含有Ca2+ |
| C.将Na2O2样品中加入稀盐酸,有气体产生,可推断Na2O2已变质 |
D.加入盐酸后有气体逸出,此气体能使澄清石灰水变浑浊,可判定溶液中只含有CO |
您最近一年使用:0次
名校
6 . 硫元素广泛存在于自然界中,是动植物生长不可缺少的元素。
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 。
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为___________ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
II.小组同学利用图3装置测定空气中 的含量。
的含量。___________ ,该装置中发生反应的离子方程式为___________ 。
(5)若空气流速为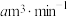 ,当观察到装置内
,当观察到装置内___________ 时,结束计时,测定耗时tmin,假定空气中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是___________  。
。
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
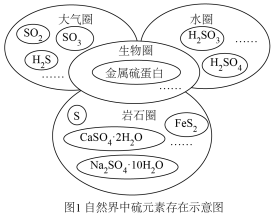
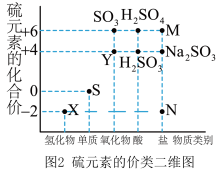
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是II.小组同学利用图3装置测定空气中
 的含量。
的含量。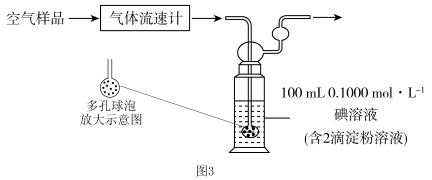
(5)若空气流速为
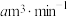 ,当观察到装置内
,当观察到装置内 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是 。
。
您最近一年使用:0次
解题方法
7 . 某小组设计制备补铁剂甘氨酸亚铁的实验步骤和装置图(夹持装置省略)如图:
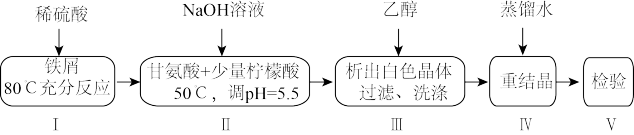
合成反应为:2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
有关物质性质如表所示:
回答下列问题:
(1)步骤I制备FeSO4,先打开K1、K2,关闭K3,充分反应后(仍有气泡),将B中溶液转移到D中的操作是______ 。
(2)步骤I、II中,为了防止Fe2+被氧化,采取的措施有______ 、______ (填2种)。
(3)步骤II,D中反应液pH过高或过低均会导致产率降低,原因是______ 。
(4)下列说法不正确 的是______ 。
(5)步骤V,检测产品中铁元素的含量,需要用到如图电子天平,以差量法 准确称量样品。操作的正确排序为:电子天平开机预热→A→B→______→______→______→______→F。______

A.调水平(使水平仪气泡归中)
B.利用标准码进行校准
C.往称量瓶中加入一定量样品,放回秤盘
D.将称量瓶置于秤盘中间,待示数不变时,按TAR键去皮
E.从称量瓶中倒出一定量样品,放回秤盘
F.关闭侧门,待示数不变时读数记录

合成反应为:2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
有关物质性质如表所示:
| 甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,微溶于乙醇 |
| 具有两性 | 酸性和还原性 | 常温不易,氧化变质 |

回答下列问题:
(1)步骤I制备FeSO4,先打开K1、K2,关闭K3,充分反应后(仍有气泡),将B中溶液转移到D中的操作是
(2)步骤I、II中,为了防止Fe2+被氧化,采取的措施有
(3)步骤II,D中反应液pH过高或过低均会导致产率降低,原因是
(4)下列说法
| A.步骤I、II使用滴液漏斗A或C滴入液体时,无需取下上口玻璃塞 |
| B.步骤III加入乙醇的作用是降低甘氨酸亚铁的溶解度,促使其结晶析出 |
| C.步骤III过滤后洗涤,往漏斗中加水浸没沉淀,小心搅拌以加快过滤 |
| D.步骤IV重结晶,将粗产品溶解于适量水中,蒸发浓缩至出现大量晶体,趁热过滤 |

A.调水平(使水平仪气泡归中)
B.利用标准码进行校准
C.往称量瓶中加入一定量样品,放回秤盘
D.将称量瓶置于秤盘中间,待示数不变时,按TAR键去皮
E.从称量瓶中倒出一定量样品,放回秤盘
F.关闭侧门,待示数不变时读数记录
您最近一年使用:0次
名校
解题方法
8 . 过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,加水将其溶解,加入___________ 溶液(填化学式),充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了mg样品,并设计用下图装置来测定过氧化钠的质量分数。
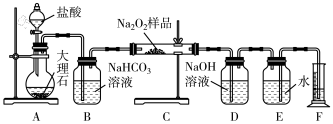
①装置中盛放盐酸的仪器的名称是___________ ,有同学提出该实验装置A、C装置之间没必要增加盛有饱和NaHCO3溶液的洗气瓶,该同学想法是否有道理?并说明理由:___________ 。
②将仪器连接好以后,必须进行的第一步操作是___________ 。
③写出装置C中发生的主要反应的化学方程式:___________ 。
④装置D的作用是___________ ;若无装置D,样品中Na2O2的质量分数___________ (填“偏高”“偏低”或“无影响”)。
⑤实验结束后,装置F中水的体积为VmL,已知氧气的密度为ρg·mL-1,样品中Na2O2质量分数为___________ (用含ρ、m、V的代数式表示)。
(3)压强不变时在一个密闭容器中放入足量过氧化钠固体,然后充入等分子数的CH4和O2,电火花引燃后充分反应,恢复至原温度,余下气体的分子数为原分子总数的___________ 。
(1)探究一包Na2O2样品是否已经变质:取少量样品,加水将其溶解,加入
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了mg样品,并设计用下图装置来测定过氧化钠的质量分数。

①装置中盛放盐酸的仪器的名称是
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生的主要反应的化学方程式:
④装置D的作用是
⑤实验结束后,装置F中水的体积为VmL,已知氧气的密度为ρg·mL-1,样品中Na2O2质量分数为
(3)压强不变时在一个密闭容器中放入足量过氧化钠固体,然后充入等分子数的CH4和O2,电火花引燃后充分反应,恢复至原温度,余下气体的分子数为原分子总数的
您最近一年使用:0次
2023-11-04更新
|
394次组卷
|
2卷引用:湖北省荆州市沙市中学2023-2024学年高一上学期11月期中考试化学试题
9 . 食品级焦亚硫酸钠 常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备
常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备 的过饱和溶液经结晶制得。回答下列问题:
的过饱和溶液经结晶制得。回答下列问题:
(1)实验室制备少量 的装置如图1所示:打开磁力搅拌器,将装有
的装置如图1所示:打开磁力搅拌器,将装有 过饱和溶液的锥形瓶置于40℃水浴中,通入
过饱和溶液的锥形瓶置于40℃水浴中,通入 ,当
,当 数字采集器测得溶液的
数字采集器测得溶液的 为
为___________ 时,停止反应,装置甲中生成 的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是
的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是___________ 。 转化成
转化成 的化学方程式为
的化学方程式为___________ 。
(2)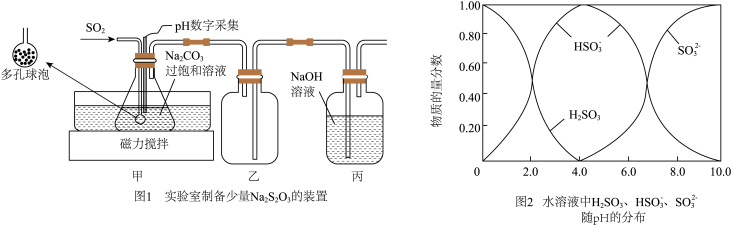
通 气体的导管末端是带许多小孔的玻璃球泡,其主要作用是
气体的导管末端是带许多小孔的玻璃球泡,其主要作用是___________ 。
(3)析出固体的反应液经减压蒸发、冷却结晶、减压抽滤、洗涤、25℃~30℃干燥,可进一步获得 固体。其中减压蒸发是为了
固体。其中减压蒸发是为了___________ 。
(4)长期放置的 晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是
晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是___________ 。(已知: 溶于水即生成
溶于水即生成 )
)
(5)某机构通过下述方法检测变质样品中抗氧化剂 残留的含量,步骤如下:
残留的含量,步骤如下:
步骤一:取配制后的样品溶液 于锥形瓶中(假设其他杂质不反应)。
于锥形瓶中(假设其他杂质不反应)。
步骤二:用 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液 。
。
滴定反应的离子方程式为___________ ,该样品中 的残留量为
的残留量为___________  。
。
 常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备
常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备 的过饱和溶液经结晶制得。回答下列问题:
的过饱和溶液经结晶制得。回答下列问题:(1)实验室制备少量
 的装置如图1所示:打开磁力搅拌器,将装有
的装置如图1所示:打开磁力搅拌器,将装有 过饱和溶液的锥形瓶置于40℃水浴中,通入
过饱和溶液的锥形瓶置于40℃水浴中,通入 ,当
,当 数字采集器测得溶液的
数字采集器测得溶液的 为
为 的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是
的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是 转化成
转化成 的化学方程式为
的化学方程式为(2)

通
 气体的导管末端是带许多小孔的玻璃球泡,其主要作用是
气体的导管末端是带许多小孔的玻璃球泡,其主要作用是(3)析出固体的反应液经减压蒸发、冷却结晶、减压抽滤、洗涤、25℃~30℃干燥,可进一步获得
 固体。其中减压蒸发是为了
固体。其中减压蒸发是为了(4)长期放置的
 晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是
晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是 溶于水即生成
溶于水即生成 )
)(5)某机构通过下述方法检测变质样品中抗氧化剂
 残留的含量,步骤如下:
残留的含量,步骤如下:步骤一:取配制后的样品溶液
 于锥形瓶中(假设其他杂质不反应)。
于锥形瓶中(假设其他杂质不反应)。步骤二:用
 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液 。
。滴定反应的离子方程式为
 的残留量为
的残留量为 。
。
您最近一年使用:0次
解题方法
10 . 下列实验操作、现象及结论都正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将一小块金属钠投入 溶液,钠会浮在溶液上四处游动,同时会有紫红色固体析出 溶液,钠会浮在溶液上四处游动,同时会有紫红色固体析出 | 钠可以置换出铜 |
| B | 向某溶液中加入稀盐酸产生无色无味气体,将该气体通入澄清石灰水,变浑浊 | 溶液一定含有 |
| C | 室温下,向等浓度、等体积的 和 和 溶液中,分别滴加几滴酚酞, 溶液中,分别滴加几滴酚酞, 溶液红色更深 溶液红色更深 | 说明 溶液碱性比 溶液碱性比 强 强 |
| D | 探究脱氧剂中还原铁粉是否变质,可取少量样品溶于盐酸,再滴加KSCN溶液,溶液未变红 | 说明脱氧剂未变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



