1 . 下表是元素周期表的一部分,a~k分别代表10种元素,请按照要求回答:
(1)元素a~k中,其简单氢化物最稳定的是_______ (填元素名称)。
(2)b的简单氢化物的电子式_______ 。
(3)元素h、i的最高价氧化物对应水化物中酸性较强的是_______ (填化学式)。
(4)g的单质与e的最高价氧化物对应的水化物反应的化学方程式是_______ 。
(5)下列说法能证明金属性k强于f的是_______ (填序号)。
A.k的简单阳离子的氧化性更弱
B.k的氢氧化物水溶液的导电性更强
C.k的单质与水反应更剧烈
| a | ||||||||
| b | c | d | ||||||
| e | f | g | h | i | ||||
| k | …… | |||||||
(2)b的简单氢化物的电子式
(3)元素h、i的最高价氧化物对应水化物中酸性较强的是
(4)g的单质与e的最高价氧化物对应的水化物反应的化学方程式是
(5)下列说法能证明金属性k强于f的是
A.k的简单阳离子的氧化性更弱
B.k的氢氧化物水溶液的导电性更强
C.k的单质与水反应更剧烈
您最近一年使用:0次
2 . 现有A、B、X、Y、Z五种短周期主族元素,原子序数逐渐增大。它们的性质或原子结构如下表:
请回答:
(1)写出X在元素周期表中的位置_______ 。
(2)比较X、Y的离子半径:X的离子半径_______ Y的离子半径(填“>”“<”“=”)。
(3)检验BA3的方法和现象_______ 。
(4)用电子式表示化合物YZ的形成过程_______ 。
(5)W元素的核电荷数是B、X的核电荷数的和,则W与B的气态氢化物稳定性为_______ (填化学式)。
| 元素 | 性质或原子结构 |
| A | 原子核内只有一个质子 |
| B | 单质是空气中含量最多的气体 |
| X | 原子的最外层电子数是次外层电子数的3倍 |
| Y | 短周期元素中原子半径最大的元素 |
| Z | 最高正化合价与最低负化合价的代数和为6 |
(1)写出X在元素周期表中的位置
(2)比较X、Y的离子半径:X的离子半径
(3)检验BA3的方法和现象
(4)用电子式表示化合物YZ的形成过程
(5)W元素的核电荷数是B、X的核电荷数的和,则W与B的气态氢化物稳定性为
您最近一年使用:0次
解题方法
3 . A、B、C、D、E、F为短周期元素, 原子序数依次增大。非金属元素A 最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。E+与D2-具有相同的电子层结构。A单质在F单质中燃烧,产物溶于水得到一种强酸M。回答下列问题:
(1)画出E的离子结构示意图___________ 。
(2)F在周期表中的位置是___________ 。
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为___________ 。
(4)由这些元素组成的物质,相关信息如下:
①a的电子式为___________ 。 写出其与水反应的化学方程式:___________ 。
②b的一种常见用途为___________ 。
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为___________ 。
(1)画出E的离子结构示意图
(2)F在周期表中的位置是
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为
(4)由这些元素组成的物质,相关信息如下:
| 物质 | 组成和结构信息 |
| a | 由 A、E组成的离子化合物 |
| b | 由D、E组成的含非极性键的离子化合物,阴阳离子数之比为1:2 |
| c | 化学式为BDF2的共价化合物 |
②b的一种常见用途为
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为
您最近一年使用:0次
名校
4 . X、Y、Z、M四种短周期元素,原子半径M>Z>X>Y,其中X、Y处在同一周期,X、Z处在同一主族。Z原子核内质子数等于X、Y原子核内质子数之和,原子核外最外层上的电子数是M原子核外最外层电子数的4倍。请回答:
(1)这两种元素名称分别是X_______ ,M_______ 。
(2)Y的简单离子结构示意图是_______ ;Z在周期表中的位置是_______ 。
(3)X、Y、Z这三种元素的气态氢化物的稳定性由大而小的顺序是_______ 。
(4)X与Y形成的三原子分子甲的结构式是_______ ,Y与M形成的原子个数比为1∶1的化合物乙的电子式是_______ ,甲与乙反应的化学方程式是_______ 。
(1)这两种元素名称分别是X
(2)Y的简单离子结构示意图是
(3)X、Y、Z这三种元素的气态氢化物的稳定性由大而小的顺序是
(4)X与Y形成的三原子分子甲的结构式是
您最近一年使用:0次
名校
解题方法
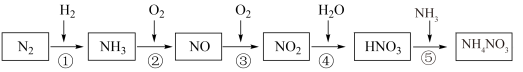
5 . 氮元素及其化合物的转化关系如图所示:___________ ,写出 的电子式
的电子式___________ 。
(2)浓、稀 的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:
的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:___________ 。
(3)氮氧化物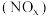 是大气污染物之一,处理
是大气污染物之一,处理 对于环境保护具有重要的意义。在一定条件下
对于环境保护具有重要的意义。在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。 ,反应的化学方程式为
,反应的化学方程式为___________ ;装置B内的试剂是___________ 。
②在装置 中
中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中  和
和 的物质的量之比为
的物质的量之比为___________ 。
③工厂里常采用 溶液吸收
溶液吸收 的混合气体,使其转化为化工产品
的混合气体,使其转化为化工产品 ,试写出其化学方程式:
,试写出其化学方程式:___________ 。
④用不同浓度的 溶液吸收
溶液吸收 含量不同的尾气,关系如图:(
含量不同的尾气,关系如图:( 表示尾气里
表示尾气里 中
中 的含量)
的含量) 含量越大,氮氧化物的吸收率越大,当
含量越大,氮氧化物的吸收率越大,当 小于
小于 时,加入
时,加入  能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是___________ 。
(4) 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:___________ (写出操作步骤、现象和结论)。
 的电子式
的电子式(2)浓、稀
 的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:
的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:(3)氮氧化物
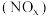 是大气污染物之一,处理
是大气污染物之一,处理 对于环境保护具有重要的意义。在一定条件下
对于环境保护具有重要的意义。在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。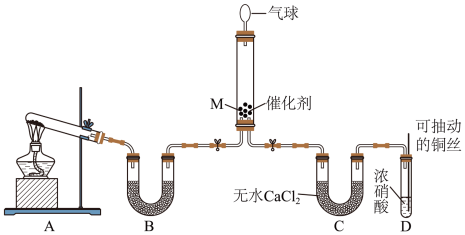
 ,反应的化学方程式为
,反应的化学方程式为②在装置
 中
中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中  和
和 的物质的量之比为
的物质的量之比为③工厂里常采用
 溶液吸收
溶液吸收 的混合气体,使其转化为化工产品
的混合气体,使其转化为化工产品 ,试写出其化学方程式:
,试写出其化学方程式:④用不同浓度的
 溶液吸收
溶液吸收 含量不同的尾气,关系如图:(
含量不同的尾气,关系如图:( 表示尾气里
表示尾气里 中
中 的含量)
的含量)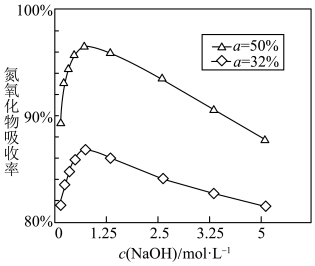
 含量越大,氮氧化物的吸收率越大,当
含量越大,氮氧化物的吸收率越大,当 小于
小于 时,加入
时,加入  能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是(4)
 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
您最近一年使用:0次
名校
解题方法
6 . 元素周期表在学习、研究和生产实践中有很重要的作用。下表显示了元素周期表中的短周期,①~⑤代表5种元素。
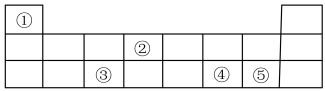
(1)②在元素周期表中的位置是______ 。
(2)⑤的最高价氧化物对应的水化物的化学式是______ 。
(3)①和⑤可形成共价化合物,用电子式表示其形成过程______ 。
(4)①分别与④、⑤形成的化合物中,稳定性强的是______ (用化学式表示)。
(5)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是______ 。
(6)元素 的原子结构示意图为
的原子结构示意图为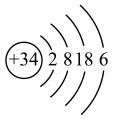 。下列推断错误的是______(填序号)。
。下列推断错误的是______(填序号)。
(7) 在一定条件下可与
在一定条件下可与 溶液反应,生成一种正盐和水,该正盐化学式为
溶液反应,生成一种正盐和水,该正盐化学式为______ 。

(1)②在元素周期表中的位置是
(2)⑤的最高价氧化物对应的水化物的化学式是
(3)①和⑤可形成共价化合物,用电子式表示其形成过程
(4)①分别与④、⑤形成的化合物中,稳定性强的是
(5)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是
(6)元素
 的原子结构示意图为
的原子结构示意图为 。下列推断错误的是______(填序号)。
。下列推断错误的是______(填序号)。A. 位于第四周期、与④同主族 位于第四周期、与④同主族 | B. 的最低负化合价为-2价 的最低负化合价为-2价 |
C. 具有还原性 具有还原性 | D.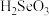 的酸性强于 的酸性强于 |
(7)
 在一定条件下可与
在一定条件下可与 溶液反应,生成一种正盐和水,该正盐化学式为
溶液反应,生成一种正盐和水,该正盐化学式为
您最近一年使用:0次
名校
解题方法
7 . 下表为元素周期表的一部分,参照元素①~⑪在表中的位置,回答下列问题:

(1)已知元素⑪的一种核素,其中子数为45,用原子符号表示该核素为_______ (用 的形式表示)。
的形式表示)。
(2)②、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为_______ (用化学式表示)。
(3)写出③和⑤两元素形成的具有较强氧化性的化合物的电子式_______ ,该物质中含有的化学键类型为_______ 。用电子式表示⑥和⑩两元素组成的化合物的形成过程_______ 。
(4)下列事实中能说明非金属性⑩>⑨的是_______ (填标号)。
a.⑨和⑩两元素的简单氢化物受热分解,后者的分解温度高
b.元素⑩的单质能将 氧化成三价铁,而元素⑨的单质只能将铁氧化成二价铁
氧化成三价铁,而元素⑨的单质只能将铁氧化成二价铁
c.元素⑩的单质与⑨的氢化物的水溶液反应,产生元素⑨的单质
d.元素⑩的氢化物的水溶液的酸性比元素⑨的氢化物的水溶液的酸性强
(5)写出⑦的单质与⑤的最高价氧化物的水化物反应的离子方程式_______ 。

(1)已知元素⑪的一种核素,其中子数为45,用原子符号表示该核素为
 的形式表示)。
的形式表示)。(2)②、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为
(3)写出③和⑤两元素形成的具有较强氧化性的化合物的电子式
(4)下列事实中能说明非金属性⑩>⑨的是
a.⑨和⑩两元素的简单氢化物受热分解,后者的分解温度高
b.元素⑩的单质能将
 氧化成三价铁,而元素⑨的单质只能将铁氧化成二价铁
氧化成三价铁,而元素⑨的单质只能将铁氧化成二价铁c.元素⑩的单质与⑨的氢化物的水溶液反应,产生元素⑨的单质
d.元素⑩的氢化物的水溶液的酸性比元素⑨的氢化物的水溶液的酸性强
(5)写出⑦的单质与⑤的最高价氧化物的水化物反应的离子方程式
您最近一年使用:0次
名校
解题方法
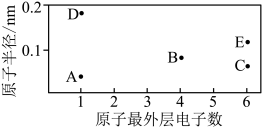
8 . 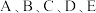 为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
请回答下列问题:
(1) 元素的某种原子的中子数比质子数多1,则该原子符号为
元素的某种原子的中子数比质子数多1,则该原子符号为_____________ ; 元素的最简单氢化物的结构式为
元素的最简单氢化物的结构式为_____________________ 。
(2)化合物 仅含有
仅含有 两种元素且
两种元素且 的原子个数比为
的原子个数比为 ,则
,则 的电子式为
的电子式为_________________________ 。 与水反应的离子方程式为
与水反应的离子方程式为_________________________ ,每消耗 ,转移
,转移_____________  电子。
电子。
(3)化合物 仅含有
仅含有 两种元素,
两种元素, 与水反应的化学方程式为
与水反应的化学方程式为_____________________ 。
(4)用电子式表示化合物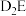 的形成过程:
的形成过程:_________________________________________ 。
(5)非金属性:
_____________ C(填“ ”或“
”或“ ”),从原子结构角度简述其原因:
”),从原子结构角度简述其原因:_________ 。
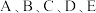 为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
请回答下列问题:
(1)
 元素的某种原子的中子数比质子数多1,则该原子符号为
元素的某种原子的中子数比质子数多1,则该原子符号为 元素的最简单氢化物的结构式为
元素的最简单氢化物的结构式为(2)化合物
 仅含有
仅含有 两种元素且
两种元素且 的原子个数比为
的原子个数比为 ,则
,则 的电子式为
的电子式为 与水反应的离子方程式为
与水反应的离子方程式为 ,转移
,转移 电子。
电子。(3)化合物
 仅含有
仅含有 两种元素,
两种元素, 与水反应的化学方程式为
与水反应的化学方程式为(4)用电子式表示化合物
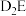 的形成过程:
的形成过程:(5)非金属性:

 ”或“
”或“ ”),从原子结构角度简述其原因:
”),从原子结构角度简述其原因:
您最近一年使用:0次
名校
9 . 下列是从上到下原子序数依次增大的六种短周期主族元素,其元素性质或原子结构如下表所示:
回答下列问题:
(1)元素F在元素周期表中的位置是_________ 。
(2)元素A的一种核素可测定文物年代,这种核素是___________ (填核素符号)。B、C、D、E四种元素的离子半径由大到小的顺序为_________ (填离子符号)。
(3)火箭发动机曾经利用B2H4作燃料、H2C2作助燃剂,产物无污染,二者反应的化学方程式为__________ ,氧化产物与还原产物物质的量之比为__________ 。
(4)元素C的单质与钠在常温下生成物质X。用电子式表示物质X的形成过程:__________ 。
(5)A、B、E、F四种元素的最高价氧化物对应的水化物中,酸性最强的是__________ (填化学式)。E的最高价氧化物对应的水化物溶液与D的最高价氧化物反应的离子方程式为___________ 。
| 元素编号 | 元素性质或原子结构 |
| A | A的一种同素异形体可用作润滑剂 |
| B | 单质是空气中含量最高的气体 |
| C | 最外层电子数是最内层电子数的3倍 |
| D | 简单阳离子半径是同周期阳离子半径最小的 |
| E | M层电子数是电子层数的2倍 |
| F | 元素最高正价是+7,最低价是-1 |
(1)元素F在元素周期表中的位置是
(2)元素A的一种核素可测定文物年代,这种核素是
(3)火箭发动机曾经利用B2H4作燃料、H2C2作助燃剂,产物无污染,二者反应的化学方程式为
(4)元素C的单质与钠在常温下生成物质X。用电子式表示物质X的形成过程:
(5)A、B、E、F四种元素的最高价氧化物对应的水化物中,酸性最强的是
您最近一年使用:0次
名校
解题方法
10 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经一百多年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
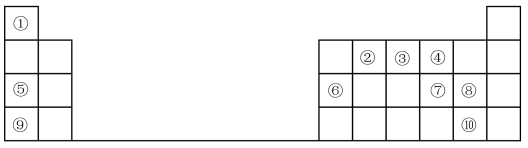
(1)元素②在周期表中的位置___________
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是___________ (填化学式)。
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:___________ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是___________ (用离子符号表示),
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:___________ 。
(6)元素的非金属性⑩___________ ⑧(填“>”或“<”);下列事实不能 证明上述结论的是___________ 。
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱

(1)元素②在周期表中的位置
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:
(6)元素的非金属性⑩
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱
您最近一年使用:0次
2024-02-13更新
|
146次组卷
|
2卷引用:安徽省淮北市第一中学2023-2024学年高一下学期开学考试 化学试卷



