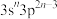1 . 化学在生产生活中无处不在。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)汽车受到猛烈碰撞时,点火器点火引发 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是___________ (填字母),生成氮气的电子式为___________ 。 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。
(2)将2.0 mol 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ 。
(3)一定条件下,将1.0 mol 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应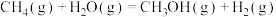 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是___________ (填字母)。
a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的 e.加入合适的催化剂
e.加入合适的催化剂
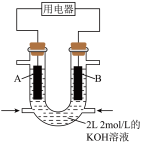
(4)用 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为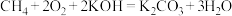 。
。 向B电极定向移动,则
向B电极定向移动,则___________ (填“A”或“B”)电极入口通甲烷,该电极反应的离子方程式为___________ 。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___________ 。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。(1)汽车受到猛烈碰撞时,点火器点火引发
 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是A.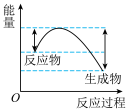 B.
B.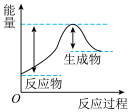 C.
C.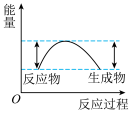
 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。(2)将2.0 mol
 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为(3)一定条件下,将1.0 mol
 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应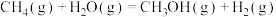 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的
 e.加入合适的催化剂
e.加入合适的催化剂(4)用
 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为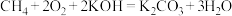 。
。
 向B电极定向移动,则
向B电极定向移动,则②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
您最近一年使用:0次
解题方法
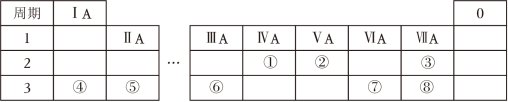
2 . 元素周期表反映了元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分。回答下列问题:___________ (填元素符号)。
(2)若元素④与⑧形成的化合物为X,用电子式表示X的形成过程:___________ ;画出X中阴离子的离子结构示意图:___________ 。
(3)⑦⑧两种元素的最高价氧化物对应的水化物酸性强弱为___________ (用化学式表示)。
(4)⑥的单质与强碱反应的离子方程式为___________ 。
(5)已知铷(Rb)是37号元素,与④同主族。下列说法正确的是 ___________(填字母)。
(2)若元素④与⑧形成的化合物为X,用电子式表示X的形成过程:
(3)⑦⑧两种元素的最高价氧化物对应的水化物酸性强弱为
(4)⑥的单质与强碱反应的离子方程式为
(5)已知铷(Rb)是37号元素,与④同主族。下列说法正确的是 ___________(填字母)。
| A.铷在周期表中的位置为第四周期第ⅠA族 |
| B.铷的熔点比④对应单质的熔点低 |
| C.⑥的简单离子与过量的RbOH反应最终会产生白色沉淀 |
| D.RbOH的碱性比④的最高价氧化物对应的水化物强 |
您最近一年使用:0次
名校
3 . 下图是元素周期表的一部分,针对表中①~⑦元素,填写下列空白:
(1)对⑧⑨元素说法正确的是 。
(2)下列说法正确的是 。
(3)下列比较正确的是 。
(4)下列说法正确的是 。
(5)对各种元素的实验室制法或工业制法错误的是 。
| 族 周期 | IA | 0 | ||||||
| 1 | ⑧ | IIA | IIIA | IVA | VA | VIA | VIIA | ⑨ |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
| A.⑧单质通常是双原子分子,⑨单质是单原子分子 |
| B.3H质量数是3,中子数是1 |
| C.⑧属于IA主族元素,是碱金属 |
| D.⑧单质是最轻的气体,有三种同位素 |
| A.②元素的最低价氢化物的化学式为NH3 | B.⑦的氢化物属于共价化合物 |
C.②元素的原子结构示意图为 | D.F的最高价为+7价 |
| A.②和⑥两种元素的原子半径大小为:②<⑥ |
| B.④和⑤两种元素的金属性强弱顺序为:④>⑤ |
| C.②③⑦的氢化物稳定性比较:②<③ ③>⑦ |
| D.最高价氧化物的水化物碱性比较:④>⑤ |
| A.元素④与⑦形成的化合物只含离子键,属于离子化合物。 |
| B.⑤的单质,最高价氧化物,最高价氧化物的水化物都能和盐酸反应,也能和NaOH溶液反应 |
| C.③的氢化物水溶液是弱酸,不能刻蚀玻璃 |
| D.②的氢化物不能制取化肥,但可以做制冷剂 |
| A.④单质的制法是电解熔融的氯化物 | B.⑤单质的制法是电解熔融的氧化物 |
| C.⑧单质的制法:可用Zn与盐酸反应 | D.⑦单质可用MnO2与稀盐酸加热制取 |
您最近一年使用:0次
名校
解题方法
4 . 某学习小组按如下实验流程进行碘的制取,甲、乙两种实验方案如下:
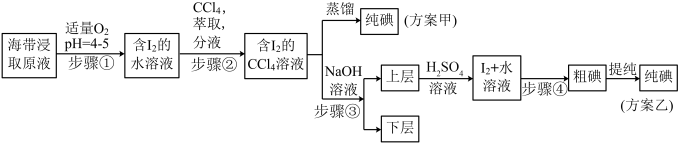
已知: ;酸性条件下,
;酸性条件下, 在水中的溶解度很小。
在水中的溶解度很小。
(1)步骤①中能代替 的最佳物质的电子式为
的最佳物质的电子式为________ 。
(2)步骤②中,萃取后分液漏斗内观察到的现象是________ 。
(3)下列有关步骤③的说法正确的是________(填序号)。
(4)方案乙中,上层液体中加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为________ ,其中步骤④操作的名称是________ ;方案甲中采用蒸馏效果不佳,理由是________ 。

已知:
 ;酸性条件下,
;酸性条件下, 在水中的溶解度很小。
在水中的溶解度很小。(1)步骤①中能代替
 的最佳物质的电子式为
的最佳物质的电子式为(2)步骤②中,萃取后分液漏斗内观察到的现象是
(3)下列有关步骤③的说法正确的是________(填序号)。
| A.应控制NaOH溶液的浓度和体积 | B.将碘转化成离子进入水层 |
| C.主要目的是除去浸取原液中的有机杂质 | D.NaOH溶液可由乙醇代替 |
(4)方案乙中,上层液体中加入
 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近一年使用:0次
5 . 利用下图,可以从不同角度研究含硫物质的性质及其转化关系,图中物质甲~己中均含有硫元素.回答下列问题:
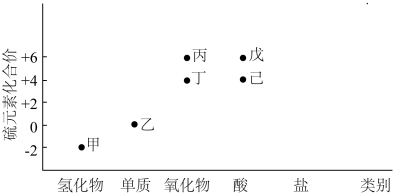
(1)写出甲的电子式:_______ ,该物质中的硫元素可表现出___________ (填“氧化性”或“还原性”);利用高温热分解甲可以获得乙,该方法的优点是______________ ,缺点是_____________ .
(2)黄铁矿(主要成分为 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是__________ (填“丙”或“丁”),该物质与水化合生成___________ (填化学名称).
(3)① 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为_______________________________ .
②同位素示踪实验可证实 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为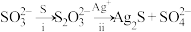 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为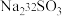 和
和 ,过程ii含硫产物是
,过程ii含硫产物是_____________ (标记出同位素原子).

(1)写出甲的电子式:
(2)黄铁矿(主要成分为
 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是(3)①
 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为②同位素示踪实验可证实
 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为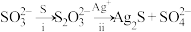 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为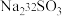 和
和 ,过程ii含硫产物是
,过程ii含硫产物是
您最近一年使用:0次
解题方法
6 . 有A、B、C、D、E、F六种物质,它们之间的反应关系如下所示:
① ②
②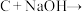 蓝色沉淀
蓝色沉淀
③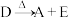 ④
④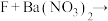 白色沉淀
白色沉淀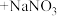 。
。
请回答下列问题。
(1)写出化学式:B_______ 、F_______ ;用电子式表示E的形成过程_______ 。
(2)写出①④反应的离子方程式:①_______ ;④_______ 。
(3)根据西汉《淮南万毕术》记载,C溶液与Fe的反应是现代湿法冶金的基础,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目,化学方程式:_______ 。
①
 ②
②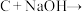 蓝色沉淀
蓝色沉淀
③
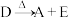 ④
④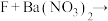 白色沉淀
白色沉淀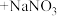 。
。请回答下列问题。
(1)写出化学式:B
(2)写出①④反应的离子方程式:①
(3)根据西汉《淮南万毕术》记载,C溶液与Fe的反应是现代湿法冶金的基础,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目,化学方程式:
您最近一年使用:0次
7 . X、Y、Z、Q、T代表五种元素,相关信息如表所示:
请回答下列问题:
(1)X的元素符号为______ ,其基态原子的电子排布式为______ 。
(2)Y的元素名称为______ ,其基态原子的轨道表示式为______ 。
(3)Z的基态原子的价层电子的轨道表示式为______ ;
(4)Q其简单离子的结构示意图为______ 。
(5)T的基态原子的价层电子排布式为______ ;其单质在X的常见单质中燃烧的化学方程式为______ 。
元素 | 信息 |
X | 基态原子最外层电子数是其电子层数的3倍 |
Y | 基态原子的L层上有2个空轨道 |
Z | 基态原子的M层的p能级上有3个未成对电子 |
Q | 基态原子的价层电子排布式为 |
T | 正三价离子的3d能级为半充满状态 |
(1)X的元素符号为
(2)Y的元素名称为
(3)Z的基态原子的价层电子的轨道表示式为
(4)Q其简单离子的结构示意图为
(5)T的基态原子的价层电子排布式为
您最近一年使用:0次
名校
8 . 下表是元素周期表的一部分,表中的每个编号代表一种元素。
请根据要求答题:
(1)元素④在周期表中的位置是_______ ,元素①③④组成的化合物属于_______ (填“离子化合物”或“共价化合物”)。
(2)元素⑤的离子结构示意图是_______ 。
(3)元素⑥、⑦的氢化物稳定性比较:_______ (填化学式);元素②、③、④的原子半径比较:_______ (填元素符号)。
(4)元素①、③按照原子个数比2:1组成的化合物的电子式为_______ 。
(5)元素④的最高价氧化物对应水化物与元素⑤的最高价氧化物对应水化物会反应,请写出反应的化学方程式_______ 。
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)元素④在周期表中的位置是
(2)元素⑤的离子结构示意图是
(3)元素⑥、⑦的氢化物稳定性比较:
(4)元素①、③按照原子个数比2:1组成的化合物的电子式为
(5)元素④的最高价氧化物对应水化物与元素⑤的最高价氧化物对应水化物会反应,请写出反应的化学方程式
您最近一年使用:0次
9 . 国家卫生健康委员会发布公告称,富硒酵母、二氧化硅、硫黄等6种食品添加剂新品种安全性已通过审查。氧、硫、硒为同一主族元素,请回答下列问题:
(1)硒 是一种生命元素,有抗癌、抗衰老等重要功能。硒元素在周期表中的位置为
是一种生命元素,有抗癌、抗衰老等重要功能。硒元素在周期表中的位置为___________ 。工业上用浓 焙烧
焙烧 的方法提取硒元素,其中
的方法提取硒元素,其中 元素转化为
元素转化为 ,且有
,且有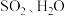 和
和 (固体)生成,该反应的化学方程式为
(固体)生成,该反应的化学方程式为___________ 。
(2)下列说法正确的是___________。
(3)短周期元素d、、f、g、h、x都可能存在于某些食品添加剂中,下表列出了该六种元素在周期表中的位置。请回答下列问题。
①由x、h、d三种元素组成原子数为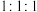 的化合物的电子式为
的化合物的电子式为___________ 。
②g的原子结构示意图为___________ 。
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为___________ 。
(1)硒
 是一种生命元素,有抗癌、抗衰老等重要功能。硒元素在周期表中的位置为
是一种生命元素,有抗癌、抗衰老等重要功能。硒元素在周期表中的位置为 焙烧
焙烧 的方法提取硒元素,其中
的方法提取硒元素,其中 元素转化为
元素转化为 ,且有
,且有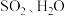 和
和 (固体)生成,该反应的化学方程式为
(固体)生成,该反应的化学方程式为(2)下列说法正确的是___________。
A.热稳定性: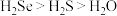 | B.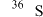 与 与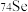 的中子数之和为60 的中子数之和为60 |
C.酸性: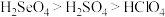 | D.还原性: |
| 周期 | 族 | |||||||
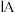 | 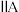 | 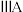 | 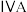 | 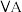 | 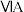 | 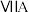 | 0 | |
| 1 | x | |||||||
| 2 | d | |||||||
| 3 | e | f | g | h | ||||
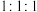 的化合物的电子式为
的化合物的电子式为②g的原子结构示意图为
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的
 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料生产制备铵铁蓝Fe(NH4)[Fe(CN)6]颜料的工艺流程如图:_______ (填化学式),滤渣①的主要成分是_______ (填化学式)。
(2)黄铁矿研细的目的是_______ 。
(3)工序①经过_______ 、过滤、洗涤得到一种含7个结晶水的晶体,该晶体为_______ (填化学式)。
(4)沉铁工序中生成一种白色沉淀为Fe(NH4)2[Fe(CN)6]。
①该物质的阴离子是由Fe2+和CN-结合形成的,CN-的电子式与氮气的电子式相似,请写出CN-的电子式:_______ 。
②该物质在酸性条件下加入NaClO3溶液,充分反应得到铵铁蓝,试补全下列离子方程式:_______ 。6Fe(NH4)2[Fe(CN)6]+ClO +_______=6FeNH4[Fe(CN)6]+ _______+_______NH
+_______=6FeNH4[Fe(CN)6]+ _______+_______NH +3H2O。
+3H2O。
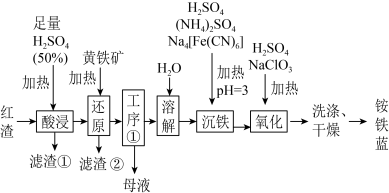
(2)黄铁矿研细的目的是
(3)工序①经过
(4)沉铁工序中生成一种白色沉淀为Fe(NH4)2[Fe(CN)6]。
①该物质的阴离子是由Fe2+和CN-结合形成的,CN-的电子式与氮气的电子式相似,请写出CN-的电子式:
②该物质在酸性条件下加入NaClO3溶液,充分反应得到铵铁蓝,试补全下列离子方程式:
 +_______=6FeNH4[Fe(CN)6]+ _______+_______NH
+_______=6FeNH4[Fe(CN)6]+ _______+_______NH +3H2O。
+3H2O。
您最近一年使用:0次
2024-03-01更新
|
86次组卷
|
2卷引用:广东省两阳中学2023-2024学年高一下学期第一次月考化学试题