名校
解题方法
1 . 回答下列问题
(1)工业以煤为燃料时,会产生大量的羰基硫 ,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
i氢解反应:
ii水解反应: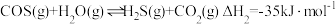
请回答下列问题:
① 的电子式为
的电子式为_________ ,分子中碳元素的化合价为_________ 。
②已知: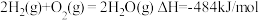
写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:___________________________ 。
(2)①常温下,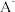 水解常数
水解常数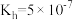 ,若
,若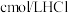 与
与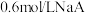 溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
_________ 。
②已知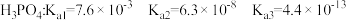 ,小王网购了一盆杜鹃花,客服告诉小王要定期施用
,小王网购了一盆杜鹃花,客服告诉小王要定期施用 肥料。由此可知,杜鹃花适宜种植在
肥料。由此可知,杜鹃花适宜种植在_________ 土壤中(填“酸性”、“中性”或“碱性”)。通过计算说明判断的依据是__________________ 。
(3)用间接电解法对 进行无害化处理,其原理如图所示。
进行无害化处理,其原理如图所示。

①电极I的电极反应式为__________________ 。
②每处理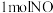 ,电解池中产生的氧气的质量为
,电解池中产生的氧气的质量为_________ g。
(1)工业以煤为燃料时,会产生大量的羰基硫
 ,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:i氢解反应:

ii水解反应:
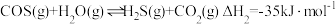
请回答下列问题:
①
 的电子式为
的电子式为②已知:
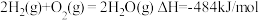
写出表示
 燃烧热的热化学方程式:
燃烧热的热化学方程式:(2)①常温下,
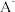 水解常数
水解常数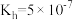 ,若
,若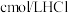 与
与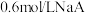 溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
②已知
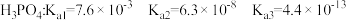 ,小王网购了一盆杜鹃花,客服告诉小王要定期施用
,小王网购了一盆杜鹃花,客服告诉小王要定期施用 肥料。由此可知,杜鹃花适宜种植在
肥料。由此可知,杜鹃花适宜种植在(3)用间接电解法对
 进行无害化处理,其原理如图所示。
进行无害化处理,其原理如图所示。
①电极I的电极反应式为
②每处理
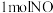 ,电解池中产生的氧气的质量为
,电解池中产生的氧气的质量为
您最近一年使用:0次
名校
2 . 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是_________ 。
(2)X与W组成的化合物电子式为________ 。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为_________ 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式:_________ 。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:_________ 。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶H2O。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①B的化学式为:________ 。
②已知1mol/L 100mL B的溶液能与1mol/L 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式:___________ 。
(1)X元素是
(2)X与W组成的化合物电子式为
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式:
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶H2O。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①B的化学式为:
②已知1mol/L 100mL B的溶液能与1mol/L 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式:
您最近一年使用:0次
名校
解题方法
3 . 下表为元素周期表的一部分,回答有关问题:
(1)请写出硅元素在周期表中的位置___________ 。
(2)元素③的原子结构示意图为___________ 。
(3)元素①、④形成的四原子分子的电子式为___________ 。
(4)元素⑨的一种核素,其中子数为20,该核素符号为___________ 。
(5)元素④、⑤、⑥、⑧的离子半径由大到小的顺序是___________ 。(填离子符号)
(6)能比较元素⑦和⑧非金属性强弱的实验事实是___________ (填字母序号)。
A.最简单气态氢化物的酸性⑧强于⑦
B.⑦的最简单气态氢化物沸点为-60℃高于⑧的最简单气态氢化物沸点-85℃
C.在⑦的氢化物 的水溶液中通少量⑧的单质
的水溶液中通少量⑧的单质 气体可置换出单质Q
气体可置换出单质Q
(7)①将 含
含 、
、 、
、 的混合气体通过足量由④和⑤构成的淡黄色固体化合物,充分反应后气体体积变为
的混合气体通过足量由④和⑤构成的淡黄色固体化合物,充分反应后气体体积变为 ,则原气体中,
,则原气体中, 的体积为
的体积为___________ 。
②若将该淡黄色固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子含量几乎不变的有
,反应完毕后,溶液中上述离子含量几乎不变的有___________ 。(填离子符号)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
(2)元素③的原子结构示意图为
(3)元素①、④形成的四原子分子的电子式为
(4)元素⑨的一种核素,其中子数为20,该核素符号为
(5)元素④、⑤、⑥、⑧的离子半径由大到小的顺序是
(6)能比较元素⑦和⑧非金属性强弱的实验事实是
A.最简单气态氢化物的酸性⑧强于⑦
B.⑦的最简单气态氢化物沸点为-60℃高于⑧的最简单气态氢化物沸点-85℃
C.在⑦的氢化物
 的水溶液中通少量⑧的单质
的水溶液中通少量⑧的单质 气体可置换出单质Q
气体可置换出单质Q(7)①将
 含
含 、
、 、
、 的混合气体通过足量由④和⑤构成的淡黄色固体化合物,充分反应后气体体积变为
的混合气体通过足量由④和⑤构成的淡黄色固体化合物,充分反应后气体体积变为 ,则原气体中,
,则原气体中, 的体积为
的体积为②若将该淡黄色固体投入到含有下列离子的溶液中:
 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子含量几乎不变的有
,反应完毕后,溶液中上述离子含量几乎不变的有
您最近一年使用:0次
名校
4 . 已知A、B、C、D、E分别为原子序数依次增大的五种元素短周期元素,A与D同主族,A原子与B原子的最外层电子数之和等于C原子的最外层电子数,E原子的质子数是B原子质子数的2倍,A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)E元素的名称______ ,C元素在元素周期表中的位置 _______ 。
(2)写出BA3的电子式_______ ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式______ 。
(3)写出D的最高价氧化物的水化物与E的最高价氧化物反应的离子方程式_________ 。
(4)写出实验室中制取B的氢化物的化学方程式_________ ,B的氢化物与B的最高价氧化物的水化物反应的离子方程式________ 。
(1)E元素的名称
(2)写出BA3的电子式
(3)写出D的最高价氧化物的水化物与E的最高价氧化物反应的离子方程式
(4)写出实验室中制取B的氢化物的化学方程式
您最近一年使用:0次
名校
5 . A、B、D、X、Y、Z是原子序数依次增大的短周期主族元素。A中无中子,B的最外层电子数等于其次外层电子数的2倍;D的气态氢化物可以与其最高价氧化物的水化物反应生成盐;X是短周期中原子半径最大的元素;Y的最外层电子数等于周期序数的两倍。用化学用语回答下列问题:
(1)写出Y元素的简单离子的结构示意图__________ ;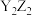 可以用作橡胶的低温硫化剂和粘合剂,请写出
可以用作橡胶的低温硫化剂和粘合剂,请写出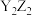 的电子式
的电子式_________________________ 。
(2)X、Y、Z三种元素的简单离子半径从大到小的顺序是_____________________ (填离子符号)。
(3)Y、Z形成的简单气态氢化物中,更稳定的是________________ (填化学式);B的一种核素可以用于测定古物的年代,请写出其核素符号__________ 。
(4)请写出实验室制备D的简单氢化物的化学方程式_______________________ 。
(5) 与Y是同一主族的元素,且在元素周期表中与Y相邻。
与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是__________ (填字母序号)。
a. 的最高正化合价为
的最高正化合价为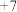 价 b.
价 b. 的还原性比
的还原性比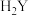 强
强
c. 的酸性比
的酸性比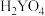 强 d.
强 d. 在一定条件下可与
在一定条件下可与 溶液反应
溶液反应
②室温下向 固体表面吹入
固体表面吹入 ,可得到两种单质和
,可得到两种单质和 ,该反应的化学方程式为
,该反应的化学方程式为__________ 。
(6)将Z的单质通入石蕊溶液中发生的颜色变化如图,请在方框内依次填写出导致该阶段颜色变化的主要粒子符号__________ 。

(1)写出Y元素的简单离子的结构示意图
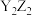 可以用作橡胶的低温硫化剂和粘合剂,请写出
可以用作橡胶的低温硫化剂和粘合剂,请写出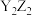 的电子式
的电子式(2)X、Y、Z三种元素的简单离子半径从大到小的顺序是
(3)Y、Z形成的简单气态氢化物中,更稳定的是
(4)请写出实验室制备D的简单氢化物的化学方程式
(5)
 与Y是同一主族的元素,且在元素周期表中与Y相邻。
与Y是同一主族的元素,且在元素周期表中与Y相邻。①根据元素周期律,下列推断正确的是
a.
 的最高正化合价为
的最高正化合价为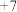 价 b.
价 b. 的还原性比
的还原性比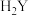 强
强c.
 的酸性比
的酸性比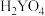 强 d.
强 d. 在一定条件下可与
在一定条件下可与 溶液反应
溶液反应②室温下向
 固体表面吹入
固体表面吹入 ,可得到两种单质和
,可得到两种单质和 ,该反应的化学方程式为
,该反应的化学方程式为(6)将Z的单质通入石蕊溶液中发生的颜色变化如图,请在方框内依次填写出导致该阶段颜色变化的主要粒子符号

您最近一年使用:0次
2023-09-10更新
|
255次组卷
|
2卷引用:重庆市巴蜀中学校2022-2023学年高一下学期3月月考化学试题
6 . 标准状态下,下列物质气态时的相对能量如下表
已知:将气态分子中1mol化学键解离为气态电中性原子时,所吸收的能量称为键能。
(1)O元素在周期表中的位置_______ ,H2O2的电子式为_______ ,其分子中含有的化学键类型为_______ 。
(2)O2的键能为_______ kJ/mol,H2O2中氧氧单键的键能为_______ kJ·mol-1;
(3)写出HOO(g)与H(g)反应生成H2O2 (g)的热化学方程式_______ ;H2的燃烧热_______  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
(4)对于可逆反应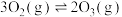 ,投入一定量的O2(g),在恒容密闭容器中进行反应,若起始压强为pokPa,5min后体系压强不再变化,此时体系压强为pkPa,则用O3表示该反应速率为
,投入一定量的O2(g),在恒容密闭容器中进行反应,若起始压强为pokPa,5min后体系压强不再变化,此时体系压强为pkPa,则用O3表示该反应速率为_______ kPa·min-1。
| 物质(g) | O | H | HO | HOO | H2 | O2 | H2O2 | H2O |
| 能量/kJ·mol-1 | 249 | 218 | 39 | 10 | 0 | 0 | -136 | -242 |
(1)O元素在周期表中的位置
(2)O2的键能为
(3)写出HOO(g)与H(g)反应生成H2O2 (g)的热化学方程式
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);(4)对于可逆反应
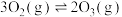 ,投入一定量的O2(g),在恒容密闭容器中进行反应,若起始压强为pokPa,5min后体系压强不再变化,此时体系压强为pkPa,则用O3表示该反应速率为
,投入一定量的O2(g),在恒容密闭容器中进行反应,若起始压强为pokPa,5min后体系压强不再变化,此时体系压强为pkPa,则用O3表示该反应速率为
您最近一年使用:0次
名校
解题方法
7 . A、B、C、D、E、F为原子序数依次增大的六种短周期主族元素。已知:A是宇宙中含量最高的元素;B、C形成的化合物是形成酸雨的主要物质;D、E、F为同周期元素,它们的最高价氧化物的水化物均可两两反应。用元素符号回答下列问题:
(1)元素C原子核内质子数比中子数少2个,满足该条件的原子符号为_______ ;元素E在周期中的位置:_______ 。
(2)若元素F的单质是一种黄绿色气体,常温时由F形成的最高价氧化物甲是一种液态物质,将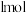 甲完全溶于水形成溶液时放出
甲完全溶于水形成溶液时放出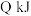 的热量,写出该过程的热化学反应方程式
的热量,写出该过程的热化学反应方程式_______ ;若元素F的单质是一种黄色固体,下列表述中能证明元素C的非金属性强于F的是_______ (填写序号)。
①元素C和F形成的化合物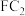 中,F化合价为
中,F化合价为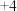 ,C化合价为
,C化合价为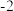
②元素C、F各自形成的最简单氢化物的沸点:前者>后者
③常温时,元素C的单质为气态,F的单质为固态
④元素C的单质可将F从其氢化物溶液中置换出来
(3)元素A、B可形成一种离子化合物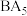 ,该化合物的电子式为
,该化合物的电子式为_______ 。
(4)用高能射线照射A、C形成的10电子分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的化学式_______ ,该阳离子存在的化学键类型有_______ 。
(5)写出元素D、E的最高价氧化物的水化物相互反应的离子方程式_______ 。
(1)元素C原子核内质子数比中子数少2个,满足该条件的原子符号为
(2)若元素F的单质是一种黄绿色气体,常温时由F形成的最高价氧化物甲是一种液态物质,将
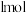 甲完全溶于水形成溶液时放出
甲完全溶于水形成溶液时放出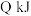 的热量,写出该过程的热化学反应方程式
的热量,写出该过程的热化学反应方程式①元素C和F形成的化合物
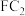 中,F化合价为
中,F化合价为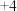 ,C化合价为
,C化合价为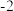
②元素C、F各自形成的最简单氢化物的沸点:前者>后者
③常温时,元素C的单质为气态,F的单质为固态
④元素C的单质可将F从其氢化物溶液中置换出来
(3)元素A、B可形成一种离子化合物
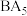 ,该化合物的电子式为
,该化合物的电子式为(4)用高能射线照射A、C形成的10电子分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的化学式
(5)写出元素D、E的最高价氧化物的水化物相互反应的离子方程式
您最近一年使用:0次
2023-05-11更新
|
581次组卷
|
2卷引用:重庆市巴蜀中学校2022-2023学年高一下学期5月期中考试化学试题
解题方法
8 . 工业氯化钡为白色粉末状晶体,是一种重要的化工原料。盐酸-硫化钡法生产氯化钡的工艺成熟、适用性强,被我国大部分工厂采用。其工艺流程如下图所示:

(1)写出硫化氢的电子式_______ 。
(2)写出高温“煅烧”时重晶石发生的主要反应的化学方程式_______ 。
(3)“酸浸”时需要控制盐酸的加入速率。请分析若加酸过快会导致怎样的危害_______ ?
(4)“酸浸”得到的氯化钡溶液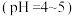 中有少量硫化物会影响产品质量,可以用双氧水进行脱硫除杂,写出反应的离子方程式
中有少量硫化物会影响产品质量,可以用双氧水进行脱硫除杂,写出反应的离子方程式_______ 。
(5)由原料重晶石带入的锶离子随着氯化钡溶液的浓缩会逐步富集。向滤液中加入铬酸,利用锶、钡的铬酸盐溶解度的差异分步沉淀出铬酸钡,进一步对钡盐和锶盐进行回收利用。若滤液中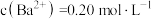 ,
,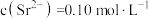 ,当
,当 沉淀完全时,则溶液中
沉淀完全时,则溶液中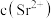 是多少
是多少_______ ?已知 时,
时,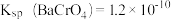 、
、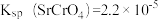 。
。

(1)写出硫化氢的电子式
(2)写出高温“煅烧”时重晶石发生的主要反应的化学方程式
(3)“酸浸”时需要控制盐酸的加入速率。请分析若加酸过快会导致怎样的危害
(4)“酸浸”得到的氯化钡溶液
 中有少量硫化物会影响产品质量,可以用双氧水进行脱硫除杂,写出反应的离子方程式
中有少量硫化物会影响产品质量,可以用双氧水进行脱硫除杂,写出反应的离子方程式(5)由原料重晶石带入的锶离子随着氯化钡溶液的浓缩会逐步富集。向滤液中加入铬酸,利用锶、钡的铬酸盐溶解度的差异分步沉淀出铬酸钡,进一步对钡盐和锶盐进行回收利用。若滤液中
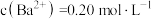 ,
,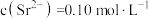 ,当
,当 沉淀完全时,则溶液中
沉淀完全时,则溶液中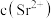 是多少
是多少 时,
时,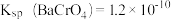 、
、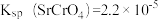 。
。
您最近一年使用:0次
名校
解题方法
9 . 元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为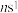 ;B元素的原子价电子排布式为
;B元素的原子价电子排布式为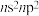 ;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。
;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。
(1)C基态原子的轨道表示式为_______ 。
(2)若A元素的原子最外层电子排布式为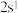 ,B元素的原子价电子排布式为
,B元素的原子价电子排布式为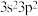 ,A、B、C、D四种元素的第一电离能由大到小的顺序是
,A、B、C、D四种元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(3)E元素的原子结构示意图是_______ ,在元素周期表中的位置是_______ 。
(4)①当 时,用电子式表示B的最简单气态氢化物的形成过程
时,用电子式表示B的最简单气态氢化物的形成过程_______ ;BC2分子的结构式是_______ 。
②当 时,B与C形成的化合物为
时,B与C形成的化合物为_______ 晶体(填“分子,共价,离子,金属”),其与氢氧化钠溶液反应的离子方程式是_______ 。它的晶胞结构如图,晶胞参数为 ,则密度为
,则密度为_______  (列出计算式)。
(列出计算式)。

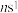 ;B元素的原子价电子排布式为
;B元素的原子价电子排布式为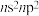 ;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。
;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。(1)C基态原子的轨道表示式为
(2)若A元素的原子最外层电子排布式为
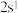 ,B元素的原子价电子排布式为
,B元素的原子价电子排布式为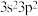 ,A、B、C、D四种元素的第一电离能由大到小的顺序是
,A、B、C、D四种元素的第一电离能由大到小的顺序是(3)E元素的原子结构示意图是
(4)①当
 时,用电子式表示B的最简单气态氢化物的形成过程
时,用电子式表示B的最简单气态氢化物的形成过程②当
 时,B与C形成的化合物为
时,B与C形成的化合物为 ,则密度为
,则密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2023-04-20更新
|
109次组卷
|
2卷引用:重庆市渝高中学校2022-2023学年高二下学期第一次月考化学试题
名校
10 . L、M、X、Y、Q为原子序数依次增大的短周期主族元素,其相关信息如下表:
请回答下列问题:
(1)M在周期表中的位置是__________ 。
(2)X、M、Y、Q简单离子的半径由大到小顺序为____________________ 。
(3)M与L能形成化合物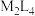 。
。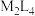 的电子式为
的电子式为____________________ 。
(4) 由固态变为气态所需克服的微粒间作用力是
由固态变为气态所需克服的微粒间作用力是__________ ;L与X的原子可形成分子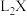 ,
,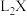 可通过
可通过_____ 结合而形成缔合分子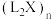 。
。
(5)Q可形成多种化合物。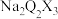 中加入稀盐酸产生可以使品红褪色的气体和淡黄色固体,则反应的离子方程式为:
中加入稀盐酸产生可以使品红褪色的气体和淡黄色固体,则反应的离子方程式为:_______________ 。
元素 | 相关信息 |
L | 单质为气体 |
M | 单质为气体 |
X | X是地壳中含量最高的元素 |
Y | Y的最外层电子数为Q的最外层电子数的一半 |
Q | Q的最外层电子数是L和M的最外层电子数之和 |
(1)M在周期表中的位置是
(2)X、M、Y、Q简单离子的半径由大到小顺序为
(3)M与L能形成化合物
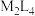 。
。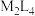 的电子式为
的电子式为(4)
 由固态变为气态所需克服的微粒间作用力是
由固态变为气态所需克服的微粒间作用力是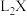 ,
,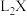 可通过
可通过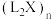 。
。(5)Q可形成多种化合物。
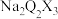 中加入稀盐酸产生可以使品红褪色的气体和淡黄色固体,则反应的离子方程式为:
中加入稀盐酸产生可以使品红褪色的气体和淡黄色固体,则反应的离子方程式为:
您最近一年使用:0次



