名校
解题方法
1 . 现有部分短周期元素的信息如表所示:
A、B、D三种单质(分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种高能燃料,分子中含有18个电子,其组成元素与丙相同。___________ ,其简单离子的结构示意图为___________ 。
(2)丁的电子式为___________ 。
(3)丙中所含的化学键类型是___________ (填序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 molNaClO参加反应时转移1 mol电子,该反应的化学方程式为___________ 。
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为___________ 。
| 元素编号 | 元素性质或原子结构信息 |
| X | 第三周期元素中简单离子半径最小的元素 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 原子核外电子数和所在周期数相等 |

(2)丁的电子式为
(3)丙中所含的化学键类型是
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 molNaClO参加反应时转移1 mol电子,该反应的化学方程式为
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.A、B、C、D、E为短周期主族元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C常温下能形成两种液态化合物 和
和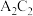 ,E元素的周期数与主族序数相等。请用化学用语回答下列问题:
,E元素的周期数与主族序数相等。请用化学用语回答下列问题:
(1)B元素在元素周期表中的位置为__________ ;由A、C、D三种元素组成的化合物中含有的化学键为__________ 。
(2)写出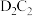 的电子式:
的电子式:__________ 。
(3)元素E的单质与元素D的最高价氧化物对应的水化物反应的离子方程式:__________ 。
(4)常温下, 与元素D的单质反应后,所得溶液的pH
与元素D的单质反应后,所得溶液的pH__________ (填“<”“=”或“>”)7。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,灼烧该化合物时,火焰呈__________ 色,DA能与水反应放出氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是__________ L。
Ⅱ.甲同学设计了图1装置探究硫和氯的非金属性相对强弱。__________ 。B装置的作用是除去 中的HCl,则B中的试剂是
中的HCl,则B中的试剂是__________ (填名称)。
(7)实验过程中,C中产生浅黄色沉淀,写出C中反应的离子方程式:__________ 。
Ⅲ.最近,德国科学家实现了Rb原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知Rb的原子序数为37,相对原子质量是85。
(8)下列关于Rb的说法中不正确的是__________ 。
a.与水反应比钠更剧烈 b. 在空气中易吸收水和二氧化碳
在空气中易吸收水和二氧化碳
c. 与水能剧烈反应并释放出
与水能剧烈反应并释放出 d.单质具有很强的氧化性
d.单质具有很强的氧化性
e.RbOH的碱性比同浓度的NaOH强
 和
和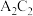 ,E元素的周期数与主族序数相等。请用化学用语回答下列问题:
,E元素的周期数与主族序数相等。请用化学用语回答下列问题:(1)B元素在元素周期表中的位置为
(2)写出
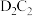 的电子式:
的电子式:(3)元素E的单质与元素D的最高价氧化物对应的水化物反应的离子方程式:
(4)常温下,
 与元素D的单质反应后,所得溶液的pH
与元素D的单质反应后,所得溶液的pH(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,灼烧该化合物时,火焰呈
Ⅱ.甲同学设计了图1装置探究硫和氯的非金属性相对强弱。

 中的HCl,则B中的试剂是
中的HCl,则B中的试剂是(7)实验过程中,C中产生浅黄色沉淀,写出C中反应的离子方程式:
Ⅲ.最近,德国科学家实现了Rb原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知Rb的原子序数为37,相对原子质量是85。
(8)下列关于Rb的说法中不正确的是
a.与水反应比钠更剧烈 b.
 在空气中易吸收水和二氧化碳
在空气中易吸收水和二氧化碳c.
 与水能剧烈反应并释放出
与水能剧烈反应并释放出 d.单质具有很强的氧化性
d.单质具有很强的氧化性e.RbOH的碱性比同浓度的NaOH强
您最近一年使用:0次
解题方法
3 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。由镍矿渣[主要含 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图: 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在: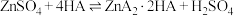
(1)“酸浸”过程中,生成了一种臭鸡蛋气味的气体,写出相应反应的离子方程式_______ ,滤渣1的主要成分是_______ 。
(2)已知“除铁”时,NaClO的作用是将 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式_______ 。
(3)“除钙”时,加入 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式_______ 。
(4)若已知萃取剂的密度大于水的密度,则应保留_______ 液体。(填“上层”或“下层”)在完成“萃取”操作后,后续操作依次为_______ 、_______ 。
 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图: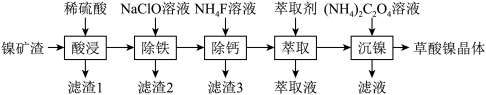
 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在: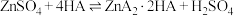
(1)“酸浸”过程中,生成了一种臭鸡蛋气味的气体,写出相应反应的离子方程式
(2)已知“除铁”时,NaClO的作用是将
 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式(3)“除钙”时,加入
 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式(4)若已知萃取剂的密度大于水的密度,则应保留
您最近一年使用:0次
名校
解题方法
4 . 下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
(1)①④⑤三种元素形成既含离子键又含极性键的化合物,该化合物的电子式为___________ 。
(2)元素①⑤组成的化合物与水反应的化学方程式为___________ 。用一个化学反应证明元素⑨比元素③的得电子能力强,该反应的化学方程式为___________ 。
(3)甲同学查阅资料知:氨气( )的分解温度在850℃以上,甲烷(
)的分解温度在850℃以上,甲烷( )的分解温度是655℃,据此得出结论:元素②的非金属性比③的非金属性
)的分解温度是655℃,据此得出结论:元素②的非金属性比③的非金属性___________ (填“强”或“弱”)。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论,则甲同学的实验方案是___________ (请用离子方程式表示)。元素⑦的简单气态氢化物的空间构型为___________ 。
(4)①和④形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的结构式___________ 。
实验室中可用次氯酸钠溶液与氨反应制备①③组成的18电子化合物乙,化学方程式为___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)元素①⑤组成的化合物与水反应的化学方程式为
(3)甲同学查阅资料知:氨气(
 )的分解温度在850℃以上,甲烷(
)的分解温度在850℃以上,甲烷( )的分解温度是655℃,据此得出结论:元素②的非金属性比③的非金属性
)的分解温度是655℃,据此得出结论:元素②的非金属性比③的非金属性(4)①和④形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的结构式
实验室中可用次氯酸钠溶液与氨反应制备①③组成的18电子化合物乙,化学方程式为
您最近一年使用:0次
解题方法
5 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经150多年。如图是元素周期表的一部分。
回答下列问题:
(1)写出 的离子结构示意图
的离子结构示意图______ 。Q的最高正价为______ ;D的气态氢化物为______ (填化学式)。
(2)元素Y在元素周期表中的位置为______ ,其元素性质与Al相似,写出Y的氧化物溶解在NaOH溶液中的离子方程式______ 。
(3)上述元素最简单氢化物热稳定性最高的是______ 元素(填元素符号)。D、M的最高价含氧酸的酸性由强到弱的顺序是______ (用化学式表示)。
(4)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱______ (填标号)。
(可供选择的药品有:A. 固体 B.稀硫酸 C.盐酸 D.饱和
固体 B.稀硫酸 C.盐酸 D.饱和 溶液 E.硅酸钠溶液)
溶液 E.硅酸钠溶液)
(5)M、Z可化合形成化合物,应用于未来超算设备的新型半导体材料,其化学式为______ 。
B | C | N | O | F |
Al | Si | Cl | ||
Y | D | M | ||
Z | Q |
(1)写出
 的离子结构示意图
的离子结构示意图(2)元素Y在元素周期表中的位置为
(3)上述元素最简单氢化物热稳定性最高的是
(4)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱
(可供选择的药品有:A.
 固体 B.稀硫酸 C.盐酸 D.饱和
固体 B.稀硫酸 C.盐酸 D.饱和 溶液 E.硅酸钠溶液)
溶液 E.硅酸钠溶液)(5)M、Z可化合形成化合物,应用于未来超算设备的新型半导体材料,其化学式为
您最近一年使用:0次
名校
解题方法
6 . 下表列出了①~⑩十种元素在周期表中的位置:
请按要求回答下列问题:
(1)上述元素中,金属性最强的是______ (填元素名称),最高价氧化物对应水化物酸性最强的是______ (填化学式)
(2)由元素③形成的单质的结构式为______ ,由元素⑥和⑨形成化合物乙,请用电子式表示物质乙的形成过程______ 。
(3)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为______ 。
(4)可以比较⑤、⑥两元素金属性强弱的实验是______。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ |
(1)上述元素中,金属性最强的是
(2)由元素③形成的单质的结构式为
(3)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为
(4)可以比较⑤、⑥两元素金属性强弱的实验是______。
| A.比较这两种元素最高价氧化物对应的水化物的碱性 |
| B.将⑤的单质投入到⑥的盐溶液中 |
| C.将这两种元素的单质分别放入冷水中 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
您最近一年使用:0次
解题方法
7 . 元素周期表与元素周期律在学习、研究中有很重要的作用。表中是6种不同元素的相关信息,其中W、X、Y、Z位于短周期。请回答以下问题:
(1)元素W、X、Y最高价氧化物水化物的酸性由强到弱的顺序为_______ (填化学式)。与Y同主族元素硒Se位于Y的下一周期,则Se在元素周期表中的位置是_______ , 的电子式是
的电子式是_______ 。
(2)元素周期表中,同主族元素性质具有相似性和递变性,请写出元素Q的单质与水反应的离子方程式_______ 。Z与X分别形成的气态简单氢化物稳定性高的为_______ (填化学式)。
(3)海水中提取R的单质,将R氧化为单质后,用空气将其吹入吸收塔中,与吸收剂 和水反应,则发生反应的离子的方程式是
和水反应,则发生反应的离子的方程式是_______ 。
| 元素 | 元素相关信息 |
| W | 最高化合价+7价 |
| X | 原子最外层电子数是内层电子总数的一半,且为非金属元素 |
| Y | 原子M层比L层少2个电子 |
| Z | 原子获得3个电子达到8电子稳定结构 |
| Q | 焰色试验(透过蓝色钴玻璃观察)火焰呈紫色 |
| R | 原子结构示意图为: |
 的电子式是
的电子式是(2)元素周期表中,同主族元素性质具有相似性和递变性,请写出元素Q的单质与水反应的离子方程式
(3)海水中提取R的单质,将R氧化为单质后,用空气将其吹入吸收塔中,与吸收剂
 和水反应,则发生反应的离子的方程式是
和水反应,则发生反应的离子的方程式是
您最近一年使用:0次
2024·上海·模拟预测
8 . 钯催化剂(主要成分为Pd、α-Al2O3,还含少量铁、铜等)是石油化工中催化加氢和催化氧化等反应的重要催化剂。一种从废钯催化剂中回收海绵钯的工艺流程如下:
②常温下,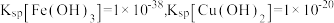 。
。
回答下列问题:
(1)“还原Ⅰ”过程中加入甲酸的主要目的是还原___________ (填化学式)。
(2)“酸浸”过程中Pd转化的离子方程式为___________ 。
(3)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”最佳条件为___________ 。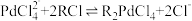 ,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是
,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是___________ 。
(5)“沉钯”过程钯元素主要发生如下转化:H2PdCl4 (稀溶液) [Pd(NH3)4]Cl2 (稀溶液)
[Pd(NH3)4]Cl2 (稀溶液) [Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为
[Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为___________ (填化学式)。
(6)N2H4的电子式为___________ 。
(7)“还原Ⅱ”过程中产生无毒无害气体。由[Pd(NH3)2]Cl2生成海绵钯的化学方程式为___________ 。
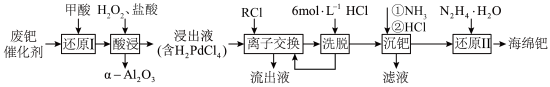
(8)H2和O2在钯的配合物离子[PdCl4]2-的作用下合成H2O2,反应历程如图。下列说法不正确的是 。
②常温下,
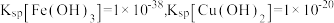 。
。回答下列问题:
(1)“还原Ⅰ”过程中加入甲酸的主要目的是还原
(2)“酸浸”过程中Pd转化的离子方程式为
(3)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”最佳条件为

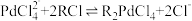 ,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是
,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是(5)“沉钯”过程钯元素主要发生如下转化:H2PdCl4 (稀溶液)
 [Pd(NH3)4]Cl2 (稀溶液)
[Pd(NH3)4]Cl2 (稀溶液) [Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为
[Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为(6)N2H4的电子式为
(7)“还原Ⅱ”过程中产生无毒无害气体。由[Pd(NH3)2]Cl2生成海绵钯的化学方程式为
(8)H2和O2在钯的配合物离子[PdCl4]2-的作用下合成H2O2,反应历程如图。下列说法不正确的是 。

| A.H2O2中存在极性键和非极性键 |
| B.[PdCl4]2-中Pd2+提供空轨道形成配位键 |
| C.反应①、②、③均属于氧化还原反应 |
| D.等物质的量的H2和O2发生反应时,反应①和反应②转移的电子数之比为1:1 |
您最近一年使用:0次
9 . 化学在生产生活中无处不在。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)汽车受到猛烈碰撞时,点火器点火引发 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是___________ (填字母),生成氮气的电子式为___________ 。 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。
(2)将2.0 mol 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ 。
(3)一定条件下,将1.0 mol 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应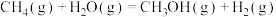 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是___________ (填字母)。
a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的 e.加入合适的催化剂
e.加入合适的催化剂
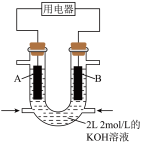
(4)用 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为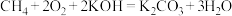 。
。 向B电极定向移动,则
向B电极定向移动,则___________ (填“A”或“B”)电极入口通甲烷,该电极反应的离子方程式为___________ 。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___________ 。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。(1)汽车受到猛烈碰撞时,点火器点火引发
 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是A.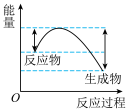 B.
B.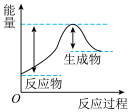 C.
C.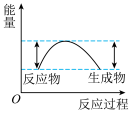
 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。(2)将2.0 mol
 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为(3)一定条件下,将1.0 mol
 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应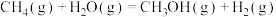 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的
 e.加入合适的催化剂
e.加入合适的催化剂(4)用
 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为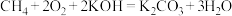 。
。
 向B电极定向移动,则
向B电极定向移动,则②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
您最近一年使用:0次
名校
解题方法
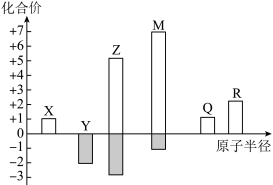
10 . X、Y、Z、M、Q、R皆为周期表中前20号元素,其原子半径与主要化合价的关系如图所。 电子式为
电子式为_________ 。
(2)比较Y和Z的简单氢化物,更稳定的是_________ (填化学式)。
(3)已知Q位于第三周期,则R在元素周期表中的位置是_________ 。
(4)下列推断正确的是_________ (填“序号”)。
a.简单离子半径: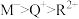
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式_________ ;比较 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是_________ (填离子符号),从原子结构的角度解释原因_________ 。
 电子式为
电子式为(2)比较Y和Z的简单氢化物,更稳定的是
(3)已知Q位于第三周期,则R在元素周期表中的位置是
(4)下列推断正确的是
a.简单离子半径:
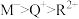
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式
 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是
您最近一年使用:0次