解题方法
1 . 下列根据实验操作及现象不能达到相应实验目的的是
| 选项 | 实验操作及现象 | 实验目的 |
| A | 向滴有几滴 的 的 溶液中加入 溶液中加入 ,缓缓通入少量 ,缓缓通入少量 并振荡、静置,水层显红色,有机层显无色 并振荡、静置,水层显红色,有机层显无色 | 验证还原性: |
| B | 相同温度下,同时进行 与 与 和 和 的反应,观察产生 的反应,观察产生 的快慢 的快慢 | 探究 键的极性对反应速率的影响 键的极性对反应速率的影响 |
| C | 将胆矾晶体投入浓硫酸中,固体由蓝色变为白色 | 验证浓硫酸具有脱水性 |
| D | 分别测定 和 和 与盐酸反应的反应热 与盐酸反应的反应热 | 确定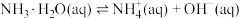 的 的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 几种含碘粒子之间的转化关系如图所示,下列说法正确的是

A. 、 、 和 和 的氧化性强弱: 的氧化性强弱: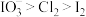 |
B.为增大 的产量,反应②可以加过量NaHSO3 的产量,反应②可以加过量NaHSO3 |
| C.将淀粉KI溶液逐滴滴入新制氯水中,溶液颜色先变浅后变蓝 |
| D.产生等量的I2,反应④消耗的H+与反应②产生的H+的量相等 |
您最近一年使用:0次
名校
解题方法
3 . 电化学中,常用电极电势表示一定条件下微粒得失电子能力,电极电势越高氧化性越强。标准状态下,氧化型电极反应 ,
,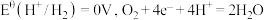 ,
,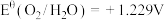 ,则
,则 的氧化性比
的氧化性比 强。含钴微粒的电极电势随
强。含钴微粒的电极电势随 的变化如图所示,两条虚线分别表示“氧线”和“氢线”。下列说法错误的是
的变化如图所示,两条虚线分别表示“氧线”和“氢线”。下列说法错误的是
 ,
,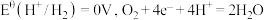 ,
,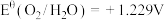 ,则
,则 的氧化性比
的氧化性比 强。含钴微粒的电极电势随
强。含钴微粒的电极电势随 的变化如图所示,两条虚线分别表示“氧线”和“氢线”。下列说法错误的是
的变化如图所示,两条虚线分别表示“氧线”和“氢线”。下列说法错误的是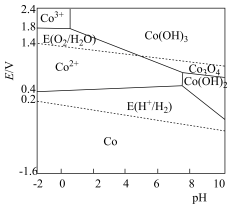
A.单质 溶于稀硫酸能置换出 溶于稀硫酸能置换出 |
| B.氧气的氧化性与溶液的酸碱性有关 |
C.一定条件下 转化为 转化为 ,氧化能力减弱 ,氧化能力减弱 |
D.酸性条件下,反应 难以进行 难以进行 |
您最近一年使用:0次
7日内更新
|
234次组卷
|
5卷引用:2024届山东省高三下学期联合模拟考试模拟预测化学试题
2024届山东省高三下学期联合模拟考试模拟预测化学试题2024届山东省潍坊市四县联考高三下学期三模化学试题山东省德州市第一中学2024届下学期三模化学试题湖南省雅礼中学2024届高三下学期热身训练(三模)化学试题(已下线)第04讲 氧化还原反应的基本概念和规律(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
4 . 二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。回答下列问题:
(1)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图。_______ ;
②“碳捕获”技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量之比为1∶1,则反应的离子方程式为_______ ;
③下列溶液中,同样能用于“捕捉”二氧化碳的是_______ (填选项字母);
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
(2) 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图所示。
排放并实现资源利用,原理如图所示。_______ ;
②若产生等物质的量CO、 ,写出反应Ⅱ的化学方程式:
,写出反应Ⅱ的化学方程式:_______ 。
(3)从空气中捕获 直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。
直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。_______ ;
②如图所示转化总反应的化学方程式是_______ 。
(1)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图。
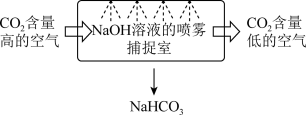
②“碳捕获”技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量之比为1∶1,则反应的离子方程式为
③下列溶液中,同样能用于“捕捉”二氧化碳的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液(2)
 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图所示。
排放并实现资源利用,原理如图所示。
②若产生等物质的量CO、
 ,写出反应Ⅱ的化学方程式:
,写出反应Ⅱ的化学方程式:(3)从空气中捕获
 直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。
直接转化为甲醇是二十多年来“甲醇经济”领域的研究热点,诺贝尔化学奖获得者乔治·安德鲁教授首次以金属钉作催化剂实现了这种转化,其转化如图所示。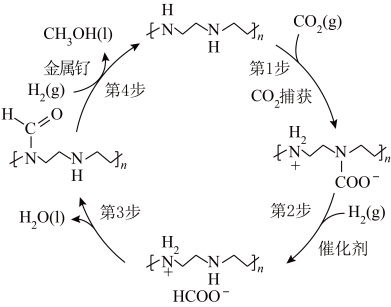
②如图所示转化总反应的化学方程式是
您最近一年使用:0次
名校
5 . 三氯化铬( )为紫色晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,其在工业生产中应用广泛,利用
)为紫色晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,其在工业生产中应用广泛,利用 ,以
,以 、
、 (沸点为76.8°C)为原料制备无水
(沸点为76.8°C)为原料制备无水 的实验装置图如下所示.
的实验装置图如下所示. 和水,装置A中产生
和水,装置A中产生 的作用为
的作用为________ 。
A.排尽装置中的空气 B.平衡气压 C.吹出 和
和
(2)装置C和装置E水槽中盛有的液体分别为________ 、________ 。
A.沸水 B.冰水
(3)装置D中另一产物为光气( ),D中反应的化学方程式为
),D中反应的化学方程式为________ 。
(4)三氯化铬属于________。
(5)利用氨气与次氯酸钠反应制备 ,写出化学方程式
,写出化学方程式________ 。
(6)将制得的 分离提纯后,进行如下实验。
分离提纯后,进行如下实验。 ,
, 可溶于氨水和硝酸。
可溶于氨水和硝酸。
【提出假设】黑色固体可能是Ag、 中的一种或两种。
中的一种或两种。
【实验验证】设计如下方案,进行实验。
(7)在10mL 的
的 溶液中加入适量肼,恰好将
溶液中加入适量肼,恰好将 完全转化为Ag(无
完全转化为Ag(无 生成),将反应后的混合物微热(忽略硝酸分解),黑色固体部分溶解,气体产物为NO,充分反应后,最终可得到Ag
生成),将反应后的混合物微热(忽略硝酸分解),黑色固体部分溶解,气体产物为NO,充分反应后,最终可得到Ag________ g。(要求写出具体计算过程)
 )为紫色晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,其在工业生产中应用广泛,利用
)为紫色晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,其在工业生产中应用广泛,利用 ,以
,以 、
、 (沸点为76.8°C)为原料制备无水
(沸点为76.8°C)为原料制备无水 的实验装置图如下所示.
的实验装置图如下所示.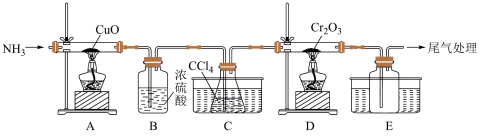
 和水,装置A中产生
和水,装置A中产生 的作用为
的作用为A.排尽装置中的空气 B.平衡气压 C.吹出
 和
和
(2)装置C和装置E水槽中盛有的液体分别为
A.沸水 B.冰水
(3)装置D中另一产物为光气(
 ),D中反应的化学方程式为
),D中反应的化学方程式为(4)三氯化铬属于________。
| A.分子晶体 | B.离子晶体 | C.共价晶体 | D.金属晶体 |
(5)利用氨气与次氯酸钠反应制备
 ,写出化学方程式
,写出化学方程式(6)将制得的
 分离提纯后,进行如下实验。
分离提纯后,进行如下实验。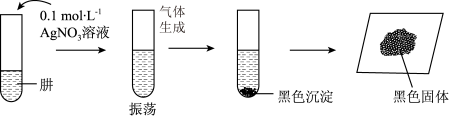
 ,
, 可溶于氨水和硝酸。
可溶于氨水和硝酸。【提出假设】黑色固体可能是Ag、
 中的一种或两种。
中的一种或两种。【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 结论 |
| ⅰ.取少量黑色固体于试管中,加入足量 | 黑色固体部分溶解 | 黑色固体中有 |
| ⅱ.取少量黑色固体于试管中,加入足量稀硝酸,振荡 | 黑色固体是Ag和 ,则肼具有的性质是碱性和③ ,则肼具有的性质是碱性和③ |
(7)在10mL
 的
的 溶液中加入适量肼,恰好将
溶液中加入适量肼,恰好将 完全转化为Ag(无
完全转化为Ag(无 生成),将反应后的混合物微热(忽略硝酸分解),黑色固体部分溶解,气体产物为NO,充分反应后,最终可得到Ag
生成),将反应后的混合物微热(忽略硝酸分解),黑色固体部分溶解,气体产物为NO,充分反应后,最终可得到Ag
您最近一年使用:0次
名校
解题方法
6 . 氢氧化氧镍( )难溶于水,常用作碱性镍镉电池的电极材料。一种用含镍废料(主要含
)难溶于水,常用作碱性镍镉电池的电极材料。一种用含镍废料(主要含 ,以及少量
,以及少量 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如图:
的工艺流程如图: 的性质较稳定。
的性质较稳定。
回答下列问题:
(1)为了提高“浸取”中废料的浸出效率,下列采取的措施不合理的有______(填标号)。
(2)“浸取渣”的主要成分为______ (填化学式)。
(3)“除铜”过程中发生了两个化学反应,写出生成S的离子方程式:______ 。
(4)“转化”时 的作用是
的作用是______ ,实际生产中发现 的实际用量比理论用量多,原因是
的实际用量比理论用量多,原因是______ 。
(5)已知该工艺条件下金属阳离子生成对应氢氧化物沉淀时的 如下表所示:
如下表所示:
则“沉铁”过程中加入 溶液调节
溶液调节 的范围应为
的范围应为______ 。
(6)“氧化”时发生反应的离子方程式为______ 。若用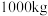 废料(其中
废料(其中 的质量分数为
的质量分数为 )经该流程制得
)经该流程制得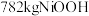 固体,则
固体,则 的产率为
的产率为______ 。( )
)
 )难溶于水,常用作碱性镍镉电池的电极材料。一种用含镍废料(主要含
)难溶于水,常用作碱性镍镉电池的电极材料。一种用含镍废料(主要含 ,以及少量
,以及少量 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如图:
的工艺流程如图: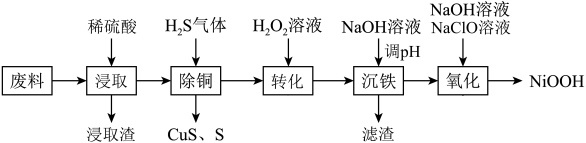
 的性质较稳定。
的性质较稳定。回答下列问题:
(1)为了提高“浸取”中废料的浸出效率,下列采取的措施不合理的有______(填标号)。
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.使用 浓硫酸浸取 浓硫酸浸取 |
(2)“浸取渣”的主要成分为
(3)“除铜”过程中发生了两个化学反应,写出生成S的离子方程式:
(4)“转化”时
 的作用是
的作用是 的实际用量比理论用量多,原因是
的实际用量比理论用量多,原因是(5)已知该工艺条件下金属阳离子生成对应氢氧化物沉淀时的
 如下表所示:
如下表所示:金属阳离子 |
|
|
|
开始沉淀时的pH | 1.5 | 6.5 | 7.2 |
沉淀完全时的pH | 3.2 | 9.7 | 9.2 |
 溶液调节
溶液调节 的范围应为
的范围应为(6)“氧化”时发生反应的离子方程式为
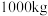 废料(其中
废料(其中 的质量分数为
的质量分数为 )经该流程制得
)经该流程制得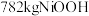 固体,则
固体,则 的产率为
的产率为 )
)
您最近一年使用:0次
7 . 人们常用 消除氮氧化物(
消除氮氧化物( )的污染,
)的污染, 消除
消除 的反应(未配平)分两步:①
的反应(未配平)分两步:①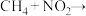
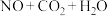 、②
、②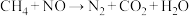 。下列说法正确的是(设
。下列说法正确的是(设 是阿伏加德罗常数的值)
是阿伏加德罗常数的值)
 消除氮氧化物(
消除氮氧化物( )的污染,
)的污染, 消除
消除 的反应(未配平)分两步:①
的反应(未配平)分两步:①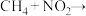
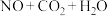 、②
、②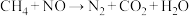 。下列说法正确的是(设
。下列说法正确的是(设 是阿伏加德罗常数的值)
是阿伏加德罗常数的值)| A.反应①中n(氧化剂)∶n(还原剂)=1∶4 |
B.反应②中,生成1mol水转移电子的数目为4 |
C.NO和 均可用排空气法收集 均可用排空气法收集 |
D.由①和②可知,还原性:NO> |
您最近一年使用:0次
解题方法
8 . 根据实验操作和现象得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 用硫酸酸化的 溶液滴入 溶液滴入 溶液中,溶液变黄色 溶液中,溶液变黄色 | 氧化性: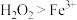 |
| B | 向某溶液中加入足量氯水,再滴加淀粉溶液,溶液未变蓝色 | 溶液中不含I⁻ |
| C | 取足量铜和浓硫酸反应后的溶液于试管中,依次加入稀盐酸、 溶液,产生大量白色沉淀 溶液,产生大量白色沉淀 | 说明硫酸有剩余 |
| D | 将两支盛有等体积、等浓度的 溶液的大小相同的试管分别置于冷水、热水中,同时加入等体积、等浓度的稀硫酸。置于热水中的试管比置于冷水中的试管先出现沉淀 溶液的大小相同的试管分别置于冷水、热水中,同时加入等体积、等浓度的稀硫酸。置于热水中的试管比置于冷水中的试管先出现沉淀 | 其他条件相同时,升高温度能加快反应速率 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 下围是以氮气和氢气为原料合成氨,并以氨为原料生产硝酸的工艺流程(其中空气等基础原料已略去).________________ .
(2)若条件控制不当,氨氧化装置中可能发生副反应, 与
与 生成
生成 ,该副反应中氧化剂与还原剂的物质的量之比为
,该副反应中氧化剂与还原剂的物质的量之比为________ .
(3)下列离子能在溶液中共存,但加入适量 溶液后无法大量共存的是________.
溶液后无法大量共存的是________.
(4)将25.6g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为8.96L(标准状况,不考虑
和NO混合气体的体积为8.96L(标准状况,不考虑 二聚).待产生的气体全部释放后,向溶液加入100mL
二聚).待产生的气体全部释放后,向溶液加入100mL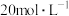 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为________  .
.
(5)可以用 还原
还原 生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的
生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的 与
与 的物质的量之比是
的物质的量之比是________ .

(2)若条件控制不当,氨氧化装置中可能发生副反应,
 与
与 生成
生成 ,该副反应中氧化剂与还原剂的物质的量之比为
,该副反应中氧化剂与还原剂的物质的量之比为(3)下列离子能在溶液中共存,但加入适量
 溶液后无法大量共存的是________.
溶液后无法大量共存的是________.A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
(4)将25.6g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生
 和NO混合气体的体积为8.96L(标准状况,不考虑
和NO混合气体的体积为8.96L(标准状况,不考虑 二聚).待产生的气体全部释放后,向溶液加入100mL
二聚).待产生的气体全部释放后,向溶液加入100mL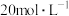 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 .
.(5)可以用
 还原
还原 生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的
生成BaO,该过程分两步进行.下图表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的 与
与 的物质的量之比是
的物质的量之比是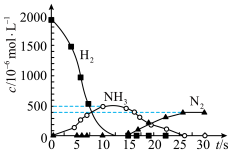
您最近一年使用:0次
名校
解题方法
10 . “微生物法”处理含 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含 废水。
废水。
(1)硫酸盐还原菌能将水中的 转化为
转化为 ,
, 与
与 可反应生成
可反应生成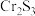 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在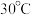 左右,温度过高,
左右,温度过高, 的去除率低的原因是
的去除率低的原因是___________ 。
(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为___________ 。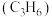 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。___________ ,乙为___________ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为___________ 。
 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含 废水。
废水。(1)硫酸盐还原菌能将水中的
 转化为
转化为 ,
, 与
与 可反应生成
可反应生成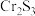 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在
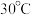 左右,温度过高,
左右,温度过高, 的去除率低的原因是
的去除率低的原因是(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的
 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为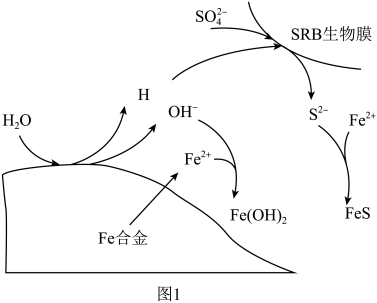
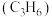 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。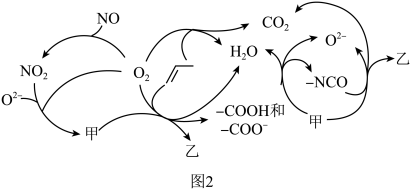
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次




