名校
1 . 碘酸钾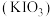 是常用的食盐加碘剂,用
是常用的食盐加碘剂,用 氧化
氧化 得到
得到 溶液,再经一系列步骤得到
溶液,再经一系列步骤得到 产品。
产品。 是一种白色晶体,在水中溶解度随温度升高而增大。
是一种白色晶体,在水中溶解度随温度升高而增大。
下列说法错误的是
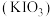 是常用的食盐加碘剂,用
是常用的食盐加碘剂,用 氧化
氧化 得到
得到 溶液,再经一系列步骤得到
溶液,再经一系列步骤得到 产品。
产品。
 是一种白色晶体,在水中溶解度随温度升高而增大。
是一种白色晶体,在水中溶解度随温度升高而增大。下列说法错误的是
A.水浴加热时发生反应的离子方程式为 |
| B.滴入适量乙醇的作用是除去多余的高锰酸钾 |
| C.为提高洗涤效果,可用热水进行洗涤 |
| D.在冷却结晶时,温度过低可能导致产品的纯度降低 |
您最近一年使用:0次
真题
2 . 劳动人民的发明创造是中华优秀传统文化的组成部分。下列化学原理描述错误的是
| 发明 | 关键操作 | 化学原理 | |
| A | 制墨 | 松木在窑内焖烧 | 发生不完全燃烧 |
| B | 陶瓷 | 黏土高温烧结 | 形成新的化学键 |
| C | 造纸 | 草木灰水浸泡树皮 | 促进纤维素溶解 |
| D | 火药 | 硫黄、硝石和木炭混合,点燃 | 发生氧化还原反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 焦亚硫酸钠(Na2S2O5)是一种重要的化工原料。工业上,以黄铁矿(主要成分FeS2)生产硫酸的尾气为原料制备焦亚硫酸钠的一种流程如下图所示:
(1)FeS2中铁元素的化合价为_______ 。
(2)“煅烧”时,主要反应的化学方程式为_______ 。
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是_______ 。
(4)因为Na2S2O5具有_______ 性,长期放置Na2S2O5样品会不可避免地存在Na2SO4,检验其中含有SO 的试剂是
的试剂是_______ 。
(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式_______
_______I2+ _______S2O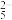 + _______H2O = _______I- + _______SO
+ _______H2O = _______I- + _______SO + _______H+
+ _______H+
在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为_______ g/L。

(1)FeS2中铁元素的化合价为
(2)“煅烧”时,主要反应的化学方程式为
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是
(4)因为Na2S2O5具有
 的试剂是
的试剂是(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式
_______I2+ _______S2O
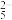 + _______H2O = _______I- + _______SO
+ _______H2O = _______I- + _______SO + _______H+
+ _______H+在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为
您最近一年使用:0次
4 . 某实验小组研究Zn单质与三价铁盐的反应。
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
【实验过程】
【分析解释】
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为___________ 。
(2)实验II中,产生的大量气体为___________ (填化学式)。
(3)实验III中,溶液变成深棕色,NO 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:___________ 。
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为___________ (填实验编号)。
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为___________
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO
 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。【实验过程】
| 实验 | 编号 | 试剂 | 现象 |
| I | 0.1 mol·L-1 FeCl3溶液(pH≈1.30 ) | 黄色溶液很快变浅,有无色气泡产生,无铁产生 |
| II | 1 mol·L-1 FeCl3溶液 (pH≈0.70 ) | 片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁 | |
| III | 1 mol·L-1 Fe(NO3)3溶液(pH≈0.70 ) | 约半小时后,溶液变为深棕色且浑浊,无铁产生 | |
| IV | 0.5 mol·L-1 Fe2(SO4)3溶液(pH≈0.70 ) | 约半小时后,溶液呈浅绿色且浑浊,产生少量铁 |
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为
(2)实验II中,产生的大量气体为
(3)实验III中,溶液变成深棕色,NO
 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:3Zn + NO
NO +8H+=3Zn2++
+8H+=3Zn2++ ___________+4H2O
___________+4H2O
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为
您最近一年使用:0次
名校
5 . 根据所学知识,回答下列问题。
(1)已知反应: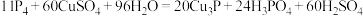 在该反应中,氧化剂是
在该反应中,氧化剂是_______ (填化学式),被氧化的元素是_______ (填元素符号)。
(2)下列状态的物质,既属于电解质又能导电的是_______。(填标号)
(3) 是人体必需的微量元素,其中
是人体必需的微量元素,其中 的中子数是
的中子数是_______ ,其氢化物 的结构式为
的结构式为_______ 。
(4)写出炽热的碳与浓硫酸反应的化学方程式_______ 。
(5)已知反应: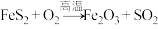 (未配平),若生成标准状况下
(未配平),若生成标准状况下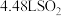 ,则转移的电子数为
,则转移的电子数为_______ 。
(6)往碘化钾溶液中通入少量 ,所发生的离子方程式
,所发生的离子方程式_______ 。
(1)已知反应:
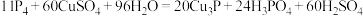 在该反应中,氧化剂是
在该反应中,氧化剂是(2)下列状态的物质,既属于电解质又能导电的是_______。(填标号)
| A.氯化镁晶体 | B.氯化钠溶液 | C.液态氯化氢 | D.熔融氢氧化钾 |
 是人体必需的微量元素,其中
是人体必需的微量元素,其中 的中子数是
的中子数是 的结构式为
的结构式为(4)写出炽热的碳与浓硫酸反应的化学方程式
(5)已知反应:
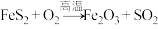 (未配平),若生成标准状况下
(未配平),若生成标准状况下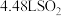 ,则转移的电子数为
,则转移的电子数为(6)往碘化钾溶液中通入少量
 ,所发生的离子方程式
,所发生的离子方程式
您最近一年使用:0次
真题
6 . 家务劳动中蕴含着丰富的化学知识。下列相关解释错误的是
A.用过氧碳酸钠漂白衣物: 具有较强氧化性 具有较强氧化性 |
| B.酿米酒需晾凉米饭后加酒曲:乙醇受热易挥发 |
| C.用柠檬酸去除水垢:柠檬酸酸性强于碳酸 |
| D.用碱液清洗厨房油污:油脂可碱性水解 |
您最近一年使用:0次
7日内更新
|
1800次组卷
|
4卷引用:2024年吉林省高考化学试题
真题
7 .  分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(①
分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(① 溶液;②淀粉、丙二酸和
溶液;②淀粉、丙二酸和 混合溶液;③
混合溶液;③ 、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
 分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(①
分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(① 溶液;②淀粉、丙二酸和
溶液;②淀粉、丙二酸和 混合溶液;③
混合溶液;③ 、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是A.无色→蓝色:生成 | B.蓝色→无色: 转化为化合态 转化为化合态 |
C. 起漂白作用 起漂白作用 | D.淀粉作指示剂 |
您最近一年使用:0次
7日内更新
|
1759次组卷
|
4卷引用:2024年吉林省高考化学试题
名校
8 . 一种从海水中提取溴的工艺流程如图所示。下列叙述错误的是
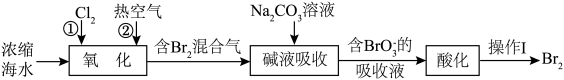
| A.“氧化”时,通入氯气前需要将海水酸化 |
B.吸收液中大量存在的离子为: 、 、 、 、 、 、 |
C.“酸化”时发生反应的离子方程式: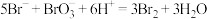 |
D. 极易挥发,所以操作Ⅰ为蒸馏 极易挥发,所以操作Ⅰ为蒸馏 |
您最近一年使用:0次
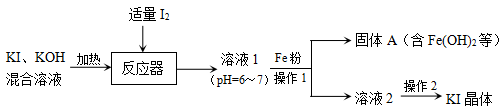
9 . KI广泛用于皮肤科、眼科等疾病的治疗,可以利用海水中获得的I2与KI、KOH的混合溶液为原料制备KI,流程如下:
ii.pH=6~7的溶液显弱酸性;
iii.KI的溶解度:
(1)溶液1中的溶质主要为KI、___________ (填化学式)。
(2)使用粉末状的铁能加快反应速率,原因是___________ 。
(3)用文字描述Fe所起的作用是___________ 。
(4)向固体A中加入稀硫酸能够制备FeSO4,该过程的离子方程式:___________ 、___________ 。
(5)操作2是___________ ,过滤,洗涤,干燥。
ii.pH=6~7的溶液显弱酸性;
iii.KI的溶解度:
| 温度/℃ | 6 | 20 | 60 | 100 |
| KI溶解度/g | 128 | 140 | 176 | 206 |
(2)使用粉末状的铁能加快反应速率,原因是
(3)用文字描述Fe所起的作用是
(4)向固体A中加入稀硫酸能够制备FeSO4,该过程的离子方程式:
(5)操作2是
您最近一年使用:0次
名校
解题方法
10 . I.汽车尾气中含有CO、NOx等有害气体。
(1)NOx能形成酸雨,氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,常见的有N2O、NO、N2O3、NO2(或N2O4)、N2O5,其中属于酸性氧化物的是___________ 。
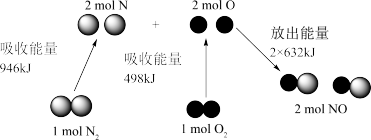
(2)汽车尾气中NO生成过程的能量变化示意图如下:___________ (填“吸热”或“放热”)___________ kJ的能量。
Ⅱ.目前工业上烟气脱硫脱硝的工艺流程如下: > 9)。
> 9)。
(3)“氧化”的目的是___________ 。图中产品中含硫成分为___________ (填化学式)。
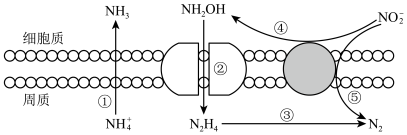
Ⅲ.海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应)。___________ 种价态。反应③和⑤中,若生成等物质的量的N2,则转移的电子数之比为___________ 。
Ⅳ.利用NaOH溶液吸收NO2,避免硝酸生产尾气中的氮氧化物对环境的破坏作用。
(5)已知用NaOH溶液吸收时会生成NaNO2和另一种盐,则吸收NO2的离子方程式为___________ 。
(1)NOx能形成酸雨,氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,常见的有N2O、NO、N2O3、NO2(或N2O4)、N2O5,其中属于酸性氧化物的是
(2)汽车尾气中NO生成过程的能量变化示意图如下:
Ⅱ.目前工业上烟气脱硫脱硝的工艺流程如下:
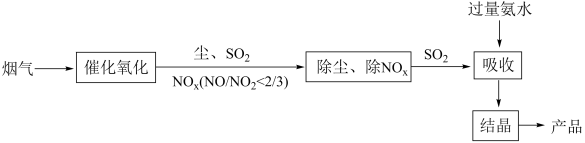
 > 9)。
> 9)。(3)“氧化”的目的是
Ⅲ.海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应)。
Ⅳ.利用NaOH溶液吸收NO2,避免硝酸生产尾气中的氮氧化物对环境的破坏作用。
(5)已知用NaOH溶液吸收时会生成NaNO2和另一种盐,则吸收NO2的离子方程式为
您最近一年使用:0次




