名校
解题方法
1 . 试回答下列问题:
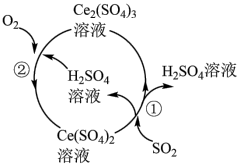
(1)化石燃料燃烧会产生大气污染物SO2、NOx等,科学家实验探究用硫酸铈循环法吸收SO2,其转化原理如图所示,反应①的离子方程式为___________ ,反应②中氧化剂与氧化产物的物质的量之比为___________ ,理论上每吸收标准状况下224mL SO2,一定消耗___________ g氧气。
(2)实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。
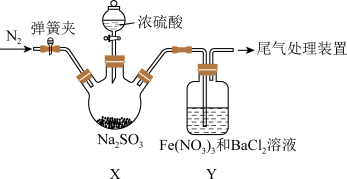
滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间 ,其目的是
,其目的是___________ ,Y中产生的白色沉淀是___________ ,若将 换成氨水,Y中产生白色沉淀
换成氨水,Y中产生白色沉淀___________ ,若将Y改为 溶液,则其化学反应方程式是
溶液,则其化学反应方程式是___________ 。
(1)化石燃料燃烧会产生大气污染物SO2、NOx等,科学家实验探究用硫酸铈循环法吸收SO2,其转化原理如图所示,反应①的离子方程式为

(2)实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。

滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间
 ,其目的是
,其目的是 换成氨水,Y中产生白色沉淀
换成氨水,Y中产生白色沉淀 溶液,则其化学反应方程式是
溶液,则其化学反应方程式是
您最近一年使用:0次
名校
解题方法
2 . 工业上常以天青石(主要成分为SrSO4,含少量BaSO4)为原料制取SrCl2·6H2O,生产流程如下:
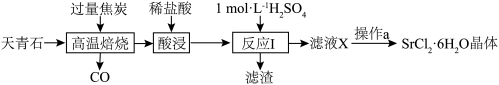
A.高温焙烧时,若0.2molSrSO4完全反应转移了1.6mol电子,该反应化学方程式为SrSO4+4C SrS+4CO↑ SrS+4CO↑ |
| B.反应Ⅰ中,应使用过量的H2SO4来提高锶元素的利用率 |
| C.为除去SrCl2·6H2O晶体表面杂质,可使用无水乙醇洗涤 |
| D.为得到无水SrCl2,可直接加热SrCl2·6H2O脱去结晶水制得 |
您最近一年使用:0次
2024-04-04更新
|
120次组卷
|
3卷引用:江苏省张家港市沙洲中学2023-2024学年高二下学期3月阶段性测试化学试题
名校
解题方法
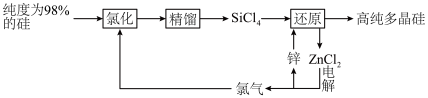
3 . 多晶硅的生产工艺方法主要是改良西门子法,该方法安全可靠,产品纯度高,但是生产成本较高.锌还原法成本低,但制备的多晶硅纯度不高,某研究所对锌还原法进行了研究改良,并成功制得了高纯多晶硅.改良后的锌还原法制备高纯多晶硅的主要流程如图,请回答下列问题: 和焦炭在
和焦炭在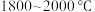 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为___________ ,该反应的氧化产物为___________ (填化学式).高纯硅常用作半导体材料,下列可用作半导体材料的是___________ (填标号).
A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成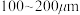 的粉末,这样做的目的是
的粉末,这样做的目的是___________ ;“精馏”可获得纯度为99.99%以上的高纯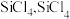 的电子式为
的电子式为___________ ;
(3)“还原”时的温度约为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;“电解”时,熔融 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于___________ (填“离子”或“共价”)化合物,“电解”反应中,每消耗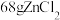 ,则生成
,则生成___________ L(换算成标准状况) 。
。
 和焦炭在
和焦炭在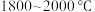 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成
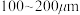 的粉末,这样做的目的是
的粉末,这样做的目的是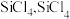 的电子式为
的电子式为(3)“还原”时的温度约为
 ,该反应的化学方程式为
,该反应的化学方程式为 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于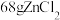 ,则生成
,则生成 。
。
您最近一年使用:0次
2024-04-04更新
|
63次组卷
|
4卷引用:广西桂林市恭城瑶族自治县民族高级中学2023-2024学年高一下学期开学考试化学试题
4 . 柠檬酸亚铁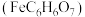 是一种高效补铁剂,实验室可通过铁粉制备,反应原理简示如下:
是一种高效补铁剂,实验室可通过铁粉制备,反应原理简示如下:
实验步骤:
①取15g铁粉,用 ,边搅拌边加热,至反应完全,过滤,以滤液制备
,边搅拌边加热,至反应完全,过滤,以滤液制备 (
(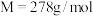 )晶体。
)晶体。
②取9g精制的 ,缓慢加入
,缓慢加入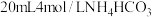 溶液,静置40min后有大量
溶液,静置40min后有大量
沉淀析出,过滤洗涤,得 晶体。
晶体。
③在烧杯中加入6g柠檬酸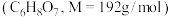 、80mL水、
、80mL水、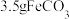 边加热边搅拌至晶体析出,过滤洗涤干燥得
边加热边搅拌至晶体析出,过滤洗涤干燥得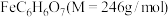 晶体。
晶体。
回答下列问题:
(1)请利用原子结构的相关知识解释三价铁比二价铁稳定原因_______ 。
(2) 溶液制备
溶液制备 晶体常用两种方法:
晶体常用两种方法:
方法ⅰ:先将滤液进行蒸发浓缩至稀糊状,可选用仪器有酒精灯、玻璃棒、_______ (从下列仪器中选择并填写名称,后一问相同要求)等,再将浓缩液冷却至室温,用_______ (仪器名称)过滤,其优点是_______ 。
方法ⅱ:将滤液冷却静置后,用玻璃棒摩擦烧杯壁,先有少量规则晶体出现,后有大量晶体 晶体出现。试回答,用玻璃棒摩擦烧杯壁的作用
晶体出现。试回答,用玻璃棒摩擦烧杯壁的作用_______ 。
(3)写出制备碳酸亚铁的离子方程式_______ 。
(4)利用邻二氮菲 与
与 生成稳定橙红色配合物
生成稳定橙红色配合物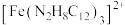 ,最大吸收波长为510nm这一特征可用来检测
,最大吸收波长为510nm这一特征可用来检测 含量,某同学将上述所制
含量,某同学将上述所制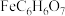 晶体全部溶解于试管中后,添加25mL3mol/L邻二氮菲溶液后,可获得最大吸收波长,则
晶体全部溶解于试管中后,添加25mL3mol/L邻二氮菲溶液后,可获得最大吸收波长,则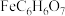 晶体质量为
晶体质量为_______ g。
(5)不用酸性高锰酸钾溶液滴定 最可能的原因是
最可能的原因是_______ 。
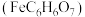 是一种高效补铁剂,实验室可通过铁粉制备,反应原理简示如下:
是一种高效补铁剂,实验室可通过铁粉制备,反应原理简示如下:
实验步骤:
①取15g铁粉,用
 ,边搅拌边加热,至反应完全,过滤,以滤液制备
,边搅拌边加热,至反应完全,过滤,以滤液制备 (
(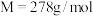 )晶体。
)晶体。②取9g精制的
 ,缓慢加入
,缓慢加入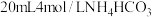 溶液,静置40min后有大量
溶液,静置40min后有大量
沉淀析出,过滤洗涤,得
 晶体。
晶体。③在烧杯中加入6g柠檬酸
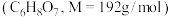 、80mL水、
、80mL水、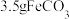 边加热边搅拌至晶体析出,过滤洗涤干燥得
边加热边搅拌至晶体析出,过滤洗涤干燥得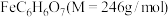 晶体。
晶体。回答下列问题:
(1)请利用原子结构的相关知识解释三价铁比二价铁稳定原因
(2)
 溶液制备
溶液制备 晶体常用两种方法:
晶体常用两种方法:方法ⅰ:先将滤液进行蒸发浓缩至稀糊状,可选用仪器有酒精灯、玻璃棒、

方法ⅱ:将滤液冷却静置后,用玻璃棒摩擦烧杯壁,先有少量规则晶体出现,后有大量晶体
 晶体出现。试回答,用玻璃棒摩擦烧杯壁的作用
晶体出现。试回答,用玻璃棒摩擦烧杯壁的作用(3)写出制备碳酸亚铁的离子方程式
(4)利用邻二氮菲
 与
与 生成稳定橙红色配合物
生成稳定橙红色配合物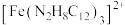 ,最大吸收波长为510nm这一特征可用来检测
,最大吸收波长为510nm这一特征可用来检测 含量,某同学将上述所制
含量,某同学将上述所制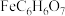 晶体全部溶解于试管中后,添加25mL3mol/L邻二氮菲溶液后,可获得最大吸收波长,则
晶体全部溶解于试管中后,添加25mL3mol/L邻二氮菲溶液后,可获得最大吸收波长,则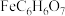 晶体质量为
晶体质量为(5)不用酸性高锰酸钾溶液滴定
 最可能的原因是
最可能的原因是
您最近一年使用:0次
解题方法
5 . 叠氮化钠( )常用作汽车安全气囊中的药剂。某化学小组在实验室制取叠氮化钠的实验装置(略去夹持仪器)如图所示。
)常用作汽车安全气囊中的药剂。某化学小组在实验室制取叠氮化钠的实验装置(略去夹持仪器)如图所示。
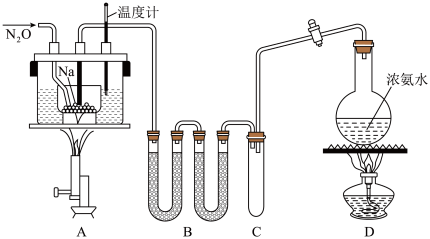
实验流程如下:
制取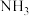 →制取
→制取 →制取
→制取 →分离提纯产品。
→分离提纯产品。
已知 是易溶于水的白色晶体,微溶于乙醇、不溶于乙醚,
是易溶于水的白色晶体,微溶于乙醇、不溶于乙醚, 熔点210℃,沸点400℃,在水溶液中易水解。下列操作及说法错误的是
熔点210℃,沸点400℃,在水溶液中易水解。下列操作及说法错误的是
 )常用作汽车安全气囊中的药剂。某化学小组在实验室制取叠氮化钠的实验装置(略去夹持仪器)如图所示。
)常用作汽车安全气囊中的药剂。某化学小组在实验室制取叠氮化钠的实验装置(略去夹持仪器)如图所示。
实验流程如下:
制取
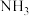 →制取
→制取 →制取
→制取 →分离提纯产品。
→分离提纯产品。已知
 是易溶于水的白色晶体,微溶于乙醇、不溶于乙醚,
是易溶于水的白色晶体,微溶于乙醇、不溶于乙醚, 熔点210℃,沸点400℃,在水溶液中易水解。下列操作及说法错误的是
熔点210℃,沸点400℃,在水溶液中易水解。下列操作及说法错误的是| A.在加热装置A中金属钠之前,需通入一段时间的氨气用于排除装置中的空气 |
B.制取 过程中需控制温度在210℃~220℃,可采用油浴加热 过程中需控制温度在210℃~220℃,可采用油浴加热 |
| C.分离提纯应先冷却产物,再向产物中加入乙醇,减压浓缩、结晶后,再过滤、洗涤、晾干 |
D.若用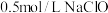 溶液将 溶液将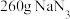 转化为无毒气体,则至少需要 转化为无毒气体,则至少需要 溶液5L 溶液5L |
您最近一年使用:0次
6 . 氮肥为粮食增产做出了重大贡献。目前,CO(NH2)2(尿素)是使用最多的氮肥之一。尿素进入土壤后,在脲酶作用下生成 和
和 。尿素的某些性质如下表所示。
。尿素的某些性质如下表所示。
1.尿素易溶于水,可能的原因是:尿素_______。
2.根据上表信息,使用尿素的注意事项是:_______ 。(写2点)
3. 与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测
与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测 的空间结构及其中心原子杂化轨道类型_______。
的空间结构及其中心原子杂化轨道类型_______。
4.简述检验溶液中存在 的实验操作。
的实验操作。_______ 。
过量使用尿素会造成水体中氨氮( 和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。
和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。
可利用生成沉淀去除水体中的氨氮。向酸性废水中加入适量Fe2(SO4)3溶液,氨氮转化为NH4Fe3(SO4)2(OH)6沉淀。

5.写出上述反应的离子方程式。_______ 。
6.氨氮去除率随溶液pH的变化如下图所示,分析氨氮去除率随pH增大,先升高后降低的原因。_______ 。

氧化可更彻底去除水体中的氨氮。向水体中加入NaClO溶液,氨氮被氧化为N2而除去。n(ClO–)/n(氨氮)对氨氮去除率和总氮去除率的影响如下图所示。

7.n(ClO–)/n(氨氮)较大时,氨氮去除率较高,但总氮去除率有所下降。n(ClO–)/n(氨氮)较大时,留在水体中的含氮微粒可能是_______。(不定项)
8.某废水中氨氮浓度为2800mg·L-1,先用Fe2(SO4)3溶液将氨氮转化为沉淀,氨氮去除率为81%。过滤后再向滤液中加入NaClO溶液,氨氮浓度下降为20mg·L-1,则处理每升废水需要NaClO物质的量_______ (写出计算过程)。
注:①氮元素只被氧化为N2;②废水1L,去除氨氮后溶液体积为2L。
 和
和 。尿素的某些性质如下表所示。
。尿素的某些性质如下表所示。| 熔点 | 沸点 | 溶解度(20℃) | 光稳定性 |
| 132.7℃ | 196.6℃ | 105g/100g水 | 见光易分解 |
1.尿素易溶于水,可能的原因是:尿素_______。
| A.是极性分子 | B.属于无机物 |
| C.能与水分子形成氢键 | D.分子间能形成氢键 |
3.
 与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测
与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测 的空间结构及其中心原子杂化轨道类型_______。
的空间结构及其中心原子杂化轨道类型_______。| A.平面三角形sp2杂化 | B.正四面体形sp3杂化 |
| C.三角锥形sp3杂化 | D.直线形sp杂化 |
 的实验操作。
的实验操作。过量使用尿素会造成水体中氨氮(
 和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。
和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。可利用生成沉淀去除水体中的氨氮。向酸性废水中加入适量Fe2(SO4)3溶液,氨氮转化为NH4Fe3(SO4)2(OH)6沉淀。

5.写出上述反应的离子方程式。
6.氨氮去除率随溶液pH的变化如下图所示,分析氨氮去除率随pH增大,先升高后降低的原因。

氧化可更彻底去除水体中的氨氮。向水体中加入NaClO溶液,氨氮被氧化为N2而除去。n(ClO–)/n(氨氮)对氨氮去除率和总氮去除率的影响如下图所示。

7.n(ClO–)/n(氨氮)较大时,氨氮去除率较高,但总氮去除率有所下降。n(ClO–)/n(氨氮)较大时,留在水体中的含氮微粒可能是_______。(不定项)
A. | B. | C.NO2 | D. |
注:①氮元素只被氧化为N2;②废水1L,去除氨氮后溶液体积为2L。
您最近一年使用:0次
7 . 硫酸除锈所产生的酸洗废液中含有较高浓度的硫酸、大量的铁(+2和+3价)和一些杂质( 、
、 等),利用硫酸酸洗废液生产硫酸亚铁的工艺流程如下图所示。下列说法不正确的是
等),利用硫酸酸洗废液生产硫酸亚铁的工艺流程如下图所示。下列说法不正确的是
 、
、 等),利用硫酸酸洗废液生产硫酸亚铁的工艺流程如下图所示。下列说法不正确的是
等),利用硫酸酸洗废液生产硫酸亚铁的工艺流程如下图所示。下列说法不正确的是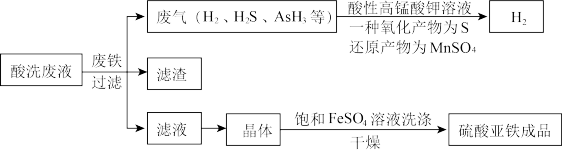
A.酸洗废液反应时,废气中的 是 是 的还原产物 的还原产物 |
B.加入废铁后,被铁还原的微粒有 、 、 、 、 和 和 等 等 |
C. 与 与 反应生成S和 反应生成S和 时,氧化剂和还原剂的物质的量之比为5:2 时,氧化剂和还原剂的物质的量之比为5:2 |
D.用饱和 溶液洗涤晶体,在除去硫酸的同时能减少硫酸亚铁晶体的溶解 溶液洗涤晶体,在除去硫酸的同时能减少硫酸亚铁晶体的溶解 |
您最近一年使用:0次
2024-04-04更新
|
346次组卷
|
4卷引用:北京市第八中学2023-2024学年高三下学期零模化学试题
北京市第八中学2023-2024学年高三下学期零模化学试题北京师范大学附属中学2023-2024学年高三下学期统练 化学试题(已下线)专题1 物质及其变化-氧化还原反应方程式的配平与计算北京市石景山区2023-2024学年高三上学期期末考试化学试卷
解题方法
8 . 以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2(SO4)3为原料制备的ZnFe2O4脱硫剂,可用于脱除煤气中的H2S。脱硫剂的制备过程可表示为
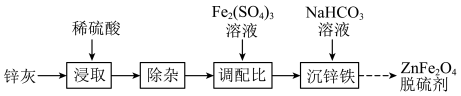
(1)“浸取”时需不断通入高温水蒸气,其目的是___________ 。
(2)“除杂”包括:向浸取后的滤液中加足量锌粉、过滤、加H2O2氧化等步骤。过滤所得滤渣的成分为(填化学式)___________ 。
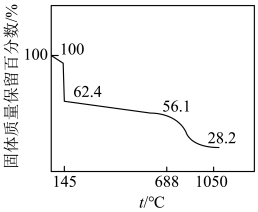
(3)ZnSO4溶液经结晶可得ZnSO4∙7H2O固体。加热该固体,固体质量保留百分数与温度的关系如图所示。温度从688℃升高到1050℃时,分解生成的产物中有两种气体(只有一种是氧化物),该过程中发生反应的化学方程式为___________ 。
(4)400℃时,将一定比例H2、H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器进行硫化。已知:硫化过程中ZnFe2O4反应后生成ZnS和FeS,该过程中发生的化学反应方程式为______________________ 。
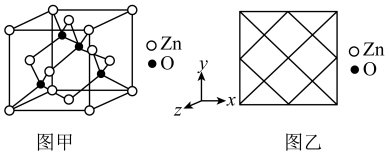
(5)①氧化锌晶体的一种晶胞是如图甲所示的立方晶胞,其中与Zn原子距离最近的O原子数目有___________ 个,请在图乙中画出该晶胞沿y轴方向的平面投影图___________ 。
②Zn2+能形成多种配离子,已知Zn2+形成的一种配离子[Zn(NH3)2(H2O)2]2+只有一种空间结构,则[Zn(NH3)4]2+的空间结构为___________ 。

(1)“浸取”时需不断通入高温水蒸气,其目的是
(2)“除杂”包括:向浸取后的滤液中加足量锌粉、过滤、加H2O2氧化等步骤。过滤所得滤渣的成分为(填化学式)
(3)ZnSO4溶液经结晶可得ZnSO4∙7H2O固体。加热该固体,固体质量保留百分数与温度的关系如图所示。温度从688℃升高到1050℃时,分解生成的产物中有两种气体(只有一种是氧化物),该过程中发生反应的化学方程式为

(4)400℃时,将一定比例H2、H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器进行硫化。已知:硫化过程中ZnFe2O4反应后生成ZnS和FeS,该过程中发生的化学反应方程式为
(5)①氧化锌晶体的一种晶胞是如图甲所示的立方晶胞,其中与Zn原子距离最近的O原子数目有

②Zn2+能形成多种配离子,已知Zn2+形成的一种配离子[Zn(NH3)2(H2O)2]2+只有一种空间结构,则[Zn(NH3)4]2+的空间结构为
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)化学与生活、生产息息相关。
① 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;
③ 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;
⑤CO可用于冶炼金属; ⑥ 可用于制硫酸;
可用于制硫酸;
⑦ 可用于制硝酸
可用于制硝酸
上述物质中,属于酸性氧化物的是______________________ (填序号)。
(2)硝酸是用途广泛的重要化工原料。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为___________ 。
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是___________ (填序号)。
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。 的沸点
的沸点___________  的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。
(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
(6)实验室中 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式_________________________ 。
(7)氰气[ ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素___________ (写元素符号)显负价。
(1)化学与生活、生产息息相关。
①
 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;③
 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;⑤CO可用于冶炼金属; ⑥
 可用于制硫酸;
可用于制硫酸;⑦
 可用于制硝酸
可用于制硝酸上述物质中,属于酸性氧化物的是
(2)硝酸是用途广泛的重要化工原料。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。
 的沸点
的沸点 的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
| A.“类钫”单质具有强氧化性 | B.“类钫”单质能与冷水剧烈反应 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 | D.“类钫”在化合物中显+1价 |
(6)实验室中
 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式(7)氰气[
 ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素
您最近一年使用:0次
10 . Ⅰ.卤素单质及其化合物在科研和工农业生产中有着广泛的应用。
(1)下列叙述错误 的是______
(2)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:

下列说法错误 的是______
(3)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。消毒效率常以单位质量的消毒剂得到的电子数表示,ClO2的消毒效率是Cl2的___________ 倍(保留2位小数)。
Ⅱ.氯气产量是衡量国家工业发展的一个重要指标。
(4)1774年,瑞典化学家舍勒发现软锰矿与浓盐酸混合加热,会产生一种令人感到窒息的黄绿色气体。请据此写出相关的化学反应方程式并标出电子转移的方向和数目___________ 。
Ⅲ.工业上采取电解饱和食盐水制备氯气。
(5)配制饱和食盐水的食盐必须精制,精制过程中需要除去Ca2+、Mg2+、 等杂质离子,先后加入的除杂试剂依次为
等杂质离子,先后加入的除杂试剂依次为___________ 。
(6)除去食盐水中少量的KNO3,实验步骤依次为:___________ 、___________ 、___________ 。
(7)①下图是电解饱和食盐水示意图,写出其化学反应方程式___________ 。
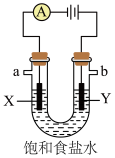
②检验Y极产物的试剂为___________ ,涉及的离子方程式为___________ 。
(1)下列叙述
| A.使用含氟牙膏能预防龋齿 | B.食盐不可作食品防腐剂 |
| C.碘酒可用于皮肤外用消毒 | D.“84”消毒液具有漂白性 |
(2)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:

下列说法
A.加入的 在还原工序中被还原 在还原工序中被还原 |
B.还原工序逸出的 可用 可用 溶液吸收 溶液吸收 |
| C.除杂工序中可用过滤操作除去产生的滤渣 |
D.中和工序中的化学反应为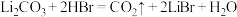 |
(3)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。消毒效率常以单位质量的消毒剂得到的电子数表示,ClO2的消毒效率是Cl2的
Ⅱ.氯气产量是衡量国家工业发展的一个重要指标。
(4)1774年,瑞典化学家舍勒发现软锰矿与浓盐酸混合加热,会产生一种令人感到窒息的黄绿色气体。请据此写出相关的化学反应方程式并标出电子转移的方向和数目
Ⅲ.工业上采取电解饱和食盐水制备氯气。
(5)配制饱和食盐水的食盐必须精制,精制过程中需要除去Ca2+、Mg2+、
 等杂质离子,先后加入的除杂试剂依次为
等杂质离子,先后加入的除杂试剂依次为(6)除去食盐水中少量的KNO3,实验步骤依次为:
(7)①下图是电解饱和食盐水示意图,写出其化学反应方程式

②检验Y极产物的试剂为
您最近一年使用:0次



