解题方法
1 . 工业上从金矿中提炼黄金可以采用氰化法,即:用NaCN稀溶液浸取粉碎的金矿石,生成溶于水的配位化合物Na[Au(CN)2],再用Zn置换出Au,产生的含氰废水经处理后排放。已知:HCN剧毒,易挥发,25℃时Ka(HCN)=4.0×10−10。
(1)配离子[Au(CN)2]−中的中心离子是___________ ,配体是___________ 。
(2)Zn位于元素周期表的第4周期第___________族。
(3)配制NaCN溶液时,将NaCN固体溶于___________溶液中,再用蒸馏水稀释。
(4)25℃时,等浓度等体积NaCN与HCN混合后溶液的pH>7,原因是___________ 。
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式___________ 。
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。
①CN−中各原子均达到8电子稳定结构,写出CN−的电子式___________ 。
②将上述离子方程式补充完整并配平。___________
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为___________ 。(NA表示阿伏加德罗常数)
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是___________ 。
(1)配离子[Au(CN)2]−中的中心离子是
(2)Zn位于元素周期表的第4周期第___________族。
| A.IIA | B.IIB | C.0 | D.12 |
| A.HCl | B.KOH | C.NaCl | D.NaOH |
(5)25℃时,H2CO3的Ka1=4.2×10−7,Ka2=4.8×10−11,将CO2通入NaCN溶液中,写出发生反应的离子方程式
(6)可用Cl2处理含CN−废水:
___________CN−+___________Cl2+___________=___________HCO
 +___________N2↑+___________Cl−+___________。
+___________N2↑+___________Cl−+___________。①CN−中各原子均达到8电子稳定结构,写出CN−的电子式
②将上述离子方程式补充完整并配平。
③若标准状况下5.6m3Cl2发生反应,转移电子的数目为
(7)酸性、碱性条件下,H2O2都能氧化废水中的CN−,但实际生产中却不选择酸性条件的可能原因是
您最近一年使用:0次
解题方法
2 . 现有一种以 为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的
为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的 和Pt进行回收。
和Pt进行回收。 不溶于硝酸。请回答下列问题:
不溶于硝酸。请回答下列问题:
(1)步骤I中将废催化剂焙烧的目的是___________ 。
(2)操作Ⅳ的名称是___________ ;检验废渣洗净的方法是___________ 。
(3)步骤Ⅲ中氧化剂是 ,反应后Pt转化成
,反应后Pt转化成 ,每生成1mol
,每生成1mol ,需要消耗H+的量为
,需要消耗H+的量为___________ mol。该步骤中有氯气生成,其离子方程式为___________ 。
(4)步骤V中,在适当酸度下,树脂上发生: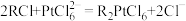 ,
, 吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用
吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用___________ (填化学式)淋洗。
(5)步骤Ⅵ中生成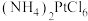 沉淀,将该沉淀在
沉淀,将该沉淀在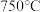 下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式___________ 。
 为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的
为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的 和Pt进行回收。
和Pt进行回收。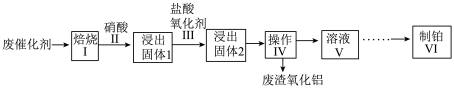
 不溶于硝酸。请回答下列问题:
不溶于硝酸。请回答下列问题:(1)步骤I中将废催化剂焙烧的目的是
(2)操作Ⅳ的名称是
(3)步骤Ⅲ中氧化剂是
 ,反应后Pt转化成
,反应后Pt转化成 ,每生成1mol
,每生成1mol ,需要消耗H+的量为
,需要消耗H+的量为(4)步骤V中,在适当酸度下,树脂上发生:
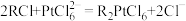 ,
, 吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用
吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用(5)步骤Ⅵ中生成
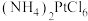 沉淀,将该沉淀在
沉淀,将该沉淀在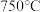 下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
您最近一年使用:0次
3 . 喹啉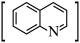 广泛用于医药、染料、农药和化学助剂等领域。在无水体系中利用Skraup反应制备喹啉的反应原理如下:
广泛用于医药、染料、农药和化学助剂等领域。在无水体系中利用Skraup反应制备喹啉的反应原理如下:
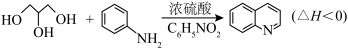
| 物质 | 分子式 | 相对分子质量 | 熔点(℃) | 沸点(℃° |
| 甘油 |  | 92 | 17.8 | 290 |
| 苯胺 | 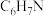 | 93 | -6.2 | 184 |
| 硝基苯 | 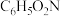 | 123 | 6 | 210 |
| 喹啉 | 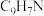 | 129 | -15.6 | 238.1 |
ⅱ.硫酸亚铁作反应的缓和剂。
实验步骤:
①预热:在250 mL三颈烧瓶中,加入2.0 g
 晶体和19 g无水甘油,控制温度在180℃左右,加热5 min。
晶体和19 g无水甘油,控制温度在180℃左右,加热5 min。②加料:待自然降温至100℃左右,依次加入4.65 g苯胺,4 g硝基苯和9 mL浓硫酸。
③制备:先用小火加热装置A,当反应液微沸时先立即移去加热装置,保持微沸继续反应,后小火回流2 h。
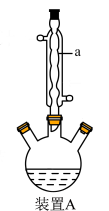
⑤蒸出:将溶液转移至圆底烧瓶,滴加40%NaOH溶液至强碱性,再用水蒸气蒸出。
⑥提纯:将粗品经分离、提纯、干燥后得到产品4.3g。
请回答下列问题:
(1)仪器a的名称是
(2)步骤③中,移去加热装置后若反应液继续沸腾,可采取的方法是
(3)用离子方程式表示步骤④中淀粉-KI试纸变蓝的原因:
(4)已知
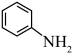 与
与 在酸性条件下反应生成重氮盐,加热煮沸时水解产生
在酸性条件下反应生成重氮盐,加热煮沸时水解产生 和苯酚。
和苯酚。步骤⑤中加入40%NaOH溶液的作用有:①
(5)检验步骤⑤中苯酚是否除尽的实验操作是
(6)计算该实验中喹啉的产率:
您最近一年使用:0次
2024-06-07更新
|
73次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
4 . 已知: 在水中的溶解度随着温度的升高而增大。某兴趣小组按以下方法制备
在水中的溶解度随着温度的升高而增大。某兴趣小组按以下方法制备 。
。
Ⅰ.在100mL锥形瓶内加入4.5g研细的 、3g
、3g  和5mL水,加热溶解后加入0.3g活性炭作催化剂。
和5mL水,加热溶解后加入0.3g活性炭作催化剂。
Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下,并缓慢加入10mL 溶液。
溶液。
Ⅲ.在60℃下反应一段时间后,再经过一系列操作,得到 晶体。
晶体。
下列说法不正确的是
 在水中的溶解度随着温度的升高而增大。某兴趣小组按以下方法制备
在水中的溶解度随着温度的升高而增大。某兴趣小组按以下方法制备 。
。Ⅰ.在100mL锥形瓶内加入4.5g研细的
 、3g
、3g  和5mL水,加热溶解后加入0.3g活性炭作催化剂。
和5mL水,加热溶解后加入0.3g活性炭作催化剂。Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下,并缓慢加入10mL
 溶液。
溶液。Ⅲ.在60℃下反应一段时间后,再经过一系列操作,得到
 晶体。
晶体。下列说法不正确的是
A.步骤Ⅰ中加入 的原因之一是增大 的原因之一是增大 的浓度,以抑制步骤Ⅱ中 的浓度,以抑制步骤Ⅱ中 的电离 的电离 |
B.步骤Ⅱ控制温度在10℃以下的主要原因是防止 和 和 受热分解 受热分解 |
| C.步骤Ⅲ中一系列的操作包括蒸发浓缩、降温结晶、过滤、洗涤、干燥 |
D.该反应化学方程式为 |
您最近一年使用:0次
解题方法
5 . 碲广泛用于半导体器件、合金、化工原料及铸铁、橡胶、玻璃等工业。工业上利用电解铜的阳极泥(主要成分为 、
、 ,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。
,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。 是一种两性氧化物,微溶于水,易溶于强酸和强碱。
是一种两性氧化物,微溶于水,易溶于强酸和强碱。
② 为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为
为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为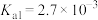 ,
,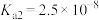 。
。
回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率,可采取的措施为_______ (写一种即可);流程中多次用到过滤操作,实验室进行过滤时需要用到的玻璃仪器有烧杯、_______ 。
(2)“氧化焙烧”后碲元素转化为 ,写出
,写出 反应的化学方程式:
反应的化学方程式:_______ 。
(3)“水浸”后,“滤液”中溶质的主要成分为_______ (填化学式)。
(4)“酸化”后,碲以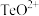 形式存在,则“还原”过程中反应的离子方程式为
形式存在,则“还原”过程中反应的离子方程式为_______ 。
(5)室温下,用水吸收二氧化硒,得到溶液的pH=2,此时溶液中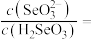
_______ 。
(6)近年,碲化镉太阳能发电玻璃在我国发展迅猛,被誉为“墙壁上的油田”,碲化镉立方晶胞结构如图乙所示。碲化镉的化学式为_______ ,Cd原子周围等距离且最近的Te原子为_______ 个,测得碲化镉晶体的密度为 ,设
,设 为阿伏加德罗常数的值,则晶胞边长为
为阿伏加德罗常数的值,则晶胞边长为_______ pm。
 、
、 ,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。
,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。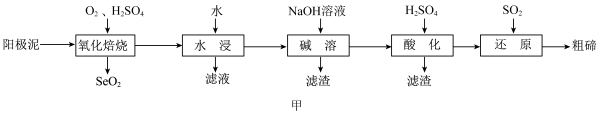
 是一种两性氧化物,微溶于水,易溶于强酸和强碱。
是一种两性氧化物,微溶于水,易溶于强酸和强碱。②
 为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为
为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为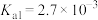 ,
,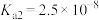 。
。回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率,可采取的措施为
(2)“氧化焙烧”后碲元素转化为
 ,写出
,写出 反应的化学方程式:
反应的化学方程式:(3)“水浸”后,“滤液”中溶质的主要成分为
(4)“酸化”后,碲以
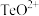 形式存在,则“还原”过程中反应的离子方程式为
形式存在,则“还原”过程中反应的离子方程式为(5)室温下,用水吸收二氧化硒,得到溶液的pH=2,此时溶液中
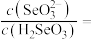
(6)近年,碲化镉太阳能发电玻璃在我国发展迅猛,被誉为“墙壁上的油田”,碲化镉立方晶胞结构如图乙所示。碲化镉的化学式为
 ,设
,设 为阿伏加德罗常数的值,则晶胞边长为
为阿伏加德罗常数的值,则晶胞边长为
您最近一年使用:0次
2024-06-07更新
|
55次组卷
|
3卷引用:2024届河南省重点高中高三下学期4月联考模拟预测理综试题-高中化学
名校
6 .  是一种重要的化工原料,可用于制化肥、农药,炸药、染料等.工业制硝酸的流程如图所示.下列说法错误的是
是一种重要的化工原料,可用于制化肥、农药,炸药、染料等.工业制硝酸的流程如图所示.下列说法错误的是
 是一种重要的化工原料,可用于制化肥、农药,炸药、染料等.工业制硝酸的流程如图所示.下列说法错误的是
是一种重要的化工原料,可用于制化肥、农药,炸药、染料等.工业制硝酸的流程如图所示.下列说法错误的是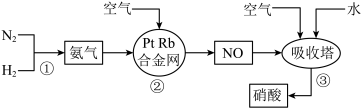
| A.反应①②③均属于氧化还原反应 |
B.若有 完全转化为 完全转化为 ,理论上共需要消耗 ,理论上共需要消耗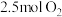 |
C.吸收塔内反应的化学方程式为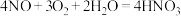 |
D.浓硝酸在光照下会逐渐变黄,原因是浓硝酸光照时分解生成了 |
您最近一年使用:0次
2024-06-07更新
|
146次组卷
|
2卷引用:甘肃省白银市2023-2024学年高一下学期期中考试化学试题
名校
解题方法
7 . 氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)三氟化氮( )气体是一种新型电子材料。其中N元素的化合价为
)气体是一种新型电子材料。其中N元素的化合价为______ ,它在潮湿的空气中与水蒸气能发生反应生成HF、NO和HNO。反应过程中,被氧化与被还原的元素的质量之比为______ 。
(2)联氨( )是一种常用的强还原剂。可用以下方法制得(装置如右图):NaClO碱性溶液与尿素[化学式为
)是一种常用的强还原剂。可用以下方法制得(装置如右图):NaClO碱性溶液与尿素[化学式为 ,沸点196.6℃]水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。滴液漏斗内的试剂是
,沸点196.6℃]水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。滴液漏斗内的试剂是______ ;制备联氨的离子方程式为______ 。 与澄清石灰水混合,溶液体积为2L,半分钟后的
与澄清石灰水混合,溶液体积为2L,半分钟后的 的物质的量减少了0.2mol,
的物质的量减少了0.2mol,
______ 。
(4)已知: 分子中的键能为a kJ/mol;
分子中的键能为a kJ/mol; 分子中
分子中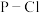 键能为b kJ/mol;1mol
键能为b kJ/mol;1mol 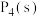 转化为气态P原子吸收能量c kJ。写出
转化为气态P原子吸收能量c kJ。写出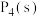 与
与 反应生成
反应生成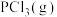 的热化学方程式:
的热化学方程式:______ 。
(1)三氟化氮(
 )气体是一种新型电子材料。其中N元素的化合价为
)气体是一种新型电子材料。其中N元素的化合价为(2)联氨(
 )是一种常用的强还原剂。可用以下方法制得(装置如右图):NaClO碱性溶液与尿素[化学式为
)是一种常用的强还原剂。可用以下方法制得(装置如右图):NaClO碱性溶液与尿素[化学式为 ,沸点196.6℃]水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。滴液漏斗内的试剂是
,沸点196.6℃]水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。滴液漏斗内的试剂是
 与澄清石灰水混合,溶液体积为2L,半分钟后的
与澄清石灰水混合,溶液体积为2L,半分钟后的 的物质的量减少了0.2mol,
的物质的量减少了0.2mol,
(4)已知:
 分子中的键能为a kJ/mol;
分子中的键能为a kJ/mol; 分子中
分子中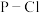 键能为b kJ/mol;1mol
键能为b kJ/mol;1mol 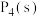 转化为气态P原子吸收能量c kJ。写出
转化为气态P原子吸收能量c kJ。写出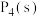 与
与 反应生成
反应生成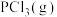 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
名校
解题方法
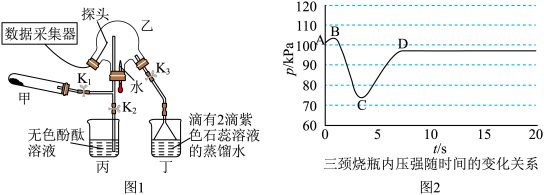
8 . 某化学兴趣小组利用图1装置(加热和夹持装置已省略)制备氨气并进行喷泉实验.
i.氨气的制备:打开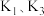 ,关闭
,关闭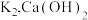 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.
ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备 ,关闭
,关闭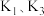 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
请回答下列问题:___________________ ;丁处倒置漏斗的作用是______________ ;氨水中含有的分子有 、
、______________ .
(2)C→D过程中,三颈烧瓶中的现象为_____________ ; 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为_____________ .
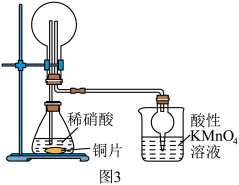
(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.__________________________ .
②烧杯中发生反应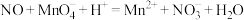 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为__________ (填化学式),氧化产物和还原产物的物质的量之比为__________ (填最简整数比).
i.氨气的制备:打开
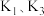 ,关闭
,关闭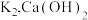 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备
 ,关闭
,关闭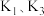 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.请回答下列问题:
 、
、(2)C→D过程中,三颈烧瓶中的现象为
 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.
②烧杯中发生反应
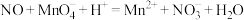 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为
您最近一年使用:0次
2024-06-06更新
|
110次组卷
|
3卷引用:甘肃省白银市2023-2024学年高一下学期期中考试化学试题
9 . 化学小组实验探究 与
与 悬浊液的反应。
悬浊液的反应。
资料:i. (无色),
(无色), 易被氧气氧化为
易被氧气氧化为 。
。
ii. 很不稳定,易转化为
很不稳定,易转化为 。
。
iii. 在酸性溶液中易转化为
在酸性溶液中易转化为 、
、 。
。
实验一:I.向 溶液中加入浓
溶液中加入浓 溶液,制得
溶液,制得 悬浊液,测得
悬浊液,测得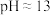 。
。
Ⅱ.向 悬浊液中通入
悬浊液中通入 产生大量白色沉淀A,测得
产生大量白色沉淀A,测得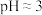 。
。
(1)产生 的离子方程式是
的离子方程式是___________ 。
(2)推测白色沉淀A中可能含有 、
、 、
、 、
、 、
、 。为检验白色沉淀成分,进行实验二:
。为检验白色沉淀成分,进行实验二:
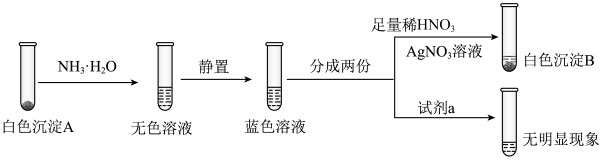
实验二:将实验一中所得的白色沉淀A过滤、洗涤,并进行如下实验。 、
、 ,试剂a为
,试剂a为___________ 。
②根据上述实验推测白色沉淀A为 ,推测依据是
,推测依据是___________ 。
③产生白色沉淀A的离子方程式是___________ 。
④实验二中无色溶液变为蓝色溶液的离子方程式为___________ 。
(3)为排除实验一溶液中 的影响,小组同学进行了实验三
的影响,小组同学进行了实验三
实验三:
I.向 溶液中加入浓
溶液中加入浓 溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的
溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的 固体加水得悬浊液,测得
固体加水得悬浊液,测得 。
。
Ⅱ.向悬浊液中通入SO2至过量,观察到局部先产生少量浅黄色沉淀,而后转化为紫红色固体,溶液变为绿色[含 ],测得溶液
],测得溶液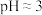 。
。
Ⅲ.向 溶液中通入
溶液中通入 至过量,无明显现象。
至过量,无明显现象。
①补全步骤I中的操作和现象___________ 。
②经确认浅黄色沉淀为 ,紫红色固体为
,紫红色固体为 。
。 与
与 悬浊液发生了氧化还原反应。结合化学用语解释产生
悬浊液发生了氧化还原反应。结合化学用语解释产生 的原因
的原因___________ 。
③解释实验三中步骤Ⅲ与步骤Ⅱ现象不同的原因___________ 。
(4)综合上述实验, 与二价铜反应的产物与
与二价铜反应的产物与___________ 等因素有关(答出两点即可)。
 与
与 悬浊液的反应。
悬浊液的反应。资料:i.
 (无色),
(无色), 易被氧气氧化为
易被氧气氧化为 。
。ii.
 很不稳定,易转化为
很不稳定,易转化为 。
。iii.
 在酸性溶液中易转化为
在酸性溶液中易转化为 、
、 。
。实验一:I.向
 溶液中加入浓
溶液中加入浓 溶液,制得
溶液,制得 悬浊液,测得
悬浊液,测得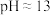 。
。Ⅱ.向
 悬浊液中通入
悬浊液中通入 产生大量白色沉淀A,测得
产生大量白色沉淀A,测得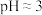 。
。(1)产生
 的离子方程式是
的离子方程式是(2)推测白色沉淀A中可能含有
 、
、 、
、 、
、 、
、 。为检验白色沉淀成分,进行实验二:
。为检验白色沉淀成分,进行实验二:实验二:将实验一中所得的白色沉淀A过滤、洗涤,并进行如下实验。
 、
、 ,试剂a为
,试剂a为②根据上述实验推测白色沉淀A为
 ,推测依据是
,推测依据是③产生白色沉淀A的离子方程式是
④实验二中无色溶液变为蓝色溶液的离子方程式为
(3)为排除实验一溶液中
 的影响,小组同学进行了实验三
的影响,小组同学进行了实验三实验三:
I.向
 溶液中加入浓
溶液中加入浓 溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的
溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的 固体加水得悬浊液,测得
固体加水得悬浊液,测得 。
。Ⅱ.向悬浊液中通入SO2至过量,观察到局部先产生少量浅黄色沉淀,而后转化为紫红色固体,溶液变为绿色[含
 ],测得溶液
],测得溶液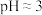 。
。Ⅲ.向
 溶液中通入
溶液中通入 至过量,无明显现象。
至过量,无明显现象。①补全步骤I中的操作和现象
②经确认浅黄色沉淀为
 ,紫红色固体为
,紫红色固体为 。
。 与
与 悬浊液发生了氧化还原反应。结合化学用语解释产生
悬浊液发生了氧化还原反应。结合化学用语解释产生 的原因
的原因③解释实验三中步骤Ⅲ与步骤Ⅱ现象不同的原因
(4)综合上述实验,
 与二价铜反应的产物与
与二价铜反应的产物与
您最近一年使用:0次
2024-06-06更新
|
70次组卷
|
2卷引用:北京市海淀区第一零一中学2023-2024学年高三下学期三模化学试题
名校
解题方法
10 . 选择性还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
已知:ⅰ. 在164℃以上时可加速分解成
在164℃以上时可加速分解成 ;
;
ⅱ.当NO与 的物质的量相同时,会发生快速反应:
的物质的量相同时,会发生快速反应:
(1)钒基催化剂(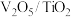 )可用于
)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。___________ 。
②若烟气中含有硫的氧化物,则会降低 的反应速率,可能的原因是
的反应速率,可能的原因是___________ 。
(2)臭氧对 反应具有一定的辅助作用:
反应具有一定的辅助作用: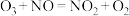 。在不同温度下,经相同时间后测得不同
。在不同温度下,经相同时间后测得不同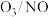 投料比时NO的脱除率如图所示。
投料比时NO的脱除率如图所示。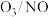 投料比为0.5时,NO脱除率较高的原因是
投料比为0.5时,NO脱除率较高的原因是___________ 。
②350℃后,NO脱除率均有不同程度下降,可能的原因是___________ (答出两点)。
(3)以电化学结合 氧化法除去烟气中的
氧化法除去烟气中的 和
和 ,装置如图所示。
,装置如图所示。 ,则经过质子交换膜的
,则经过质子交换膜的 为
为___________ mol。
②从资源利用角度说明结合电解法与 氧化法的优点
氧化法的优点___________ 。
 )。
)。已知:ⅰ.
 在164℃以上时可加速分解成
在164℃以上时可加速分解成 ;
;ⅱ.当NO与
 的物质的量相同时,会发生快速反应:
的物质的量相同时,会发生快速反应:
(1)钒基催化剂(
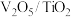 )可用于
)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。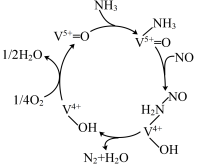
②若烟气中含有硫的氧化物,则会降低
 的反应速率,可能的原因是
的反应速率,可能的原因是(2)臭氧对
 反应具有一定的辅助作用:
反应具有一定的辅助作用: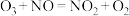 。在不同温度下,经相同时间后测得不同
。在不同温度下,经相同时间后测得不同 投料比时NO的脱除率如图所示。
投料比时NO的脱除率如图所示。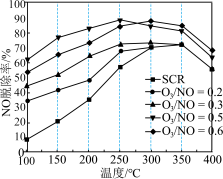
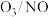 投料比为0.5时,NO脱除率较高的原因是
投料比为0.5时,NO脱除率较高的原因是②350℃后,NO脱除率均有不同程度下降,可能的原因是
(3)以电化学结合
 氧化法除去烟气中的
氧化法除去烟气中的 和
和 ,装置如图所示。
,装置如图所示。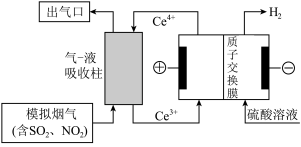
 ,则经过质子交换膜的
,则经过质子交换膜的 为
为②从资源利用角度说明结合电解法与
 氧化法的优点
氧化法的优点
您最近一年使用:0次



