1 . 现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-的物质的量为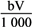 mol
mol
③反应过程中转移的电子的物质的量为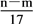 mol
mol
④生成NO气体的体积在标准状况下为 L
L
⑤与合金反应的硝酸的物质的量为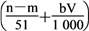 mol
mol
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-的物质的量为
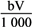 mol
mol③反应过程中转移的电子的物质的量为
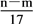 mol
mol④生成NO气体的体积在标准状况下为
 L
L⑤与合金反应的硝酸的物质的量为
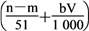 mol
mol| A.5项 | B.4项 | C.3项 | D.2项 |
您最近一年使用:0次
名校
2 . 向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是
A.当0<b<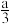 时:SO2+H2O+3ClO-= 时:SO2+H2O+3ClO-= +2HClO+Cl- +2HClO+Cl- |
B.当b=a时:SO2+H2O+ClO-= +2H++Cl- +2H++Cl- |
C.当 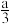 <b<a时;反应后溶液中H+的物质的量:0<n(H+)<2bmol <b<a时;反应后溶液中H+的物质的量:0<n(H+)<2bmol |
D.当0<b<a时;反应后溶液中Cl-、ClO-和 物质的量之比为:(a-b):b:b 物质的量之比为:(a-b):b:b |
您最近一年使用:0次
2017-05-27更新
|
699次组卷
|
4卷引用:辽宁省沈阳市2017届高三第三次模拟考试理综化学试题
解题方法
3 . 一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)nC16-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
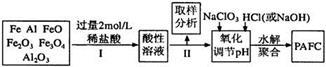
请回答下列问题:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有_________ 。
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)下列关于PAFC的说法中正确的有( )
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水电离出OH—,是碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是( )
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式为______________________ 。
(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有_______________ 。
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6)在测定过程中的操作顺序是: 过滤、___________ 、灼烧、_________ 、称量。(写操作名称)。
(7)测定时,直接称量的是____________ 和_____________ 的质量(填化学式)。

请回答下列问题:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)下列关于PAFC的说法中正确的有
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水电离出OH—,是碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式为
(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6)在测定过程中的操作顺序是: 过滤、
(7)测定时,直接称量的是
您最近一年使用:0次
名校
解题方法
4 . 现有两种金属组成的混合物,把5.6g 该混合物加入到100g一定溶质质量分数的稀硫酸中,恰好完全反应,产生氢气物质的量为w。则下列说法中正确的是
| A.若混合物为Zn、Al,w不可能是0.1 mol |
| B.若混合物为Zn、Fe,w可能大于0.1 mol |
| C.若混合物为Fe、Mg,则加入的稀硫酸中溶质质量分数等于9.8% |
| D.若混合物为Cu、Fe,w是0.05mol,则混合物中Fe与Cu的质量比为1:1 |
您最近一年使用:0次
2016-12-09更新
|
722次组卷
|
3卷引用:2015-2016学年四川省南充高级中学高一上期末化学试卷
名校
解题方法
5 . 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是
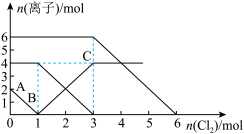

| A.离子的还原性顺序为:Fe2+>Br->I- |
| B.原混合溶液中FeBr2的物质的量为4mol |
| C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
| D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
您最近一年使用:0次
2016-12-09更新
|
1854次组卷
|
7卷引用:2016届河南省西华县第一高级中学高三上学期10月联考化学试卷
解题方法
6 . 某废水中含有 和
和 等离子,需经污水处理达标后才能排放,污水处理拟采用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理拟采用下列流程进行处理:

回答下列问题:
(1)步骤②中, 被
被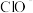 氧化为
氧化为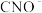 的离子方程式为
的离子方程式为________________ 。
(2)步骤③的反应的离子方程式为 (未配平),每消耗0.4mol
(未配平),每消耗0.4mol  时,反应中
时,反应中 失去
失去_________ mol电子。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是________________ 。
(4)在25℃下,将amol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示 的水解常数Kh=
的水解常数Kh=_______ mol·L-1。若25℃时将浓度均为0.1mol·L-1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是_______ (填代号)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)利用 测定某SnCl2的纯度(杂质不参与反应,溶液中Sn4+较为稳定):将
测定某SnCl2的纯度(杂质不参与反应,溶液中Sn4+较为稳定):将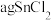 样品制成溶液的操作为
样品制成溶液的操作为________________ ,向得到的SnCl2溶液中加入过量的FeCl3溶液,用bmol·L-l 滴定生成的Fe2+(已知酸性环境下,
滴定生成的Fe2+(已知酸性环境下, 可被还原为Cr3+),共用去
可被还原为Cr3+),共用去 溶液xmL.则样品中SnCl2的的质量分数是
溶液xmL.则样品中SnCl2的的质量分数是_________ 。(SnCl2的摩尔质量为M g·mol-1,用含a、b、x、M的代数式表示)
 和
和 等离子,需经污水处理达标后才能排放,污水处理拟采用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理拟采用下列流程进行处理:
回答下列问题:
(1)步骤②中,
 被
被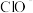 氧化为
氧化为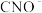 的离子方程式为
的离子方程式为(2)步骤③的反应的离子方程式为
 (未配平),每消耗0.4mol
(未配平),每消耗0.4mol  时,反应中
时,反应中 失去
失去(3)含Cr3+废水可以加入熟石灰进一步处理,目的是
(4)在25℃下,将amol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示
 的水解常数Kh=
的水解常数Kh=a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)利用
 测定某SnCl2的纯度(杂质不参与反应,溶液中Sn4+较为稳定):将
测定某SnCl2的纯度(杂质不参与反应,溶液中Sn4+较为稳定):将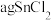 样品制成溶液的操作为
样品制成溶液的操作为 滴定生成的Fe2+(已知酸性环境下,
滴定生成的Fe2+(已知酸性环境下, 可被还原为Cr3+),共用去
可被还原为Cr3+),共用去 溶液xmL.则样品中SnCl2的的质量分数是
溶液xmL.则样品中SnCl2的的质量分数是
您最近一年使用:0次
名校
7 . 将一定量的Cl2通入体积为40mL、浓度为7.5mol/L的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,下列说法不正确的是
| A.该反应的离子方程式为:5Cl2+10OH-=7Cl-+2ClO-+ClO3—+5H2O |
| B.该反应中,氧化剂与还原剂物质的量之比为5:3 |
| C.上述苛性钾溶液中含有0.3mol的KOH |
| D.反应后生成的ClO-和ClO3-两种离子在一定条件下均有氧化性 |
您最近一年使用:0次
2016-12-09更新
|
2582次组卷
|
5卷引用:2015-2016学年江苏省南通中学高一上学期期末化学试卷
8 . 现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为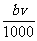 mol
mol
③反应过程中转移的电子数为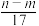 mol
mol
④生成标准状况下NO气体的体积为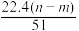 L
L
⑤与合金反应反应的硝酸的物质的量为(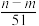 +
+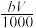 )mol
)mol
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为
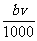 mol
mol③反应过程中转移的电子数为
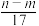 mol
mol ④生成标准状况下NO气体的体积为
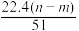 L
L⑤与合金反应反应的硝酸的物质的量为(
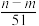 +
+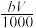 )mol
)mol| A.2项 | B.3项 | C.4项 | D.5项 |
您最近一年使用:0次
名校
9 . 在一定浓度的浓硝酸中加入m克铜镁合金恰好完全溶解(假定硝酸的还原产物只有NO2),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,恰好完全反应,得到沉淀质量为n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n−m)克 ②恰好溶解后溶液中 的物质的量为bV mol
的物质的量为bV mol
③反应过程中转移的电子数为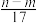 mol ④生成NO2气体的体积为
mol ④生成NO2气体的体积为 L
L
⑤与合金反应的硝酸的物质的量为 mol
mol
①沉淀中氢氧根的质量为(n−m)克 ②恰好溶解后溶液中
 的物质的量为bV mol
的物质的量为bV mol③反应过程中转移的电子数为
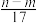 mol ④生成NO2气体的体积为
mol ④生成NO2气体的体积为 L
L⑤与合金反应的硝酸的物质的量为
 mol
mol| A.①②③④⑤ | B.①③④⑤ |
| C.①③⑤ | D.①②③⑤ |
您最近一年使用:0次
2016-12-09更新
|
2382次组卷
|
4卷引用:2016届山东省济宁市第一中学高三上学期期中考试化学试卷
2016届山东省济宁市第一中学高三上学期期中考试化学试卷(已下线)《2018,我的高考我的教师君》-【考前基础篇】高考化学必会知识大盘点江西师范大学附属中学2020-2021学年高一下学期4月月考化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题
解题方法
10 . 硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂.某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
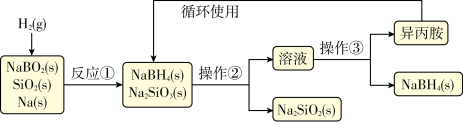
下列说法不正确的是( )

下列说法不正确的是( )
| A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀 |
| B.操作②、操作③分别是过滤与蒸发结晶 |
| C.反应①加料之前需将反应器加热至100℃以上并通入氩气 |
| D.反应①中氧化剂与还原剂的物质的量之比为1:2 |
您最近一年使用:0次
2016-07-12更新
|
1213次组卷
|
7卷引用:2016届浙江省金丽衢十二校高三第二次联考理综化学试卷



