解题方法
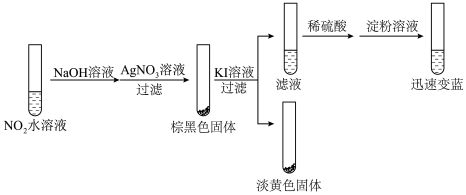
1 . 小组同学用淀粉碘化钾试纸检验 气体,过程如下。
气体,过程如下。
(1)对Ⅰ中试纸迅速变蓝的原因作出如下假设。
①假设a: 中N的化合价为
中N的化合价为___________ ,在水的作用下将KI氧化。
②假设b: 与水反应
与水反应___________ (用化学方程式表示),产生的 氧化KI。
氧化KI。
③假设c:空气中存在 ,在酸性条件下氧化KI,离子方程式为
,在酸性条件下氧化KI,离子方程式为___________ 。
(2)探究假设b、c是否成立。
实验Ⅳ:将___________ (填试剂)滴在淀粉碘化钾试纸上,试纸无明显变化。
得出结论:假设b、c不是Ⅰ中试纸迅速变蓝的主要原因。
(3)探究假设a是否成立。
资料:ⅰ. 与水反应生成
与水反应生成 ,
, 有强氧化性。
有强氧化性。
ⅱ. (淡黄色)微溶于水,AgI(黄色)、
(淡黄色)微溶于水,AgI(黄色)、 (棕黑色)难溶于水。
(棕黑色)难溶于水。
实验Ⅴ: 与水反应生成
与水反应生成 的证据是
的证据是___________ 。
②写出 与水反应生成
与水反应生成 的化学方程式:
的化学方程式:___________ 。
小组同学认为Ⅰ中试纸迅速变蓝的可能原因有: 与水反应生成的
与水反应生成的 迅速氧化KI;水作溶剂增大
迅速氧化KI;水作溶剂增大 氧化KI的速率。
氧化KI的速率。
(4)结合乙醇的性质,分析Ⅲ中试纸迅速 变黄(经检测含有 )的可能原因:
)的可能原因:___________ 。
 气体,过程如下。
气体,过程如下。| 实验操作 | 实验现象 | |
| 实验Ⅰ | 将用水润湿的淀粉碘化钾试纸靠近 气体 气体 | 试纸迅速变蓝 |
| 实验Ⅱ | 将干燥的淀粉碘化钾试纸靠近 气体 气体 | 试纸无明显变化,较长时间后稍变蓝 |
| 实验Ⅲ | 将用乙醇润湿的淀粉碘化钾试纸靠近 气体 气体 | 试纸迅速变黄 |
(1)对Ⅰ中试纸迅速变蓝的原因作出如下假设。
①假设a:
 中N的化合价为
中N的化合价为②假设b:
 与水反应
与水反应 氧化KI。
氧化KI。③假设c:空气中存在
 ,在酸性条件下氧化KI,离子方程式为
,在酸性条件下氧化KI,离子方程式为(2)探究假设b、c是否成立。
实验Ⅳ:将
得出结论:假设b、c不是Ⅰ中试纸迅速变蓝的主要原因。
(3)探究假设a是否成立。
资料:ⅰ.
 与水反应生成
与水反应生成 ,
, 有强氧化性。
有强氧化性。ⅱ.
 (淡黄色)微溶于水,AgI(黄色)、
(淡黄色)微溶于水,AgI(黄色)、 (棕黑色)难溶于水。
(棕黑色)难溶于水。实验Ⅴ:
 与水反应生成
与水反应生成 的证据是
的证据是②写出
 与水反应生成
与水反应生成 的化学方程式:
的化学方程式:小组同学认为Ⅰ中试纸迅速变蓝的可能原因有:
 与水反应生成的
与水反应生成的 迅速氧化KI;水作溶剂增大
迅速氧化KI;水作溶剂增大 氧化KI的速率。
氧化KI的速率。(4)结合乙醇的性质,分析Ⅲ中试纸
 )的可能原因:
)的可能原因:
您最近一年使用:0次
2024高三·江苏·专题练习
2 . 回答下列问题:
(1)Al-空气电池具有较高的比能量,在碱性电解液中总反应为4Al+3O2+6H2O+4OH-=4[Al(OH)4] -; 则该Al-空气电池的负极反应式为_______ 。
(2)水体中的过量的硝态氮(主要以 的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。相同条件下,向含有50 mg/L
的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。相同条件下,向含有50 mg/L  的两份水样中分别加入纳米铁粉、纳米铁粉 -活性炭 -铜粉,水样中
的两份水样中分别加入纳米铁粉、纳米铁粉 -活性炭 -铜粉,水样中 的去除速率差异如图所示,产生该差异的可能原因有
的去除速率差异如图所示,产生该差异的可能原因有_______ 。_______ 。_______ 。
②理论上1 mol H2S参加反应可产生H2的物质的量为_______ 。
(1)Al-空气电池具有较高的比能量,在碱性电解液中总反应为4Al+3O2+6H2O+4OH-=4[Al(OH)4] -; 则该Al-空气电池的负极反应式为
(2)水体中的过量的硝态氮(主要以
 的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。相同条件下,向含有50 mg/L
的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。相同条件下,向含有50 mg/L  的两份水样中分别加入纳米铁粉、纳米铁粉 -活性炭 -铜粉,水样中
的两份水样中分别加入纳米铁粉、纳米铁粉 -活性炭 -铜粉,水样中 的去除速率差异如图所示,产生该差异的可能原因有
的去除速率差异如图所示,产生该差异的可能原因有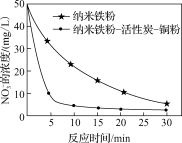
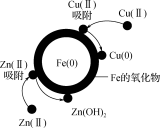
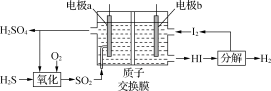
②理论上1 mol H2S参加反应可产生H2的物质的量为
您最近一年使用:0次
名校
解题方法
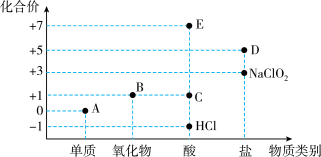
3 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。_____ 。
(2)纯净的 在A中燃烧的现象为
在A中燃烧的现象为_____ ,体现了 的
的_____ (填“氧化性”或“还原性”)。
(3)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为_____ 。
(4)某同学利用①FeO、② 、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与
、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与_____ (填序号)发生反应;从化合价角度看,盐酸中 具有
具有_____ 性,可能与_____ (填序号)发生反应。
(5)已知A与氢氧化钠溶液反应生成NaCl、NaClO和 的混合物,若
的混合物,若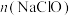 与
与 之比为2∶3,则氧化剂与还原剂的物质的量之比为
之比为2∶3,则氧化剂与还原剂的物质的量之比为_____ 。
(6)将 通入冷的石灰乳【
通入冷的石灰乳【 】中制得漂白粉,该反应的化学方程式为
】中制得漂白粉,该反应的化学方程式为_____ 。
(2)纯净的
 在A中燃烧的现象为
在A中燃烧的现象为 的
的(3)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为
(4)某同学利用①FeO、②
 、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与
、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与 具有
具有(5)已知A与氢氧化钠溶液反应生成NaCl、NaClO和
 的混合物,若
的混合物,若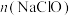 与
与 之比为2∶3,则氧化剂与还原剂的物质的量之比为
之比为2∶3,则氧化剂与还原剂的物质的量之比为(6)将
 通入冷的石灰乳【
通入冷的石灰乳【 】中制得漂白粉,该反应的化学方程式为
】中制得漂白粉,该反应的化学方程式为
您最近一年使用:0次
4 . 1000多年前我国就利用“细菌氧化”法将铜矿石中的硫化物转化为硫酸盐,并用形成的天然“胆水”来冶炼铜。现代采用电解精炼铜会产生阳极泥,其中含有铜、金、银等金属单质。某科研小组设计提纯金和银的工艺流程如下: 反应生成
反应生成 。
。
(1)“胆水”的主要溶质是___________ ;浸出液1含有的金属离子主要是___________ 。
(2)下列说法正确的是___________。
(3)浸取1中相关反应的化学方程式是___________ 。
(4)“细菌氧化”时, 发生反应的离子方程式是
发生反应的离子方程式是___________ ,设计实验检验反应产物中的离子:___________ 。
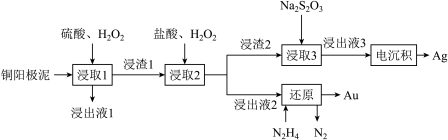
 反应生成
反应生成 。
。(1)“胆水”的主要溶质是
(2)下列说法正确的是___________。
| A.浸渣1的主要成分是金和银,浸渣2的主要成分是银 |
B.电沉积阴极反应式是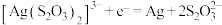 |
C.浸取2中盐酸有利于Au转化为 ,Ag转化为AgCl,实现有效分离 ,Ag转化为AgCl,实现有效分离 |
D.还原步骤中, 与Au的物质的量之比为4∶3 与Au的物质的量之比为4∶3 |
(3)浸取1中相关反应的化学方程式是
(4)“细菌氧化”时,
 发生反应的离子方程式是
发生反应的离子方程式是
您最近一年使用:0次
5 . 分类法是一种简单易行的科学方法。现对 进行多角度分析并预测其性质。
进行多角度分析并预测其性质。
(1)从组成特点分析, 属于
属于___________ (填“氧化物”、“酸”或“盐”)。
(2) 的水溶液可导电,
的水溶液可导电, 的电离方程式是
的电离方程式是___________ 。
(3)从 中Cl元素价态分析,
中Cl元素价态分析, 在氧化还原反应中表现
在氧化还原反应中表现___________ 性。
(4) 与下列物质反应且体现氧化性的是
与下列物质反应且体现氧化性的是___________ 。
a.空气中的 和
和 b.
b. c.KI d.
c.KI d.
 进行多角度分析并预测其性质。
进行多角度分析并预测其性质。(1)从组成特点分析,
 属于
属于(2)
 的水溶液可导电,
的水溶液可导电, 的电离方程式是
的电离方程式是(3)从
 中Cl元素价态分析,
中Cl元素价态分析, 在氧化还原反应中表现
在氧化还原反应中表现(4)
 与下列物质反应且体现氧化性的是
与下列物质反应且体现氧化性的是a.空气中的
 和
和 b.
b. c.KI d.
c.KI d.
您最近一年使用:0次
名校
解题方法
6 . 按照要求回答下列问题:
(1)下列物质:①铁片 ②液态的HCl ③蔗糖 ④酒精 ⑤稀盐酸 ⑥H2SO4 ⑦KOH ⑧熔融状态的KNO3 ⑨O2 ⑩BaSO4固体。
(a)以上物质中能导电的是_______ 。(填序号,下同)
(b)以上物质中属于电解质的是_______ 。
(c)以上物质中属于非电解质的是_______ 。
(2)取少量Fe2O3粉末(红棕色)加入适量盐酸,得到黄色溶液,用此溶液进行以下实验:
(a)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中加入制取的黄色溶液2mL,继续煮沸至液体呈_______ 色,停止加热,用激光笔照射烧杯中的液体,可以观察到液体中_______ 。
(b)氢氧化铁胶体制备的化学方程式为_______ 。
(c)向烧杯中逐滴加入过量的盐酸,会出现一系列变化:现象为_______ ,原因是(用离子方程式表示)_______ 。
(d)氢氧化铁胶体稳定存在的主要原因是_______ 。
(3)某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO 的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为
的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为_______ 。
(4)铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→…→铜”的转化。
铜 铜绿
铜绿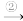 A
A Cu(OH)2
Cu(OH)2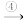 B
B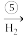 Cu
Cu
(a)从三种不同分类标准回答,“铜绿”属于哪类物质?_______ 。
(b)写出B的化学式_______ 。
(c)上述转化过程中属于置换反应的是_______ (填序号)。
(d)写出②反应的化学方程式:_______ 。
(5)下列方程式中G、Q、X、Y、Z均为含氯元素的物质,它们之间存在如下反应:
(a)Y+NaOH→G+Q+H2O;(b)G→Q+NaCl;(c)Q+H2O→X+H2;(d)Z+NaOH→Q+X+H2O。
试推断五种物质中氯元素的化合价由低到高的顺序为_______ 。
(1)下列物质:①铁片 ②液态的HCl ③蔗糖 ④酒精 ⑤稀盐酸 ⑥H2SO4 ⑦KOH ⑧熔融状态的KNO3 ⑨O2 ⑩BaSO4固体。
(a)以上物质中能导电的是
(b)以上物质中属于电解质的是
(c)以上物质中属于非电解质的是
(2)取少量Fe2O3粉末(红棕色)加入适量盐酸,得到黄色溶液,用此溶液进行以下实验:
(a)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中加入制取的黄色溶液2mL,继续煮沸至液体呈
(b)氢氧化铁胶体制备的化学方程式为
(c)向烧杯中逐滴加入过量的盐酸,会出现一系列变化:现象为
(d)氢氧化铁胶体稳定存在的主要原因是
(3)某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO
 的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为
的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为(4)铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→…→铜”的转化。
铜
 铜绿
铜绿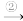 A
A Cu(OH)2
Cu(OH)2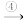 B
B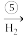 Cu
Cu(a)从三种不同分类标准回答,“铜绿”属于哪类物质?
(b)写出B的化学式
(c)上述转化过程中属于置换反应的是
(d)写出②反应的化学方程式:
(5)下列方程式中G、Q、X、Y、Z均为含氯元素的物质,它们之间存在如下反应:
(a)Y+NaOH→G+Q+H2O;(b)G→Q+NaCl;(c)Q+H2O→X+H2;(d)Z+NaOH→Q+X+H2O。
试推断五种物质中氯元素的化合价由低到高的顺序为
您最近一年使用:0次
2024-09-03更新
|
427次组卷
|
2卷引用:江苏省南京外国语学校2023-2024学年高一上学期第一阶段测试化学试卷
7 . 分类法是常用的科学研究方法,通过对物质进行分类,可以更方便地认识物质变化的规律。
(1)在 四种物质中,有一种物质所属类别与其他三种不同。写出该物质溶于水时的电离方程式:
四种物质中,有一种物质所属类别与其他三种不同。写出该物质溶于水时的电离方程式:___________ 。
(2)在硝酸、氧气、铝三种物质中:
①常用作氧化剂的是___________ 。
②欲实现转化: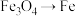 ,应选择加入
,应选择加入___________ 。
(3)根据高铁酸钾 中铁元素的化合价为
中铁元素的化合价为___________ 价,推测其具有___________ (填“氧化性”或“还原性”)。
(4) 属于酸性氧化物。
属于酸性氧化物。 与氢氧化钠溶液反应的化学方程式为
与氢氧化钠溶液反应的化学方程式为___________ 。
(1)在
 四种物质中,有一种物质所属类别与其他三种不同。写出该物质溶于水时的电离方程式:
四种物质中,有一种物质所属类别与其他三种不同。写出该物质溶于水时的电离方程式:(2)在硝酸、氧气、铝三种物质中:
①常用作氧化剂的是
②欲实现转化:
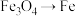 ,应选择加入
,应选择加入(3)根据高铁酸钾
 中铁元素的化合价为
中铁元素的化合价为(4)
 属于酸性氧化物。
属于酸性氧化物。 与氢氧化钠溶液反应的化学方程式为
与氢氧化钠溶液反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 将含+4价硫的化合物X通入(加入)到84消毒液中,可能发生反应NaClO+H2O+X→Na2SO4+Y+HCl,下列有关说法错误的是
| A.X发生氧化反应 |
| B.Y与HCl的化学计量数之比为1:1 |
| C.X为少量Na2SO3 |
| D.含Y的溶液应保存在棕色试剂瓶中 |
您最近一年使用:0次
2024-09-02更新
|
165次组卷
|
2卷引用:安徽省部分学校2024-2025学年高三上学期8月联考化学试题
9 . 化学与生活密切相关。下列有关物质用途与性质的说法正确的是
| A.小苏打可用作胃药,因为其受热易分解 |
| B.“84”消毒液可用于杀菌消毒,因为该溶液具有强氧化性 |
| C.Al2O3可用于制造耐火坩埚,因为其具有两性 |
| D.维生素C与亚铁补血剂一起服用效果好,因为维生素C具有氧化性 |
您最近一年使用:0次
解题方法
10 . 从“铁器时代”开始,铁单质及其化合物一直备受青睐。回答下列问题:
Ⅰ.古代铁质文物的研究。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是___________ (填化学式)。
(2)从潮湿土壤出土或海底打捞的铁质文物必须进行脱氯处理:用稀NaOH溶液反复浸泡使 渗出后,取最后一次浸泡液加入试剂
渗出后,取最后一次浸泡液加入试剂___________ (填化学式),检验脱氯处理是否达标。
Ⅱ.现代对含铁化合物的应用。
(3)电子工业中常用 溶液为“腐蚀液”与覆铜板反应制备印刷电路板。向盛有
溶液为“腐蚀液”与覆铜板反应制备印刷电路板。向盛有
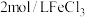 溶液的试管中,加入一块铜片,发生的离子反应方程式为
溶液的试管中,加入一块铜片,发生的离子反应方程式为___________ 。理论上为保证 完全被
完全被 还原,至少需要加入
还原,至少需要加入 的质量为
的质量为___________ g。
(4)高铁酸钾 是一种强氧化剂,可用作水处理剂。将
是一种强氧化剂,可用作水处理剂。将 加入
加入 与
与 的混合液中可以制得
的混合液中可以制得 溶液,发生的反应如下,请补全并配平。
溶液,发生的反应如下,请补全并配平。___________
___________ ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________
Ⅰ.古代铁质文物的研究。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是
(2)从潮湿土壤出土或海底打捞的铁质文物必须进行脱氯处理:用稀NaOH溶液反复浸泡使
 渗出后,取最后一次浸泡液加入试剂
渗出后,取最后一次浸泡液加入试剂Ⅱ.现代对含铁化合物的应用。
(3)电子工业中常用
 溶液为“腐蚀液”与覆铜板反应制备印刷电路板。向盛有
溶液为“腐蚀液”与覆铜板反应制备印刷电路板。向盛有
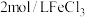 溶液的试管中,加入一块铜片,发生的离子反应方程式为
溶液的试管中,加入一块铜片,发生的离子反应方程式为 完全被
完全被 还原,至少需要加入
还原,至少需要加入 的质量为
的质量为(4)高铁酸钾
 是一种强氧化剂,可用作水处理剂。将
是一种强氧化剂,可用作水处理剂。将 加入
加入 与
与 的混合液中可以制得
的混合液中可以制得 溶液,发生的反应如下,请补全并配平。
溶液,发生的反应如下,请补全并配平。___________
 ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________
您最近一年使用:0次



