1 . 某试样含有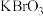 、
、 及㤢性物质。称取试样
及㤢性物质。称取试样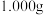 ,溶解后配制到
,溶解后配制到 容量瓶中。吸取
容量瓶中。吸取 ,在
,在 介质中用
介质中用 将
将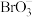 还原为
还原为 ,除去过量的
,除去过量的 后调至中性测定
后调至中性测定 ,消耗
,消耗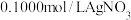 溶液
溶液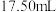 。另吸取
。另吸取 试液用
试液用 酸化后加热除去
酸化后加热除去 ,再调至中性,滴定过剩
,再调至中性,滴定过剩 时消耗了上述
时消耗了上述 溶液
溶液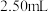 。计算试样中
。计算试样中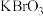 、
、 的质量分数
的质量分数_______ 、_______ 。
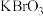 、
、 及㤢性物质。称取试样
及㤢性物质。称取试样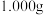 ,溶解后配制到
,溶解后配制到 容量瓶中。吸取
容量瓶中。吸取 ,在
,在 介质中用
介质中用 将
将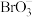 还原为
还原为 ,除去过量的
,除去过量的 后调至中性测定
后调至中性测定 ,消耗
,消耗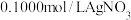 溶液
溶液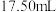 。另吸取
。另吸取 试液用
试液用 酸化后加热除去
酸化后加热除去 ,再调至中性,滴定过剩
,再调至中性,滴定过剩 时消耗了上述
时消耗了上述 溶液
溶液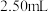 。计算试样中
。计算试样中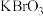 、
、 的质量分数
的质量分数
您最近一年使用:0次
解题方法
2 . 选择性催化还原(SCR)脱硝技术可用于减少工业生产中氮氧化物( )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:
Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
(1)反应

___________ ,副反应化学方程式为___________ 。
(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图:___________ ,应选择的最佳催化剂为___________ ,选用合适的催化剂还能抑制催化剂表面出现铵盐结晶现象,结晶会导致___________ 。
Ⅱ.H2―SCR技术
主反应: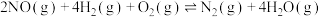
副反应:
(3)恒温下,向容积为1L的容器中充入2mol NO、4mol 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的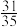 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为___________ ,主反应的
___________ (列出计算式即可)。
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:___________ ,随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是___________ 。
 )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
| 反应方程式 | 反应热 | |
| 吸附过程 | 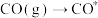 |  |
 |  | |
| 解离过程 |  |  |
| 缔结过程 | 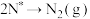 |  |
 |  | |
 | 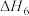 |
(1)反应


(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图: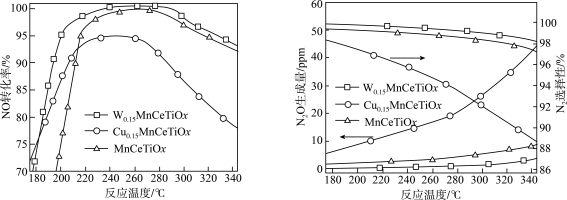
Ⅱ.H2―SCR技术
主反应:
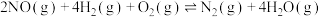
副反应:

(3)恒温下,向容积为1L的容器中充入2mol NO、4mol
 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的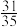 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的
 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
您最近一年使用:0次
解题方法
3 . 以硫铁矿(主要成分为 )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体( )的工艺流程如下图所示。
)的工艺流程如下图所示。
(1)需将硫铁矿粉碎再“焙烧”的目的是_______ 。
(2)硫铁矿“焙烧”后的烧渣中含有 、
、 等,“酸溶”时不能用硫酸代替盐酸的原因是
等,“酸溶”时不能用硫酸代替盐酸的原因是_______ 。
(3)“操作I”的名称为_______ 。
(4)“氧化”过程中主要发生反应的离子方程式为_______ , 的电子式为
的电子式为_______ 。
(5)实验室常用 配制
配制 溶液,写出正确的配制方法:
溶液,写出正确的配制方法:_______ 。
(6)尾气主要含 、
、 、
、 和少量的
和少量的 、
、 ,为测定其中
,为测定其中 的含量,某同学将VL尾气缓慢通入装置A中。
的含量,某同学将VL尾气缓慢通入装置A中。_______ ,该装置的作用是_______ 。
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量 的含量,写出该方案合理与否的理由:
的含量,写出该方案合理与否的理由:_______ 。
 )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体( )的工艺流程如下图所示。
)的工艺流程如下图所示。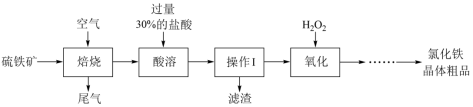
(1)需将硫铁矿粉碎再“焙烧”的目的是
(2)硫铁矿“焙烧”后的烧渣中含有
 、
、 等,“酸溶”时不能用硫酸代替盐酸的原因是
等,“酸溶”时不能用硫酸代替盐酸的原因是(3)“操作I”的名称为
(4)“氧化”过程中主要发生反应的离子方程式为
 的电子式为
的电子式为(5)实验室常用
 配制
配制 溶液,写出正确的配制方法:
溶液,写出正确的配制方法:(6)尾气主要含
 、
、 、
、 和少量的
和少量的 、
、 ,为测定其中
,为测定其中 的含量,某同学将VL尾气缓慢通入装置A中。
的含量,某同学将VL尾气缓慢通入装置A中。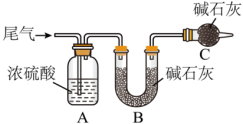
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量
 的含量,写出该方案合理与否的理由:
的含量,写出该方案合理与否的理由:
您最近一年使用:0次
4 . 常温下,往烧杯中加入10mL1mol/LFeCl3溶液和10mL2mol/LKI溶液,c(I-)随时间变化如图所示,不考虑溶液混合时体积的改变。下列说法正确的是
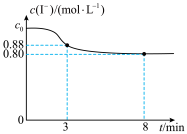
| A.c0=2 |
| B.3~8min内,Fe3+的平均反应速率为0.08mol/(L·min) |
| C.8min时,往烧杯中滴加KSCN溶液,溶液不变红 |
D.烧杯中发生反应的离子方程式为2Fe3++2I- 2Fe2++I2 2Fe2++I2 |
您最近一年使用:0次
名校
解题方法
5 . 某化学兴趣小组利用图1装置(加热和夹持装置已省略)制备氨气并进行喷泉实验.
i.氨气的制备:打开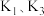 ,关闭
,关闭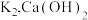 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.
ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备 ,关闭
,关闭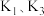 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
请回答下列问题:___________________ ;丁处倒置漏斗的作用是______________ ;氨水中含有的分子有 、
、______________ .
(2)C→D过程中,三颈烧瓶中的现象为_____________ ; 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为_____________ .
(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.__________________________ .
②烧杯中发生反应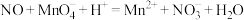 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为__________ (填化学式),氧化产物和还原产物的物质的量之比为__________ (填最简整数比).
i.氨气的制备:打开
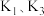 ,关闭
,关闭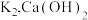 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备
 ,关闭
,关闭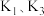 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.请回答下列问题:
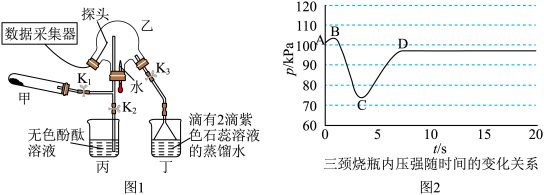
 、
、(2)C→D过程中,三颈烧瓶中的现象为
 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.
②烧杯中发生反应
 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为
您最近一年使用:0次
2024-05-08更新
|
113次组卷
|
3卷引用:甘肃省白银市2023-2024学年高一下学期期中考试化学试题
解题方法
6 . 二氧化碲(TeO2)是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为Cu2Te,还含有少量Cu,Ag)为原料制备TeO2并获得海绵铜的工艺流程如图所示。
(1)Te位于元素周期表的___________ 族。
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为___________ ,为了加快反应速率,不可以采取的措施为___________ (写字母)
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:______ 。
□Ag+□H++□ =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。
③若使用稀硝酸代替NaClO3,不足之处可能是___________ 。
(3)“碱浸提碲”时,TeO2反应的化学方程式为___________ ,浸渣b的主要成分为___________ 。
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为___________ 。
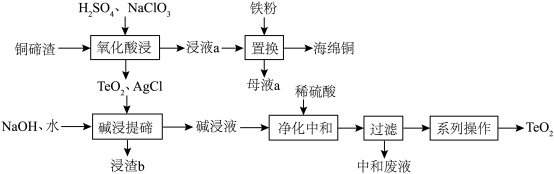
(1)Te位于元素周期表的
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:
□Ag+□H++□
 =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。③若使用稀硝酸代替NaClO3,不足之处可能是
(3)“碱浸提碲”时,TeO2反应的化学方程式为
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为
您最近一年使用:0次
解题方法
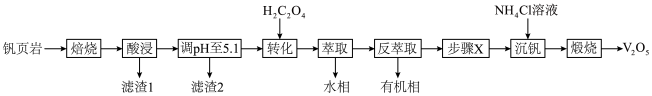
7 . V有“工业味精”之称。工业上提取钒的工艺有多种,一种从钒页岩(一种主要含Si、Fe、Al、V元素的矿石)中提取V的工艺流程如下:
①“酸浸”时有VO 生成;
生成;
② 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为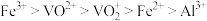 ;
;
③VO 和
和 可以相互转化。
可以相互转化。
回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl- 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是____________________ 。
(2)“滤渣1”除掉的主要杂质元素是_______ (填元素符号)。
(3) 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是_____________ ,发生的离子反应方程式为_____________________ 。
(4)①“沉钒”时,生成 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入________ (填“氧化剂”或“还原剂”),写出“沉钒”时的离子反应方程式_______________________ 。
②以“沉钒率”( 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是_______________ 。 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到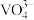 ,
,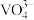 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为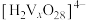 ,其中
,其中
________ 。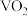 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是_____ 原子。
①“酸浸”时有VO
 生成;
生成;②
 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为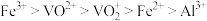 ;
;③VO
 和
和 可以相互转化。
可以相互转化。回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl-
 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是(2)“滤渣1”除掉的主要杂质元素是
(3)
 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是(4)①“沉钒”时,生成
 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入②以“沉钒率”(
 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是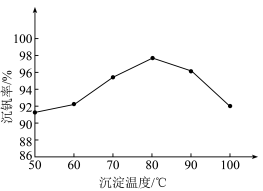
 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到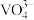 ,
,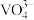 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为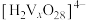 ,其中
,其中
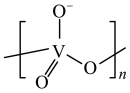
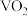 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是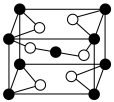
您最近一年使用:0次
2024-05-03更新
|
525次组卷
|
2卷引用:广东省大湾区普通高中2024届高三下学期毕业年级联合模拟考试(二)化学试卷
8 . 纳米级硒化锰(MnSe)是一种半导体材料,难溶于水。以锰渣(主要成分是 ,含少量
,含少量 、CuO)为原料制备硒化锰的流程如图所示:
、CuO)为原料制备硒化锰的流程如图所示:
(1)为了提高“酸溶”速率,宜采取的措施有___________ (填两条)。
(2)滤渣1的主要成分之一是单质,“还原”得到的滤液中溶质为 和
和 。写出“还原”反应的离子方程式:
。写出“还原”反应的离子方程式:___________ 。
(3)“氧化”中还原剂、氧化剂的物质的量之比为___________ 。
(4)滤渣2的主要成分是___________ (填化学式)。常温下,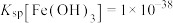 。离子浓度
。离子浓度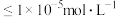 时认为该离子已沉淀完全。“除铁”调节pH的最小值为
时认为该离子已沉淀完全。“除铁”调节pH的最小值为___________ 。
(5)“合成”中分离MnSe的操作名称是___________ 。
 ,含少量
,含少量 、CuO)为原料制备硒化锰的流程如图所示:
、CuO)为原料制备硒化锰的流程如图所示: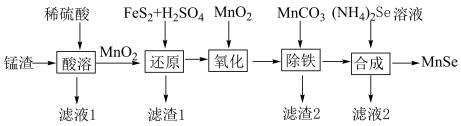
(1)为了提高“酸溶”速率,宜采取的措施有
(2)滤渣1的主要成分之一是单质,“还原”得到的滤液中溶质为
 和
和 。写出“还原”反应的离子方程式:
。写出“还原”反应的离子方程式:(3)“氧化”中还原剂、氧化剂的物质的量之比为
(4)滤渣2的主要成分是
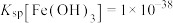 。离子浓度
。离子浓度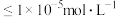 时认为该离子已沉淀完全。“除铁”调节pH的最小值为
时认为该离子已沉淀完全。“除铁”调节pH的最小值为(5)“合成”中分离MnSe的操作名称是
您最近一年使用:0次
2024·江苏·模拟预测
9 . 氮氧化物会严重污染空气,汽车尾气及一些工业生产的烟气中都含有氮氧化物,工业上常用催化转化法、氨还原法、氧化剂氧化法进行处理。回答下列问题:
(1)汽车排放的尾气中有NO和CO,在催化剂的作用下可转化为两种无污染的气体。已知:
N2(g)+O2(g) 2NO(g) △H1=+180.0kJ·mol-1 ①
2NO(g) △H1=+180.0kJ·mol-1 ①
CO(g)+ O2(g)
O2(g)  CO2(g) △H2=-283.5kJ·mol-1 ②
CO2(g) △H2=-283.5kJ·mol-1 ②
则反应2CO(g)+2NO(g) N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=_______ 。
(2)在2L的密闭容器中充入1molNO2和2molCO,发生下述反应:4CO(g)+2NO2(g) N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的
N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的_______ 点。_______ ,历程图中总反应的化学方程式为_______ 。 ,并放出热量。
,并放出热量。
①该反应的离子方程式为_______ 。
②向NaClO2溶液中加入Fe3+,会发生反应:Fe3++ =Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是
=Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是_______ ;以NaClO2溶液为吸收剂,NO的氧化率随温度的变化情况,如图2所示,温度超过60℃后,NO氧化率下降,试解释其原因:_______ 。
(1)汽车排放的尾气中有NO和CO,在催化剂的作用下可转化为两种无污染的气体。已知:
N2(g)+O2(g)
 2NO(g) △H1=+180.0kJ·mol-1 ①
2NO(g) △H1=+180.0kJ·mol-1 ①CO(g)+
 O2(g)
O2(g)  CO2(g) △H2=-283.5kJ·mol-1 ②
CO2(g) △H2=-283.5kJ·mol-1 ②则反应2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=(2)在2L的密闭容器中充入1molNO2和2molCO,发生下述反应:4CO(g)+2NO2(g)
 N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的
N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的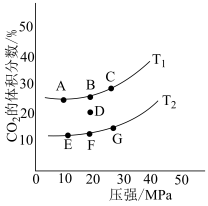

 ,并放出热量。
,并放出热量。①该反应的离子方程式为
②向NaClO2溶液中加入Fe3+,会发生反应:Fe3++
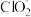 =Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是
=Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是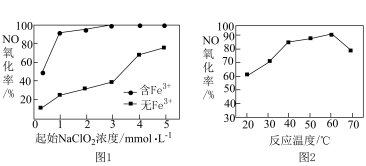
您最近一年使用:0次
解题方法
10 . 重铬酸钾是一种重要的化工原料,工业上以某含铬矿(主要成分为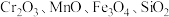 等)为主要原料制备重铬酸钾的工艺流程如图所示:
等)为主要原料制备重铬酸钾的工艺流程如图所示: 的条件下,
的条件下, (III)不能被氧化,高锰酸钾的还原产物是
(III)不能被氧化,高锰酸钾的还原产物是 。
。
回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有_______ (任写两条)。
(2)浸渣的主要成分为_______ (填化学式);“除铁、除锰”时沉锰的离子方程式为_______ 。
(3)“焙烧”时发生反应的化学方程式为_______ 。
(4)调 ”的目的是为了完成
”的目的是为了完成 和
和 的转换,涉及反应:
的转换,涉及反应: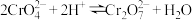 ;常温下,某
;常温下,某 溶液中含铬元素
溶液中含铬元素 ,调节溶液的
,调节溶液的 后两种离子的变化曲线如图所示,
后两种离子的变化曲线如图所示,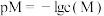 ,其中
,其中 可表示
可表示 或
或 ,图中表示
,图中表示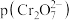 随
随 变化的曲线为
变化的曲线为_______ (填“X”或“Y”);其中反应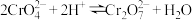 的平衡常数
的平衡常数
_______ 。 ”,在完成转换的同时制备
”,在完成转换的同时制备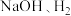 和
和 (装置如图所示):
(装置如图所示):_______ (填化学式),离子交换膜为_______ (填“阴离子”“质子”或“阳离子”)交换膜。
(6)“交换”过程中有关物质的溶解度如图所示,有同学认为结晶过滤的温度应是 和
和 溶解度相差最大的时候,你认为这个观点是否正确并说明理由:
溶解度相差最大的时候,你认为这个观点是否正确并说明理由:_______ 。
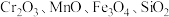 等)为主要原料制备重铬酸钾的工艺流程如图所示:
等)为主要原料制备重铬酸钾的工艺流程如图所示: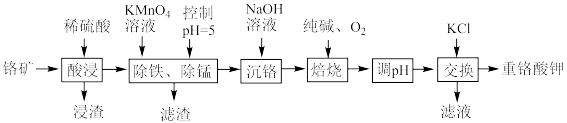
 的条件下,
的条件下, (III)不能被氧化,高锰酸钾的还原产物是
(III)不能被氧化,高锰酸钾的还原产物是 。
。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有
(2)浸渣的主要成分为
(3)“焙烧”时发生反应的化学方程式为
(4)调
 ”的目的是为了完成
”的目的是为了完成 和
和 的转换,涉及反应:
的转换,涉及反应: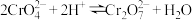 ;常温下,某
;常温下,某 溶液中含铬元素
溶液中含铬元素 ,调节溶液的
,调节溶液的 后两种离子的变化曲线如图所示,
后两种离子的变化曲线如图所示,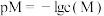 ,其中
,其中 可表示
可表示 或
或 ,图中表示
,图中表示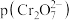 随
随 变化的曲线为
变化的曲线为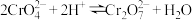 的平衡常数
的平衡常数

 ”,在完成转换的同时制备
”,在完成转换的同时制备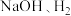 和
和 (装置如图所示):
(装置如图所示):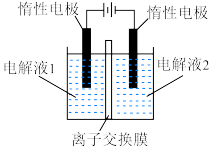
(6)“交换”过程中有关物质的溶解度如图所示,有同学认为结晶过滤的温度应是
 和
和 溶解度相差最大的时候,你认为这个观点是否正确并说明理由:
溶解度相差最大的时候,你认为这个观点是否正确并说明理由: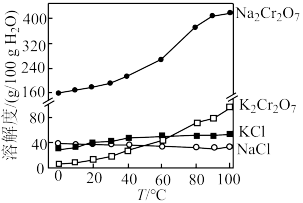
您最近一年使用:0次



