名校
解题方法
1 . 三氯化钌( )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从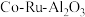 催化剂废料中分离制各
催化剂废料中分离制各 和
和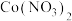 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)“焙烧”后所得固体主要成分为 、
、 、
、 和
和___________ 。
(3)“还原”过程会产生 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为______________________ 。
(4)“酸溶”过程中,先加入盐酸溶解 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为___________ 。
(5)“蒸发结晶”在真空度为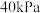 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是___________ 。
(6)若维持 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于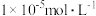 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于___________ 。[已知: ,
,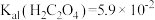 ,
, 结果保留三位小数]
结果保留三位小数]
(7)“沉钴”时,若得到的是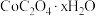 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为______________________ 。
(8)该流程中,还有一种重要成分 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:___________ 。
 )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从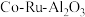 催化剂废料中分离制各
催化剂废料中分离制各 和
和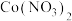 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“焙烧”后所得固体主要成分为
 、
、 、
、 和
和(3)“还原”过程会产生
 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为(4)“酸溶”过程中,先加入盐酸溶解
 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为(5)“蒸发结晶”在真空度为
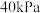 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是(6)若维持
 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于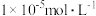 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于 ,
,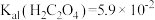 ,
, 结果保留三位小数]
结果保留三位小数](7)“沉钴”时,若得到的是
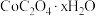 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为(8)该流程中,还有一种重要成分
 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:
您最近一年使用:0次
2024-01-09更新
|
1269次组卷
|
6卷引用:湖南省株洲市2024届高三上学期教学质量统一检测化学试题
湖南省株洲市2024届高三上学期教学质量统一检测化学试题湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届江西省贵溪市实验中学高三下学期5月模拟考试压轴(三)化学试卷
名校
解题方法
2 . 贵州磷矿储量丰富。磷酸氢钙( )是一种磷肥,某工厂利用磷矿(含
)是一种磷肥,某工厂利用磷矿(含 等元素)进行综合生产的部分流程如图所示:
等元素)进行综合生产的部分流程如图所示: 。
。
回答下列问题:
(1) 的分子空间结构为
的分子空间结构为___________ 。
(2)为提高浸出效率,可采取的措施有___________ (任写一条),用离子方程式说明酸浸时通入 的目的:
的目的:___________ ,滤渣1的主要成分是___________ 。
(3)常温下,酸浸后滤液1中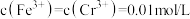 、
、 ,调节
,调节 将
将 完全沉淀,滤液2调节
完全沉淀,滤液2调节 的范围为
的范围为___________ 。
(4)为使 与
与 完全反应生成
完全反应生成 ,二者质量之比为
,二者质量之比为___________ 。
(5)利用 可制得
可制得 ,一定条件下,
,一定条件下, 可与
可与 、过量C反应,生成可用于制作锂电池的
、过量C反应,生成可用于制作锂电池的 ,写出该反应的化学方程式:
,写出该反应的化学方程式:___________ 。
(6)氧化镁熔沸点高,可制造耐火、耐高温器材,其晶胞结构如图所示。该晶体中每个 周围与它最近且距离相等的
周围与它最近且距离相等的 数为
数为___________ ;若该立方晶胞参数为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 )是一种磷肥,某工厂利用磷矿(含
)是一种磷肥,某工厂利用磷矿(含 等元素)进行综合生产的部分流程如图所示:
等元素)进行综合生产的部分流程如图所示: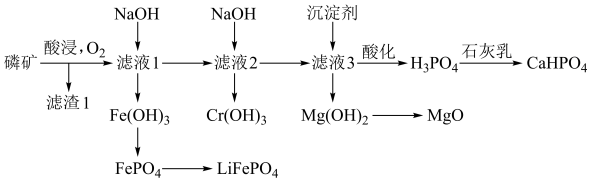
 。
。回答下列问题:
(1)
 的分子空间结构为
的分子空间结构为(2)为提高浸出效率,可采取的措施有
 的目的:
的目的:(3)常温下,酸浸后滤液1中
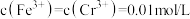 、
、 ,调节
,调节 将
将 完全沉淀,滤液2调节
完全沉淀,滤液2调节 的范围为
的范围为(4)为使
 与
与 完全反应生成
完全反应生成 ,二者质量之比为
,二者质量之比为(5)利用
 可制得
可制得 ,一定条件下,
,一定条件下, 可与
可与 、过量C反应,生成可用于制作锂电池的
、过量C反应,生成可用于制作锂电池的 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(6)氧化镁熔沸点高,可制造耐火、耐高温器材,其晶胞结构如图所示。该晶体中每个
 周围与它最近且距离相等的
周围与它最近且距离相等的 数为
数为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。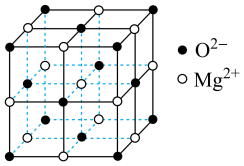
您最近一年使用:0次
名校
解题方法
3 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
Ⅰ.某学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验。
请回答下列问题:
(1)实验①中湿棉花、肥皂液作用分别是___________ 、___________ ;实验①中能观察到肥皂液中持续产生肥皂泡,当用燃烧着火柴靠近肥皂泡时,气泡破裂,气体燃烧,火焰呈黄色,并发出轻微的爆鸣声。解释火焰呈黄色的原因___________ ;实验①中反应的化学方程式是___________ 。
(2)实验②前,甲同学对其反应及现象进行预测:向反应后固体加入稀硫酸发生反应的离子方程式_______________ ;实验②中溶液B呈现______ 色,其中发生反应的离子方程式___________ 。
(3)实验②中,乙同学观察到溶液B未呈现红色,则溶液B未呈现红色的原因__________ (用离子方程式表示)。检验B溶液中金属离子的方法_______________ 。
Ⅱ.我国具有5000年文化,文物是活的历史。某博物馆修复出土铁器包括:检测锈蚀产物→分析腐蚀原理→脱氯→形成保护层等过程。
(4)锈蚀产物的主要成分为 、
、 、
、 、
、 、FeOCl。研究发现,出土文物
、FeOCl。研究发现,出土文物 保护层被
保护层被 氧化为
氧化为 而引起腐蚀的。
而引起腐蚀的。 中铁的化合价为
中铁的化合价为_______ 。
(5)利用在NaOH溶液中,溶解度FeOCl大于 ,对固体FeOCl进行脱氯,离子方程式为
,对固体FeOCl进行脱氯,离子方程式为_______________ 。
(6)用 把脱氯产物
把脱氯产物 还原为
还原为 ,生成1mol
,生成1mol  需要
需要___________ mol  。
。
Ⅰ.某学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验。
| 实验① | 实验② |
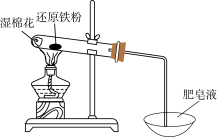 | 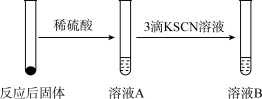 |
(1)实验①中湿棉花、肥皂液作用分别是
(2)实验②前,甲同学对其反应及现象进行预测:向反应后固体加入稀硫酸发生反应的离子方程式
(3)实验②中,乙同学观察到溶液B未呈现红色,则溶液B未呈现红色的原因
Ⅱ.我国具有5000年文化,文物是活的历史。某博物馆修复出土铁器包括:检测锈蚀产物→分析腐蚀原理→脱氯→形成保护层等过程。
(4)锈蚀产物的主要成分为
 、
、 、
、 、
、 、FeOCl。研究发现,出土文物
、FeOCl。研究发现,出土文物 保护层被
保护层被 氧化为
氧化为 而引起腐蚀的。
而引起腐蚀的。 中铁的化合价为
中铁的化合价为(5)利用在NaOH溶液中,溶解度FeOCl大于
 ,对固体FeOCl进行脱氯,离子方程式为
,对固体FeOCl进行脱氯,离子方程式为(6)用
 把脱氯产物
把脱氯产物 还原为
还原为 ,生成1mol
,生成1mol  需要
需要 。
。
您最近一年使用:0次
解题方法
4 . 电镀厂阳极产生的电镀污泥中含有大量的重金属物质[主要含有Cr2O3、Cu2Te及少量单质金(Au)],为了消除有害电镀污泥对环境的污染,某科研团队设计了新工艺,该工艺实现了Cr—Au—Cu—Te的深度利用,工艺流程如图:
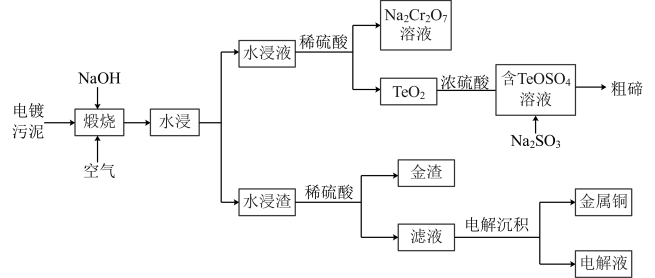
已知:①煅烧过程中Cu2Te发生的反应为 ;
;
②TeO2是两性氧化物,微溶于水,NaTeO3溶液为无色溶液。
(1)煅烧过程中的主要反应为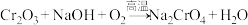 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为___________ ,该步骤不能使用陶瓷坩埚的原因是___________ 。
(2)水浸渣的成分为___________ ,基态Cr原子的价层电子轨道表示式为___________ 。
(3)图中生成Na2Cr2O7溶液时的离子方程式为_____________________ ,溶液的颜色由_______ 色变为_______ 色。
(4)电解沉积除铜时,阳极电极反应式为___________ ,流程中可以循环利用的物质是________ 。
(5)写出向“含TeOSO4溶液”加入Na2SO3固体的化学方程式为___________ 。
(6)粗碲经熔融结晶法能得到高纯碲。若500kg电镀污泥可以制得100kg含碲99.8%的高纯碲,已知电镀污泥中含Cu2Te的质量分数为49.9%,计算提纯过程中碲的利用率为___________ %。

已知:①煅烧过程中Cu2Te发生的反应为
 ;
;②TeO2是两性氧化物,微溶于水,NaTeO3溶液为无色溶液。
(1)煅烧过程中的主要反应为
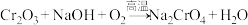 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为(2)水浸渣的成分为
(3)图中生成Na2Cr2O7溶液时的离子方程式为
(4)电解沉积除铜时,阳极电极反应式为
(5)写出向“含TeOSO4溶液”加入Na2SO3固体的化学方程式为
(6)粗碲经熔融结晶法能得到高纯碲。若500kg电镀污泥可以制得100kg含碲99.8%的高纯碲,已知电镀污泥中含Cu2Te的质量分数为49.9%,计算提纯过程中碲的利用率为
您最近一年使用:0次
2023-12-31更新
|
413次组卷
|
2卷引用:河北省2024届高三上学期大数据应用调研联合测评Ⅲ化学试卷
名校
解题方法
5 . 工业上用软锰矿(主要成分是MnO2,含有Al2O3、SiO2等杂质),制备KMnO4的流程如下:
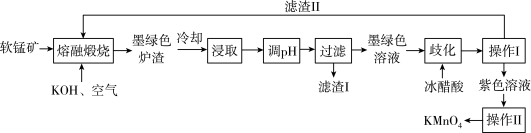
已知:①软锰矿中MnO2质量分数为52.2%
②K2MnO4固体和溶液均为墨绿色;酸性环境下能发生歧化反应。
(1)K2MnO4中Mn的化合价是___________ 。
(2)为了提高煅烧速率,可采取的措施有___________ 。(答一点即可)
(3)熔融煅烧时将空气改用KClO也能达到目的,写出KClO与软锰矿反应的主要化学方程式___________ 。
(4)向浸取后的溶液中通入CO2,调节其pH,经过滤得滤渣Ⅰ,滤渣Ⅰ的成分是___________ 。整个流程中可以循环利用的物质是___________ 。
(5)写出歧化一步发生的离子反应方程式:___________ 。
(6)不用盐酸代替冰醋酸的原因:___________ 。
(7)若不考虑物质循环与制备过程中的损失,1t软锰矿理论上可制得KMnO4固体___________ kg。

已知:①软锰矿中MnO2质量分数为52.2%
②K2MnO4固体和溶液均为墨绿色;酸性环境下能发生歧化反应。
(1)K2MnO4中Mn的化合价是
(2)为了提高煅烧速率,可采取的措施有
(3)熔融煅烧时将空气改用KClO也能达到目的,写出KClO与软锰矿反应的主要化学方程式
(4)向浸取后的溶液中通入CO2,调节其pH,经过滤得滤渣Ⅰ,滤渣Ⅰ的成分是
(5)写出歧化一步发生的离子反应方程式:
(6)不用盐酸代替冰醋酸的原因:
(7)若不考虑物质循环与制备过程中的损失,1t软锰矿理论上可制得KMnO4固体
您最近一年使用:0次
名校
解题方法
6 . 利用表面含有油脂的废旧的铁屑制备Fe3O4粒子,流程如下:
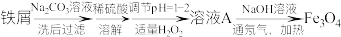
已知: 易与水反应(水解反应),pH=2.7时开始沉淀,pH=3.7沉淀完全。
易与水反应(水解反应),pH=2.7时开始沉淀,pH=3.7沉淀完全。
回答下列问题:
(1)Na2CO3溶液的作用是___________ 。
(2)调节pH为1—2的目的是___________ 。
(3)控制H2O2用量的原因是___________ 。
(4)溶液A中的阳离子是___________ ,检验溶液A中阳离子(除Fe元素外形成的阳离子)的具体操作是___________ 。
(5)溶液A到Fe3O4的离子方程式是___________ 。
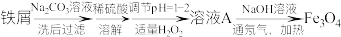
已知:
 易与水反应(水解反应),pH=2.7时开始沉淀,pH=3.7沉淀完全。
易与水反应(水解反应),pH=2.7时开始沉淀,pH=3.7沉淀完全。回答下列问题:
(1)Na2CO3溶液的作用是
(2)调节pH为1—2的目的是
(3)控制H2O2用量的原因是
(4)溶液A中的阳离子是
(5)溶液A到Fe3O4的离子方程式是
您最近一年使用:0次
名校
解题方法
7 . 锰元素能形成 、
、 、
、 、
、 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为 、
、 ,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为
,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
已知:硫化氢 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。 溶液滴入
溶液滴入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为___________ 。
(2)从安全及环保的角度来看“酸浸”过程中,向硫酸溶液中,加料方式为___________ (填标号)。
A.先加软锰矿,再加碳酸锰矿 B.先加碳酸锰矿,再加软锰矿
过滤得到的“酸浸渣”中含有单质S,写出生成单质S的离子方程式:___________ 。
(3)“打浆”:将所得 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是___________ 。
(4)“氧化”: 置于空气中在60℃条件下加热即可得到
置于空气中在60℃条件下加热即可得到 ,该反应的化学方程为
,该反应的化学方程为___________ 。
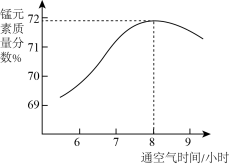
(5)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。___________ 。
 、
、 、
、 、
、 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为 、
、 ,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为
,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。已知:硫化氢
 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
 溶液滴入
溶液滴入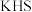 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为(2)从安全及环保的角度来看“酸浸”过程中,向硫酸溶液中,加料方式为
A.先加软锰矿,再加碳酸锰矿 B.先加碳酸锰矿,再加软锰矿
过滤得到的“酸浸渣”中含有单质S,写出生成单质S的离子方程式:
(3)“打浆”:将所得
 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是(4)“氧化”:
 置于空气中在60℃条件下加热即可得到
置于空气中在60℃条件下加热即可得到 ,该反应的化学方程为
,该反应的化学方程为(5)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
您最近一年使用:0次
2023-12-13更新
|
240次组卷
|
3卷引用:江苏省百校大联考2023-2024学年高一上学期12月阶段检测化学试卷
解题方法
8 . 由软锰矿(主要成分为MnO2,含有少量CaO、MgO)制备MnO2的工艺流程如下:
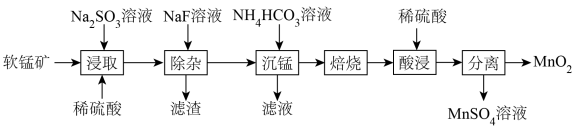
已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为_______ 。
(2)加快“浸取”速率可采取的措施为_______ (答出一种方法即可);“滤渣”的主要成分为_______ 。
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为_______ 。
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:_______ 。
(5)① 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为_______ 、_______ 。
②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是_______ 。
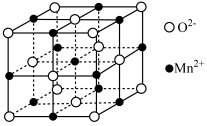
③MnO晶胞结构如图所示,平均每个晶胞中 组成的正四面体空隙有
组成的正四面体空隙有_______ 个,2个 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=_______ g·cm-3。

已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为
(2)加快“浸取”速率可采取的措施为
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:
(5)①
 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是
③MnO晶胞结构如图所示,平均每个晶胞中
 组成的正四面体空隙有
组成的正四面体空隙有 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=
您最近一年使用:0次
2023-12-08更新
|
292次组卷
|
2卷引用:广东省佛山市2023-2024学年高三上学期12月月考化学试题
解题方法
9 . 已知: ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。
(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为_______ 。
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是_______ 。
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。
①
 中
中 键的数目为
键的数目为_______ 。
②蚀刻能力恢复的化学方程式为_______ 。
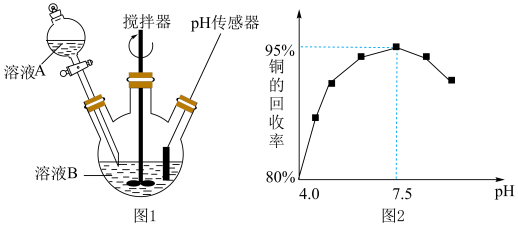
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出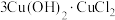 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
①为减少 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为_______ (选填“酸性”或“碱性”)蚀刻废液。
② 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为_______ 。
(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中_______ 。(实验中必须 使用的试剂:20% 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
 ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为
 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。①

 中
中 键的数目为
键的数目为②蚀刻能力恢复的化学方程式为
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出
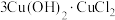 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
①为减少
 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为②
 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中
 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
您最近一年使用:0次
名校
解题方法
10 . 据题目要求完成下列各题:
(1)写出氯气溶于水的离子反应方程式___________ 。
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a___________ b(填>、<、=)。
(3) 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为___________ 。
(4) 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为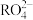 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为___________ 。
(5)已知爆炸时硝酸铵按下式分解: 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为___________ 。
(6)高铁酸钠( )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。
①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:________

②每转移3mol电子,生成 的物质的量为
的物质的量为___________ mol。
(1)写出氯气溶于水的离子反应方程式
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a
(3)
 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为(4)
 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为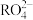 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为(5)已知爆炸时硝酸铵按下式分解:
 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为(6)高铁酸钠(
 )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:

②每转移3mol电子,生成
 的物质的量为
的物质的量为
您最近一年使用:0次
2023-11-29更新
|
331次组卷
|
2卷引用:河北省秦皇岛市第一中学2023-2024学年高一上学期期中考试化学试题



