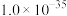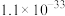解题方法
1 . KMnO4是生活中常用的消毒剂。已知在酸性介质中墨绿色的 易发生歧化反应,生成
易发生歧化反应,生成 和MnO2,回答下列问题:
和MnO2,回答下列问题:
实验(一)制备KMnO4。

(1)“熔融”时分批加入MnO2粉末的目的是
A.铁坩埚 B.玻璃棒 C.泥三角 D.坩埚钳
(2)“抽滤”时选择乙装置,相对甲,乙的主要优点是
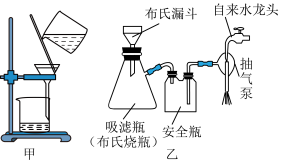
(3)“歧化”时锰元素进入产品的百分率约为
(4)工业上,常用“电解”代替“歧化”,提高锰元素利用率,电解的总反应方程式为
实验(二)测定产品纯度。
取wgKMnO4溶于水配成250mL溶液,取25.00mL于锥形瓶中,加入适量稀硫酸酸化,用 Na2C2O4标准溶液滴定至终点,消耗标准溶液VmL。
Na2C2O4标准溶液滴定至终点,消耗标准溶液VmL。
(5)下列叙述正确的是______(填标号)。
| A.滴定终点时溶液由无色变为紫红色 | B.滴定时眼睛始终注视锥形瓶中溶液颜色变化 |
| C.若锥形瓶未干燥,测得结果会偏高 | D.本实验需要托盘天平、量筒、容量瓶、滴定管等 |
(6)该产品的纯度为
您最近一年使用:0次
解题方法
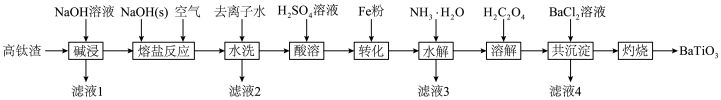
2 . 钛酸钡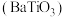 是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。用高钛渣(主要成分为
是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。用高钛渣(主要成分为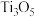 ,含
,含 、
、 等杂质)为原料制备
等杂质)为原料制备 的工业流程如下:
的工业流程如下:
已知:① 在溶液中呈绿色;
在溶液中呈绿色; 是强电解质;
是强电解质;
②部分金属离子开始沉淀的 如下表:
如下表:
回答下列问题:
(1)“碱浸”操作过程中除去的杂质为_______ 。
(2)“水洗”过程中 与水发生离子交换反应:
与水发生离子交换反应: ,滤液2呈绿色,经除杂处理后可在
,滤液2呈绿色,经除杂处理后可在_______ (操作单元名称)循环利用,“熔盐反应”过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
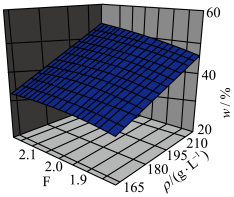
(3)“酸溶”过程中 (
( 溶液质量浓度)及F(
溶液质量浓度)及F( 溶液酸度)与w(
溶液酸度)与w( 质量分数)之间的关系如图所示。当
质量分数)之间的关系如图所示。当 值恒定时,随
值恒定时,随 溶液质量浓度增大,所需硫酸的质量分数
溶液质量浓度增大,所需硫酸的质量分数_______ (填“增大”“减小”或“不变”)。
(4)“水解”操作加入 目的是调节溶液
目的是调节溶液 ,可适当提高水解速率。已知:
,可适当提高水解速率。已知: ,水解反应
,水解反应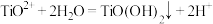 的平衡常数
的平衡常数
_______ ;“转化”过程加入铁粉的目的是_______ ,滤液3中含有的金属阳离子有_______ 。
(5)“共沉淀”过程发生反应: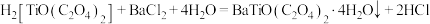 ,“灼烧”时隔绝空气,发生反应的化学方程式为
,“灼烧”时隔绝空气,发生反应的化学方程式为_______ 。
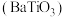 是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。用高钛渣(主要成分为
是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。用高钛渣(主要成分为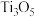 ,含
,含 、
、 等杂质)为原料制备
等杂质)为原料制备 的工业流程如下:
的工业流程如下:
已知:①
 在溶液中呈绿色;
在溶液中呈绿色; 是强电解质;
是强电解质;②部分金属离子开始沉淀的
 如下表:
如下表:| 金属离子 |  |  |  |
开始沉淀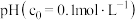 | 1.9 | 7.0 | 9.1 |
(1)“碱浸”操作过程中除去的杂质为
(2)“水洗”过程中
 与水发生离子交换反应:
与水发生离子交换反应: ,滤液2呈绿色,经除杂处理后可在
,滤液2呈绿色,经除杂处理后可在 发生反应的离子方程式为
发生反应的离子方程式为(3)“酸溶”过程中
 (
( 溶液质量浓度)及F(
溶液质量浓度)及F( 溶液酸度)与w(
溶液酸度)与w( 质量分数)之间的关系如图所示。当
质量分数)之间的关系如图所示。当 值恒定时,随
值恒定时,随 溶液质量浓度增大,所需硫酸的质量分数
溶液质量浓度增大,所需硫酸的质量分数
(4)“水解”操作加入
 目的是调节溶液
目的是调节溶液 ,可适当提高水解速率。已知:
,可适当提高水解速率。已知: ,水解反应
,水解反应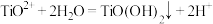 的平衡常数
的平衡常数
(5)“共沉淀”过程发生反应:
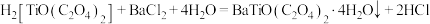 ,“灼烧”时隔绝空气,发生反应的化学方程式为
,“灼烧”时隔绝空气,发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 废旧电池镍钴锰酸锂三元正极材料的主要成分为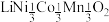 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为_______ ;实际生产中还有少量的Li2CO3生成,原因是_______ 。
(2)“酸洗”的目的是_______ ;若“洗液”中c(Li+)=2.0mol•L-1,加入Na2CO3固体后,为使沉淀Li2CO3中Li元素含量不小于Li元素总量的95%,则1.0L“洗液”中至少需要加入Na2CO3的物质的量为______ mol[忽略溶液体积变化,Ksp(Li2CO3)=2.2×10-3]。
(3)“沉锰”过程中pH对金属沉淀率的影响如图所示。_______ 。
②pH=0.5时,有少量钴、镍析出,可能的原因是_______ ;应选择的最佳pH为_______ 。
(4)“反萃取”的目的是将有机层中Co2+、Ni2+转移到水层。
①试剂X为_______ (填试剂名称)。
②为使Co2+、Ni2+尽可能多地转移到水层,应采取的实验操作有_______ 。
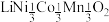 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。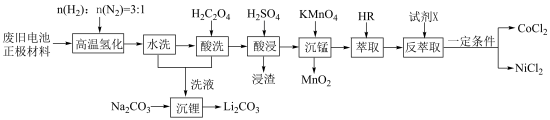
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为
(2)“酸洗”的目的是
(3)“沉锰”过程中pH对金属沉淀率的影响如图所示。
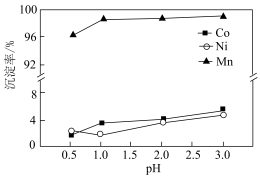
②pH=0.5时,有少量钴、镍析出,可能的原因是
(4)“反萃取”的目的是将有机层中Co2+、Ni2+转移到水层。
①试剂X为
②为使Co2+、Ni2+尽可能多地转移到水层,应采取的实验操作有
您最近一年使用:0次
2024-03-22更新
|
856次组卷
|
3卷引用:山东省临沂市2024届高三一模化学试题
名校
解题方法
4 . 钒和钼是贵重金属,一种从石油炼制的废催化剂(主要成分为MoS2、NiS、V2O5、Al2O3等)中提取钒和钼的工艺流程如图所示。 、MoO
、MoO 、VO
、VO 、[Al(OH)4]-、
、[Al(OH)4]-、 。
。
②常温下,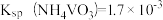 。
。
回答下列问题:
(1)V在元素周期表中的位置为_____ ;H2MoO4·H2O中钼元素的化合价为_____ 。
(2)在“焙烧”过程中MoS2参与的反应中还原剂与氧化剂的物质的量之比为_____ ;若在实验室中完成“焙烧”,应选择_____ (填“石英”或“铁”)坩埚。
(3)写出“沉铝”时生成Al(OH)3的离子方程式:_____ 。
(4)若“沉钒”前溶液中c(VO )=0.17mol·L-1,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(
)=0.17mol·L-1,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c( )=
)=_____ mol·L-1(忽略溶液体积变化)。
(5)一种钒的硫化物的晶体结构(图1)及其俯视图(图2)如图所示:_____ 。
②设阿伏加德罗常数的值为NA,则该晶体的密度为_____ g·cm-3(用含a、b、NA的代数式表示)。
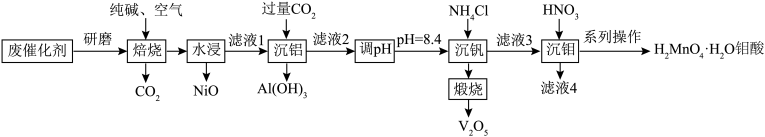
 、MoO
、MoO 、VO
、VO 、[Al(OH)4]-、
、[Al(OH)4]-、 。
。②常温下,
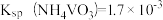 。
。回答下列问题:
(1)V在元素周期表中的位置为
(2)在“焙烧”过程中MoS2参与的反应中还原剂与氧化剂的物质的量之比为
(3)写出“沉铝”时生成Al(OH)3的离子方程式:
(4)若“沉钒”前溶液中c(VO
 )=0.17mol·L-1,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c(
)=0.17mol·L-1,为使钒元素的沉降率达到99%,则“沉钒”后溶液中c( )=
)=(5)一种钒的硫化物的晶体结构(图1)及其俯视图(图2)如图所示:

②设阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
解题方法
5 . 黄金除具备货币商品属性外,由于其优良特性,还可用作珠宝装饰、金触媒、超导体等。以含砷金精矿(成分为Au、FeAsS)为原料提炼黄金的工艺流程如图,请回答下列问题:______ 。
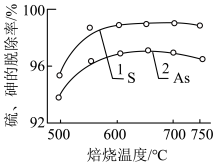
(2)焙烧温度对硫、砷的脱除率的影响如图所示,则最适宜的焙烧温度为______ ℃,原因为______ 。______ 。
(4)氰化过程中,通入O2将Au转化为Na[Au(CN)2](易溶于水),写出该反应的离子方程式:______ 。
(5)滤渣的主要成分为______ 、______ 。
(6)at含Auw%的含砷金精矿通过上述流程(假设Au的损失率为5%)可制得______ tAu。

(2)焙烧温度对硫、砷的脱除率的影响如图所示,则最适宜的焙烧温度为
(4)氰化过程中,通入O2将Au转化为Na[Au(CN)2](易溶于水),写出该反应的离子方程式:
(5)滤渣的主要成分为
(6)at含Auw%的含砷金精矿通过上述流程(假设Au的损失率为5%)可制得
您最近一年使用:0次
2024-03-19更新
|
255次组卷
|
2卷引用:辽宁省辽阳市2024届高三第一次模拟考试化学试卷
6 . 低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:
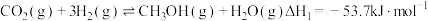
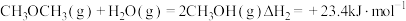
则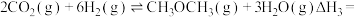
_______ kJ∙mol-1。
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: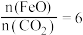 ,则
,则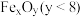 的化学式为
的化学式为_______ ,“热分解系统”中每转移 电子,需消耗
电子,需消耗
_______  。
。
(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子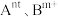 和负离子
和负离子 组成,该物质
组成,该物质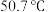 以上形成无序结构(高温相),
以上形成无序结构(高温相),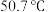 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示:_______ 。
ii.“高温相”具有良好的离子导电性,其主要原因是_______ 。
(4)铜基催化剂 (
( 为
为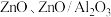 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 上发生反应的总化学方程式
上发生反应的总化学方程式_______ 。
(5)利用电解法在碱性或酸性条件下将 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: 和法拉第效率(
和法拉第效率( )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下:
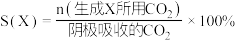

①实验测得,碱性条件生成 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是_______ 。
②实验测得,酸性条件生成 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是_______ 。
(1)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: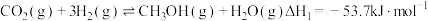
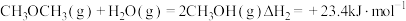
则
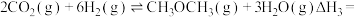
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由
 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: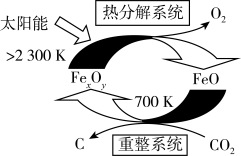
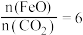 ,则
,则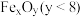 的化学式为
的化学式为 电子,需消耗
电子,需消耗
 。
。(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子
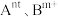 和负离子
和负离子 组成,该物质
组成,该物质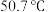 以上形成无序结构(高温相),
以上形成无序结构(高温相),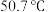 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示: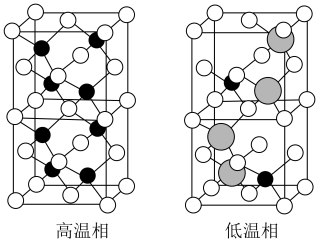
说明:图中,○球为负离子;高温相中的●深色球为正离子或空位;低温相中的 球为
球为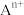 离子,●球为
离子,●球为 离子。
离子。
ii.“高温相”具有良好的离子导电性,其主要原因是
(4)铜基催化剂
 (
( 为
为 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 
 上发生反应的总化学方程式
上发生反应的总化学方程式(5)利用电解法在碱性或酸性条件下将
 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: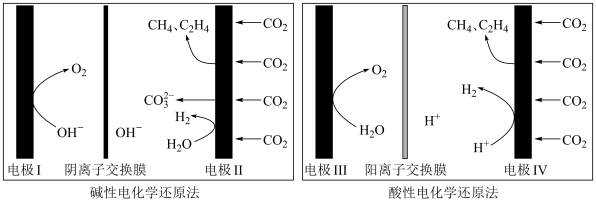
 和法拉第效率(
和法拉第效率(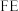 )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下: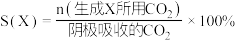

①实验测得,碱性条件生成
 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是②实验测得,酸性条件生成
 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是
您最近一年使用:0次
2024-03-11更新
|
425次组卷
|
4卷引用:江苏省常州市第一中学2023-2024学年高三下学期期初检测化学试卷
江苏省常州市第一中学2023-2024学年高三下学期期初检测化学试卷(已下线)大题预测卷(江西专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)江苏省扬州中学2024届高三下学期考前模拟化学试题江苏省常州市第一中2023-2024学年高二下学期5月月考化学试题
名校
解题方法
7 . 硼化钛强度高、硬度大,广泛应用于机械制造领域;五氟化锑( )是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含
)是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含 、
、 、
、 、
、 、
、 、
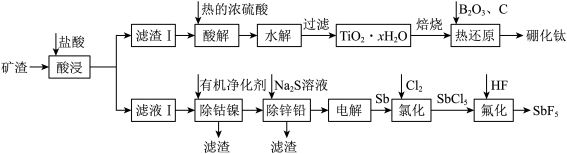
、 )为原料制取硼化钛和五氟化锑的流程如图所示。
)为原料制取硼化钛和五氟化锑的流程如图所示。
已知:① 性质较稳定,加热时可溶于浓硫酸中形成
性质较稳定,加热时可溶于浓硫酸中形成 。
。
②25℃时, 、
、 的
的 分别为
分别为 ,
,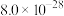 。
。
(1)“水解”步骤中对应的离子方程式为___________ 。为了使水解趋于完全,可采取的措施有___________ 。
(2)硼化钛有类似石墨的层状结构,硼原子平面和钛原子平面在晶体结构中交替出现,形成二维网状结构,其投影图如下,硼化钛的化学式为___________ 。“热还原”步骤中使用电弧炉高温加热装置(1450~1550℃),每消耗1mol 转移电子数为
转移电子数为___________ 。
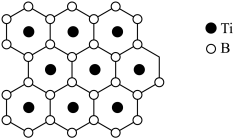
(3)“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理表示为:
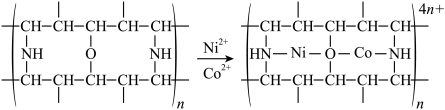
 ,
, 能发生上述转化而
能发生上述转化而 不能,推测可能的原因为
不能,推测可能的原因为___________ 。
(4)已知滤液I中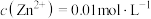 ,
,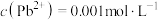 。“除锌铅”步骤中,缓慢滴加稀
。“除锌铅”步骤中,缓慢滴加稀 溶液,先产生的沉淀是(填化学式)
溶液,先产生的沉淀是(填化学式)___________ ;当 、
、 共沉时,先沉淀的物质是否已经沉淀完全(离子浓度
共沉时,先沉淀的物质是否已经沉淀完全(离子浓度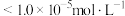 )
)___________ (填“是”或“否”)。
(5)1986年化学家用 和
和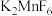 反应,首次实现了用非电解法制取
反应,首次实现了用非电解法制取 ,同时生成
,同时生成 ,已知该过程中
,已知该过程中 接受了一个
接受了一个 的电子对,请写出该反应的化学方程式
的电子对,请写出该反应的化学方程式___________ 。
 )是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含
)是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含 、
、 、
、 、
、 、
、 、
、 )为原料制取硼化钛和五氟化锑的流程如图所示。
)为原料制取硼化钛和五氟化锑的流程如图所示。
已知:①
 性质较稳定,加热时可溶于浓硫酸中形成
性质较稳定,加热时可溶于浓硫酸中形成 。
。②25℃时,
 、
、 的
的 分别为
分别为 ,
,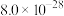 。
。(1)“水解”步骤中对应的离子方程式为
(2)硼化钛有类似石墨的层状结构,硼原子平面和钛原子平面在晶体结构中交替出现,形成二维网状结构,其投影图如下,硼化钛的化学式为
 转移电子数为
转移电子数为
(3)“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理表示为:

 ,
, 能发生上述转化而
能发生上述转化而 不能,推测可能的原因为
不能,推测可能的原因为(4)已知滤液I中
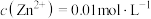 ,
,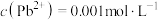 。“除锌铅”步骤中,缓慢滴加稀
。“除锌铅”步骤中,缓慢滴加稀 溶液,先产生的沉淀是(填化学式)
溶液,先产生的沉淀是(填化学式) 、
、 共沉时,先沉淀的物质是否已经沉淀完全(离子浓度
共沉时,先沉淀的物质是否已经沉淀完全(离子浓度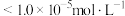 )
)(5)1986年化学家用
 和
和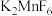 反应,首次实现了用非电解法制取
反应,首次实现了用非电解法制取 ,同时生成
,同时生成 ,已知该过程中
,已知该过程中 接受了一个
接受了一个 的电子对,请写出该反应的化学方程式
的电子对,请写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
8 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: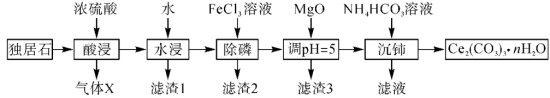
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
2024-03-03更新
|
152次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
解题方法
9 . 构建知识网络是一种有效的学习方法,化学学习中的“价-类”二维图就是其中一种,如图所示是铁及其化合物的“价-类”二维图,请回答下列问题:_____ 。
(2)下列各图示中能较长时间观察到 的是
的是_____ 。_____ ,当生成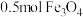 时,转移电子数为
时,转移电子数为_____ 。
(4)将 溶于盐酸后再加入1滴
溶于盐酸后再加入1滴 溶液,则溶液变红时发生反应的离子方程式为
溶液,则溶液变红时发生反应的离子方程式为_____ 。
(5)绿矾 是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后
是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后_____ 可获得绿矾晶体,如何检验绿矾是否完全变质_____ 。
(6)将硫酸亚铁固体隔绝空气煅烧,可发生以下反应,请将方程式配平:_____ 。
_____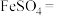 _____
_____ _____
_____ _____
_____

(2)下列各图示中能较长时间观察到
 的是
的是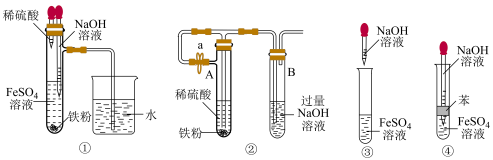
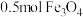 时,转移电子数为
时,转移电子数为(4)将
 溶于盐酸后再加入1滴
溶于盐酸后再加入1滴 溶液,则溶液变红时发生反应的离子方程式为
溶液,则溶液变红时发生反应的离子方程式为(5)绿矾
 是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后
是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后(6)将硫酸亚铁固体隔绝空气煅烧,可发生以下反应,请将方程式配平:
_____
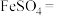 _____
_____ _____
_____ _____
_____
您最近一年使用:0次
名校
解题方法
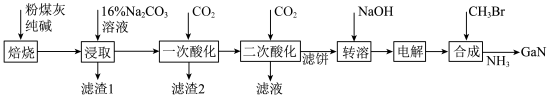
10 . 镓是优良的半导体材料。氮化镓是制作发光二极管的新材料,用于雷达、卫星通信设备等。某工厂利用铝土矿(主要成分为 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度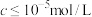 时,可认为已除尽。
时,可认为已除尽。
③金属离子氢氧化物的溶度积(25℃)
④ 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。
回答下列问题:
(1)写出元素镓在周期表中的位置______ ,其简化电子排布式为______ 。
(2)“焙烧”后所得产物主要有______ (写化学式)。
(3)“一次酸化”的目的是______ 。
(4)“二次酸化”中 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式______ 。
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式______ 。
(7)25℃时,已知: 可溶于氨水中,
可溶于氨水中,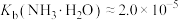 ,反应
,反应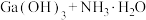
 的平衡常数
的平衡常数 ,计算反应
,计算反应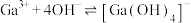 的平衡常数
的平衡常数
______ 。
 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度
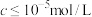 时,可认为已除尽。
时,可认为已除尽。③金属离子氢氧化物的溶度积(25℃)
|
|
| |
|
|
|
|
 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。回答下列问题:
(1)写出元素镓在周期表中的位置
(2)“焙烧”后所得产物主要有
(3)“一次酸化”的目的是
(4)“二次酸化”中
 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式
(7)25℃时,已知:
 可溶于氨水中,
可溶于氨水中,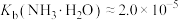 ,反应
,反应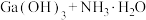
 的平衡常数
的平衡常数 ,计算反应
,计算反应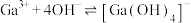 的平衡常数
的平衡常数
您最近一年使用:0次