解题方法
1 . 二氧化硫脲[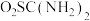 ](
](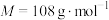 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
①滤液b主要成份为硫脲[ ](
](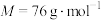 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。
②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[ ]。
]。
请回答:
(1)仪器Y的名称是________________ 。
(2)下列说法正确的是 。
(3)装置A的气密性检查操作为___________ 。
(4)请写出溶液b生成二氧化硫脲的化学方程式_____________ 。
(5)步骤5中将溶液温度下降到5℃的目的是______________ 。
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。
涉及到的反应有:
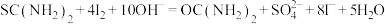
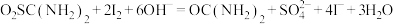

②另取0.1000g产品,加入50.00mL 0.1000 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。
涉及到的反应有:
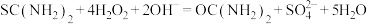


该产品中二氧化硫脲的质量分数为____________ 。
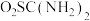 ](
](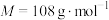 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下: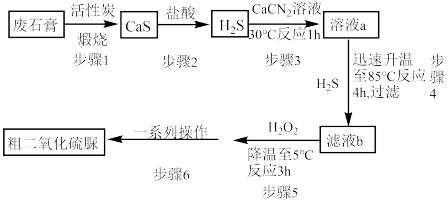

①滤液b主要成份为硫脲[
 ](
](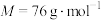 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[
 ]。
]。请回答:
(1)仪器Y的名称是
(2)下列说法正确的是 。
A.装置B中装的X溶液为饱和 溶液 溶液 |
B.装置E中的 与 与 发生氧化还原反应,起到尾气处理的作用 发生氧化还原反应,起到尾气处理的作用 |
| C.装置F中可分多次加入碳酸氢铵,以提高二氧化硫脲的产率 |
| D.步骤6“一系列操作”可为减压过滤,用冷水洗涤沉淀2-3次,一定温度下烘干沉淀 |
(3)装置A的气密性检查操作为
(4)请写出溶液b生成二氧化硫脲的化学方程式
(5)步骤5中将溶液温度下降到5℃的目的是
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500
 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。涉及到的反应有:
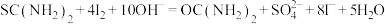
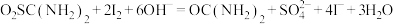

②另取0.1000g产品,加入50.00mL 0.1000
 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。涉及到的反应有:
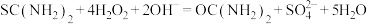


该产品中二氧化硫脲的质量分数为
您最近一年使用:0次
解题方法
2 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制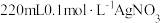 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: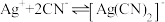 ,
,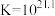 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是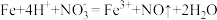 和
和___________ (用离子方程式表示,已知氧化性: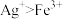 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中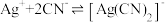 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为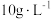 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为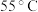 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由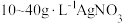 溶液和
溶液和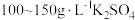 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: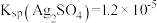 。
。
I.实验准备。
(1)用
 固体配制
固体配制 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
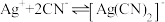 ,
,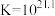 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的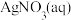 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
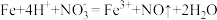 和
和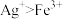 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
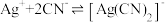 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(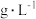 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为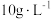 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
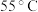 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
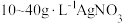 溶液和
溶液和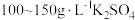 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
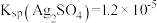 。
。
您最近一年使用:0次
2024-04-16更新
|
346次组卷
|
5卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
3 . 钡盐沉淀法处理酸性含铬废水(含 、[Ni(CN)4]2-、
、[Ni(CN)4]2-、 等)并回收铬元素的工艺路线如下:
等)并回收铬元素的工艺路线如下: +H2O
+H2O 2
2 +2H+
+2H+
II.室温下相关物质的Ksp如下:
(1)向废水中加入破氰剂NaClO,可以提高镍元素的去除率。①NaClO能氧化CN-,生成无毒无味气体,补全该反应的离子方程式:_____ 。
□CN-+□_____+□_____=□ +□_____+□_____
+□_____+□_____
②结合平衡移动原理解释加入NaClO可提高镍元素的去除率的原因:_____ 。
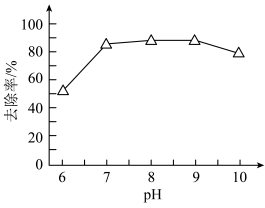
(2)用石灰乳将含铬废水预调至不同pH,经破氰后取等量的溶液1,向其中加入等量的BaCl2·2H2O,搅拌、反应60min,得到Cr(VI)去除率随预调pH变化如图。与预调pH=6相比,pH=7时Cr(VI)的去除率显著提高,可能的原因有_____ (写出两条)。_____ 。
(4)溶液2需处理至Ba2+含量达标后方可排放。可用如下方法测定废水中Ba2+含量。
步骤1:取aL含Ba2+废水,浓缩至100mL后,加入过量的Na2CrO4标准溶液,充分反应后过滤,向滤液中加入指示剂,用0.1mol·L−1HCl标准溶液滴定至CrO 全部转化为Cr2O
全部转化为Cr2O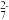 ,消耗HCl标准溶液的体积为bmL。
,消耗HCl标准溶液的体积为bmL。
步骤2:取100mL蒸馏水,加入与步骤1中等量的Na2CrO4标准溶液,加入指示剂,用0.1mol·L−1HCl标准溶液滴定,消耗HCl标准溶液的体积为cmL。
①步骤1中加入的Na2CrO4标准溶液必须过量,目的是_____ 。
②若废水中其他杂质不参与反应,则废水中Ba2+的含量为_____ mg·L−1(写出表达式)。
 、[Ni(CN)4]2-、
、[Ni(CN)4]2-、 等)并回收铬元素的工艺路线如下:
等)并回收铬元素的工艺路线如下:
 +H2O
+H2O 2
2 +2H+
+2H+II.室温下相关物质的Ksp如下:
| 化合物 | CaSO4 | BaSO4 | BaCrO4 |
| Ksp | 4.9×10-5 | 1.1×10-10 | 1.2×10-10 |
(1)向废水中加入破氰剂NaClO,可以提高镍元素的去除率。①NaClO能氧化CN-,生成无毒无味气体,补全该反应的离子方程式:
□CN-+□_____+□_____=□
 +□_____+□_____
+□_____+□_____②结合平衡移动原理解释加入NaClO可提高镍元素的去除率的原因:
(2)用石灰乳将含铬废水预调至不同pH,经破氰后取等量的溶液1,向其中加入等量的BaCl2·2H2O,搅拌、反应60min,得到Cr(VI)去除率随预调pH变化如图。与预调pH=6相比,pH=7时Cr(VI)的去除率显著提高,可能的原因有
(4)溶液2需处理至Ba2+含量达标后方可排放。可用如下方法测定废水中Ba2+含量。
步骤1:取aL含Ba2+废水,浓缩至100mL后,加入过量的Na2CrO4标准溶液,充分反应后过滤,向滤液中加入指示剂,用0.1mol·L−1HCl标准溶液滴定至CrO
 全部转化为Cr2O
全部转化为Cr2O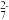 ,消耗HCl标准溶液的体积为bmL。
,消耗HCl标准溶液的体积为bmL。步骤2:取100mL蒸馏水,加入与步骤1中等量的Na2CrO4标准溶液,加入指示剂,用0.1mol·L−1HCl标准溶液滴定,消耗HCl标准溶液的体积为cmL。
①步骤1中加入的Na2CrO4标准溶液必须过量,目的是
②若废水中其他杂质不参与反应,则废水中Ba2+的含量为
您最近一年使用:0次
2024-04-13更新
|
596次组卷
|
3卷引用:2023-2024学年海淀区第二学期期中考试高三化学试卷
2023-2024学年海淀区第二学期期中考试高三化学试卷(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)北京市海淀区2023-2024学年高三下学期期中练习化学试题
4 . 某实验小组探究KMnO4溶液与NH3以及铵盐溶液的反应。
已知: 的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
下列说法不正确 的是
已知:
 的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。| 实验 | 序号 | 试剂a | 实验现象 |
| Ⅰ | 8mol·L-1氨水(pH≈13) | 紫色变浅,底部有棕黑色沉淀 |
| Ⅱ | 0.1mol·L-1NaOH溶液 | 无明显变化 | |
| Ⅲ | 4mol·L-1(NH4)2SO4溶液(pH≈6) | 紫色略变浅,底部有少量棕黑色沉淀 | |
| Ⅳ | 硫酸酸化的4mol·L-1(NH4)2SO4溶液(pH≈1) | 紫色变浅 | |
| Ⅴ | 硫酸酸化的4mol·L-1NH4Cl溶液(pH≈1) | 紫色褪去 |
A.由Ⅱ可知,pH=13时,OH-不能还原 |
B.由Ⅰ、Ⅱ、Ⅲ可知,与 相比,NH3更易还原 相比,NH3更易还原 |
C.由Ⅲ、Ⅳ可探究溶液pH对 与 与 反应的影响 反应的影响 |
D.由Ⅳ、Ⅴ可知, 浓度降低,其还原性增强 浓度降低,其还原性增强 |
您最近一年使用:0次
2024-04-13更新
|
407次组卷
|
4卷引用:2023-2024学年海淀区第二学期期中考试高三化学试卷
名校
解题方法
5 . 硫酸铜可用于游泳池消毒,工业上一种利用含铜矿石(主要含 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示:
(1)为了提高“焙烧”的反应速率,可采取的措施为__________ (任写一种即可)。
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、 ),
), 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
(3)“酸溶”后,溶液中的金属阳离子有__________ ;“滤渣a”用途为__________ (任写一点即可)。
(4)“转化”时发生反应的离子方程式为__________ ,不能将双氧水替换为硝酸的原因是__________ ,“一系列操作”包括蒸发浓缩、__________ 、过滤、干燥。
(5)硫酸铜晶体(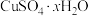 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为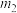 ,则结晶水
,则结晶水
__________ (用字母表示)。
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为 ,晶胞参数为
,晶胞参数为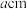 。
。
①O的配位数为__________ 。
②阿伏加德罗常数=__________ (用含 、a的字母表示)。
、a的字母表示)。
 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示: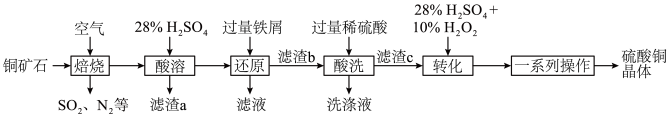
(1)为了提高“焙烧”的反应速率,可采取的措施为
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、
 ),
), 发生反应的化学方程式为
发生反应的化学方程式为(3)“酸溶”后,溶液中的金属阳离子有
(4)“转化”时发生反应的离子方程式为
(5)硫酸铜晶体(
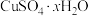 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为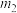 ,则结晶水
,则结晶水
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为
 ,晶胞参数为
,晶胞参数为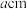 。
。①O的配位数为
②阿伏加德罗常数=
 、a的字母表示)。
、a的字母表示)。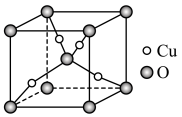
您最近一年使用:0次
2024-04-10更新
|
195次组卷
|
3卷引用:甘肃省2024届高三普通高中三模化学试卷
6 . 我国科学家设计的化学链重整联合CO2捕集制H2系统如下图所示:
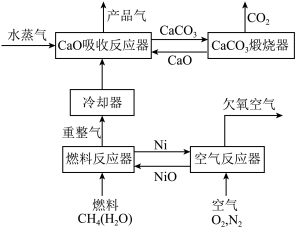
(1)空气反应器中发生___________ 反应(填“吸热”或“放热”)。
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有___________ 。
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =___________ 。
② 反应温度对H2产率(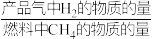 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
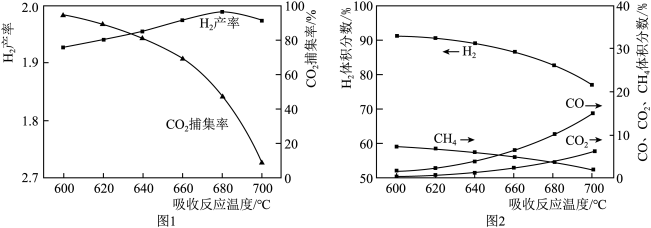
结合化学方程式说明图1中温度升高CO2捕集率降低的原因___________ ;解释图2中温度升高H2体积分数降低的原因___________ 。
(4)燃料反应器和吸收反应器中加入水蒸气的作用___________ 。

(1)空气反应器中发生
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =
② 反应温度对H2产率(
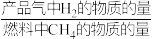 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
结合化学方程式说明图1中温度升高CO2捕集率降低的原因
(4)燃料反应器和吸收反应器中加入水蒸气的作用
您最近一年使用:0次
解题方法
7 . 一种从水钴矿(含 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
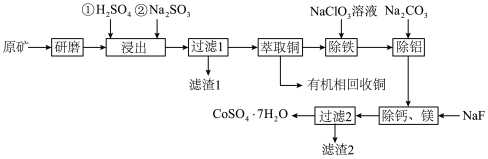
请回答下列问题:
(1)“研磨”的目的是___________ 。
(2)“浸出”时, 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
(3)滤渣1的成分是___________ 。
(4)“除铁”时, 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为___________ ;“除铝”时加入 的目的是
的目的是___________ 。
(5)已知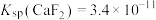 ,
,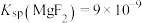 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中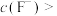
___________  。
。
(6)由“过滤2”后的母液得到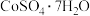 的操作是
的操作是___________ ,___________ 、过滤、洗涤、干燥。
 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是
(2)“浸出”时,
 被浸出的化学方程式为
被浸出的化学方程式为(3)滤渣1的成分是
(4)“除铁”时,
 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为 的目的是
的目的是(5)已知
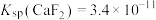 ,
,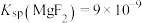 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中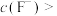
 。
。(6)由“过滤2”后的母液得到
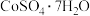 的操作是
的操作是
您最近一年使用:0次
解题方法
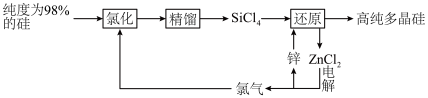
8 . 多晶硅的生产工艺方法主要是改良西门子法,该方法安全可靠,产品纯度高,但是生产成本较高.锌还原法成本低,但制备的多晶硅纯度不高,某研究所对锌还原法进行了研究改良,并成功制得了高纯多晶硅.改良后的锌还原法制备高纯多晶硅的主要流程如图,请回答下列问题: 和焦炭在
和焦炭在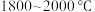 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为___________ ,该反应的氧化产物为___________ (填化学式).高纯硅常用作半导体材料,下列可用作半导体材料的是___________ (填标号).
A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成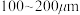 的粉末,这样做的目的是
的粉末,这样做的目的是___________ ;“精馏”可获得纯度为99.99%以上的高纯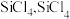 的电子式为
的电子式为___________ ;
(3)“还原”时的温度约为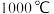 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;“电解”时,熔融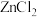 被电解成
被电解成 和
和 ,由此可知
,由此可知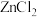 属于
属于___________ (填“离子”或“共价”)化合物,“电解”反应中,每消耗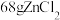 ,则生成
,则生成___________ L(换算成标准状况) 。
。
 和焦炭在
和焦炭在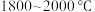 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成
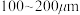 的粉末,这样做的目的是
的粉末,这样做的目的是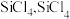 的电子式为
的电子式为(3)“还原”时的温度约为
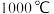 ,该反应的化学方程式为
,该反应的化学方程式为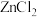 被电解成
被电解成 和
和 ,由此可知
,由此可知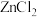 属于
属于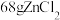 ,则生成
,则生成 。
。
您最近一年使用:0次
2024-04-04更新
|
40次组卷
|
2卷引用:广西桂林市恭城瑶族自治县民族高级中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
9 . 溴及其化合物广泛应用于医药、农药和阻燃剂等生产中。一种利用空气吹出法从海水中提取溴的工艺流程如下。
浓缩海水 酸化海水
酸化海水 含溴空气
含溴空气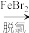
 含溴溶液
含溴溶液 产品溴
产品溴
已知:i.与Na2CO3反应时,Br2转化为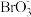 和Br-。
和Br-。
ii.HBrO3为强酸。
下列说法不正确的是
浓缩海水
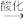 酸化海水
酸化海水 含溴空气
含溴空气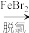
 含溴溶液
含溴溶液 产品溴
产品溴已知:i.与Na2CO3反应时,Br2转化为
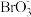 和Br-。
和Br-。ii.HBrO3为强酸。
下列说法不正确的是
| A.酸化海水通入Cl2提取溴的反应:Cl2+2Br-=2Cl-+Br2 |
B.脱氯过程脱除1molCl2可能消耗 molFeBr2 molFeBr2 |
C.用Na2CO3溶液吸收足量Br2蒸气后,所得产物中的含碳粒子主要是 |
| D.H2SO4酸化后重新得到Br2的反应中氧化剂和还原剂的物质的量比为1:5 |
您最近一年使用:0次
解题方法
10 . 某实验小组为探究 与
与 的反应,设计如下实验:将
的反应,设计如下实验:将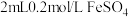 溶液和
溶液和
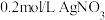 溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。
溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。
回答下列问题:
(1)甲同学根据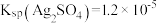 ,推测试管底部的灰色沉淀中有
,推测试管底部的灰色沉淀中有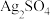 ,写出生成
,写出生成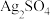 的离子方程式
的离子方程式___________ 。
(2)乙同学依据“上层清液呈黄色”,推测上层清液中含有 。
。
①将 氧化成
氧化成 的物质可能是:
的物质可能是: 、
、 或
或__________ (填化学式)。
②实验证明, 氧化
氧化 是主因,通过计算作出分析
是主因,通过计算作出分析_________ ,写出该反应的离子方程式____________ 。
(已知:以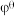 表示标准态(
表示标准态( )时的电极电势,当
)时的电极电势,当 ,反应可以自发进行;
,反应可以自发进行;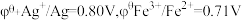 )
)
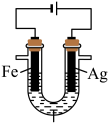
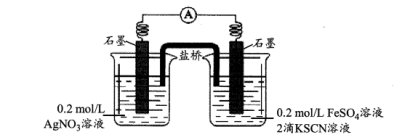
③乙同学又通过设计如图所示的原电池装置进行探究,当观察到__________ 现象时,证明 氧化了
氧化了 。
。
(3)丙同学为了定量研究试管底部灰色固体(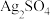 和
和 )的组成,设计了如下操作流程。
)的组成,设计了如下操作流程。
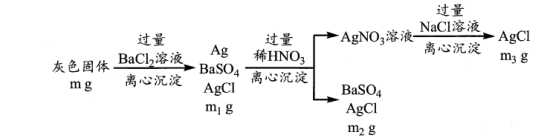
①离心沉淀相比于传统沉淀的优点是____________________ 。
②计算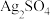 的质量分数
的质量分数____________________ 。(用流程中的字母表示,列出一个计算式即可)
 与
与 的反应,设计如下实验:将
的反应,设计如下实验:将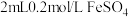 溶液和
溶液和
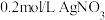 溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。
溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。回答下列问题:
(1)甲同学根据
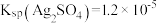 ,推测试管底部的灰色沉淀中有
,推测试管底部的灰色沉淀中有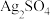 ,写出生成
,写出生成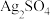 的离子方程式
的离子方程式(2)乙同学依据“上层清液呈黄色”,推测上层清液中含有
 。
。①将
 氧化成
氧化成 的物质可能是:
的物质可能是: 、
、 或
或②实验证明,
 氧化
氧化 是主因,通过计算作出分析
是主因,通过计算作出分析(已知:以
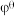 表示标准态(
表示标准态( )时的电极电势,当
)时的电极电势,当 ,反应可以自发进行;
,反应可以自发进行;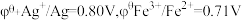 )
)③乙同学又通过设计如图所示的原电池装置进行探究,当观察到
 氧化了
氧化了 。
。
(3)丙同学为了定量研究试管底部灰色固体(
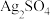 和
和 )的组成,设计了如下操作流程。
)的组成,设计了如下操作流程。
①离心沉淀相比于传统沉淀的优点是
②计算
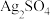 的质量分数
的质量分数
您最近一年使用:0次