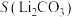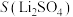名校
1 . FeOOH在生产生活中有广泛应用。
I.用硫酸渣(主要成分为 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。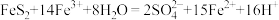 ;
; 、
、 均与
均与 不反应。
不反应。
(1)基态 价层电子排布式为
价层电子排布式为___________ 。
(2)“还原”时还原产物与氧化产物的物质的量之比为___________ 。
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为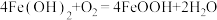 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:___________ 。
II. 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(4)在80℃下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备1mol 理论上需要
理论上需要 的物质的量为
的物质的量为___________ mol;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(5) 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。 分子中的共价键的物质的量为
分子中的共价键的物质的量为___________ mol。
②写出反应II的化学方程式:___________ 。
I.用硫酸渣(主要成分为
 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。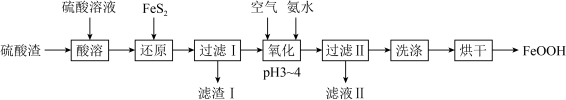
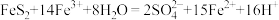 ;
; 、
、 均与
均与 不反应。
不反应。(1)基态
 价层电子排布式为
价层电子排布式为(2)“还原”时还原产物与氧化产物的物质的量之比为
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。
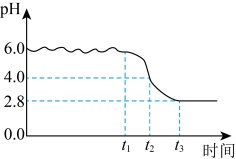
 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为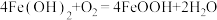 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:II.
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(4)在80℃下,向
 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备1mol
 理论上需要
理论上需要 的物质的量为
的物质的量为 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(5)
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。
 分子中的共价键的物质的量为
分子中的共价键的物质的量为②写出反应II的化学方程式:
您最近一年使用:0次
2024-06-16更新
|
58次组卷
|
2卷引用:江苏省南通市海安高级中学2023-2024学年高一下学期期中考试化学试题
名校
2 . 天然气中的 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:________________ .当消耗标准状况下22.4L富氧空气时,有________ mol电子转移。
 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
您最近一年使用:0次
名校
3 . 研究氮及其化合物的性质对改善人类的生存环境具有重要意义。回答下列问题:
(1)氨气是氮的最简单氢化物,电子式为_______ ,其水溶液呈_______ (填“酸性”、“中性”或“碱性”)。
(2)①以氨气为原料可制得铵态氮肥。下列属于铵态氮肥的是_______ (填选项字母)。
A.硝酸钾 B. C.尿素
C.尿素 D.碳铵
D.碳铵
② 常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的
常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的 溶液480 mL,需要称量
溶液480 mL,需要称量 固体的质量为
固体的质量为_______ g。
(3)在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出 消除
消除 的化学反应方程式:
的化学反应方程式:_______ 。
(4)亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
途径一: 加热到380℃分解,原理为
加热到380℃分解,原理为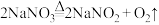 ;
;
途径二:NaOH溶液吸收NO、 气体。
气体。
①写出途径二反应的离子方程式:_______ 。
②制备等量的 ,途径一与途径二转移电子的物质的量之比为
,途径一与途径二转移电子的物质的量之比为_______ 。
(1)氨气是氮的最简单氢化物,电子式为
(2)①以氨气为原料可制得铵态氮肥。下列属于铵态氮肥的是
A.硝酸钾 B.
 C.尿素
C.尿素 D.碳铵
D.碳铵②
 常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的
常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的 溶液480 mL,需要称量
溶液480 mL,需要称量 固体的质量为
固体的质量为(3)在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出
 消除
消除 的化学反应方程式:
的化学反应方程式:(4)亚硝酸钠(
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。途径一:
 加热到380℃分解,原理为
加热到380℃分解,原理为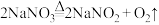 ;
;途径二:NaOH溶液吸收NO、
 气体。
气体。①写出途径二反应的离子方程式:
②制备等量的
 ,途径一与途径二转移电子的物质的量之比为
,途径一与途径二转移电子的物质的量之比为
您最近一年使用:0次
名校
解题方法
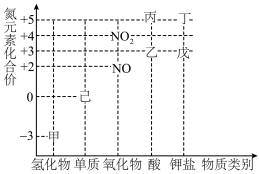
4 . 物质类别与元素化合价是研究物质性质的两个视角,下列是氮元素及其化合物的“价类二维图”。根据要求回答下列问题:___________ ,丁与硫黄、木炭混合即为黑火药,黑火药的爆炸反应为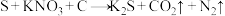 (未配平)。该反应中氧化剂与还原剂的物质的量之比为
(未配平)。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)在含有1.0mol丙的稀溶液中慢慢加入28g的铁粉,反应分为两个阶段。第一阶段的离子反应方程式为___________ ,第二阶段离子反应: 。
。
(3)甲和 在一定条件下发生反应,产物之一为己,该反应的化学方程式为
在一定条件下发生反应,产物之一为己,该反应的化学方程式为___________ 。
(4)戊在酸性条件下,与 按物质的量之比
按物质的量之比 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式:
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式:___________ 。
(5)某化学兴趣小组拟利用下列装置,在实验室中制取并收集干燥的甲气体。__________ →b(按从左到右的气流方向)。
②利用装置Ⅰ制取甲气体,可以选用浓氨水和生石灰,反应的化学方程式为___________ 。
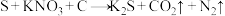 (未配平)。该反应中氧化剂与还原剂的物质的量之比为
(未配平)。该反应中氧化剂与还原剂的物质的量之比为(2)在含有1.0mol丙的稀溶液中慢慢加入28g的铁粉,反应分为两个阶段。第一阶段的离子反应方程式为
 。
。(3)甲和
 在一定条件下发生反应,产物之一为己,该反应的化学方程式为
在一定条件下发生反应,产物之一为己,该反应的化学方程式为(4)戊在酸性条件下,与
 按物质的量之比
按物质的量之比 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式:
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式:(5)某化学兴趣小组拟利用下列装置,在实验室中制取并收集干燥的甲气体。

②利用装置Ⅰ制取甲气体,可以选用浓氨水和生石灰,反应的化学方程式为
您最近一年使用:0次
解题方法
5 .  的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),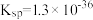
(1)装置A中发生的化学反应方程式是_______ 。
(2)加入药品前,检验装置气密性,方法是_______ 。
(3)装置B的作用是_______ 。
(4)实验Ⅲ中生成黑色沉淀的离子方程式是_______ 。
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
① 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离_______ 。
②完善下列离子方程式:_______ 。
_______ _______
_______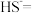 _______
_______ _______
_______ _______。
_______。
结论:实验Ⅱ的pH比实验Ⅰ的小, 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。
(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是_______ 。
(7)实验Ⅰ充分反应后,测 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为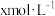 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中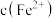 还需要的实验数据:
还需要的实验数据:___ 。
 的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),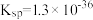
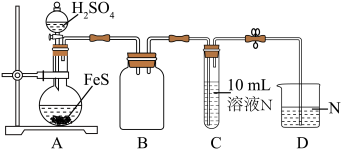
| 序号 | 溶液N | C中实验现象 |
| Ⅰ | 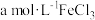 溶液( 溶液( ) ) | 溶液颜色变浅,有乳白色沉淀生成 |
| Ⅱ | 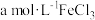 溶液(含少量稀 溶液(含少量稀 , ,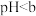 ) ) | 溶液颜色变浅,有乳白色沉淀生成,沉淀比实验Ⅰ少 |
| Ⅲ | 一定浓度的 溶液 溶液 | 溶液颜色变浅,有黑色沉淀生成 |
| Ⅳ | 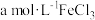 (含有一定浓度的 (含有一定浓度的 溶液, 溶液,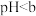 ) ) | 溶液颜色变浅,先有黑色沉淀生成,一段时间后转化为乳白色,沉淀比实验Ⅰ多 |
(1)装置A中发生的化学反应方程式是
(2)加入药品前,检验装置气密性,方法是
(3)装置B的作用是
(4)实验Ⅲ中生成黑色沉淀的离子方程式是
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
①
 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离②完善下列离子方程式:
_______
 _______
_______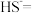 _______
_______ _______
_______ _______。
_______。结论:实验Ⅱ的pH比实验Ⅰ的小,
 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是
(7)实验Ⅰ充分反应后,测
 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为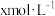 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中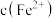 还需要的实验数据:
还需要的实验数据:
您最近一年使用:0次
名校
解题方法
6 . 碲(Te)常用于冶金工业,也是石油裂解的催化剂。工业上常以碲铜废料(主要成分是 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下: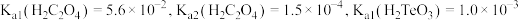 ,
,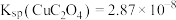 。
。
(1) 中碲元素的化合价为
中碲元素的化合价为_______ 。碲在元素周期表中的位置为_______ 。
(2)“氧化酸浸”得到 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)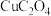 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为_______ 。(保留两位有效数字){已知:反应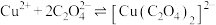 的平衡常数
的平衡常数 }
}
(4)“还原”在 50 ℃条件下进行: ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为_______ 。
(5)“还原”时, 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有_______ 。
(6)将一定质量的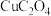 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为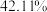 ,则剩余固体的化学式为
,则剩余固体的化学式为_______ 。
 )为原料提取碲,其工艺流程如下:
)为原料提取碲,其工艺流程如下:
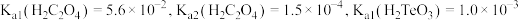 ,
,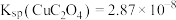 。
。(1)
 中碲元素的化合价为
中碲元素的化合价为(2)“氧化酸浸”得到
 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(3)
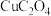 可溶于
可溶于 ,反应
,反应 的平衡常数为
的平衡常数为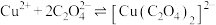 的平衡常数
的平衡常数 }
}(4)“还原”在 50 ℃条件下进行:
 ,反应中还原产物和氧化产物的物质的量之比为
,反应中还原产物和氧化产物的物质的量之比为(5)“还原”时,
 的实际投入量大于理论量,其可能原因有
的实际投入量大于理论量,其可能原因有(6)将一定质量的
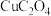 置于
置于 气中热解,测得剩余固体的质量与原始固体的质量的比值约为
气中热解,测得剩余固体的质量与原始固体的质量的比值约为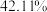 ,则剩余固体的化学式为
,则剩余固体的化学式为
您最近一年使用:0次
名校
解题方法
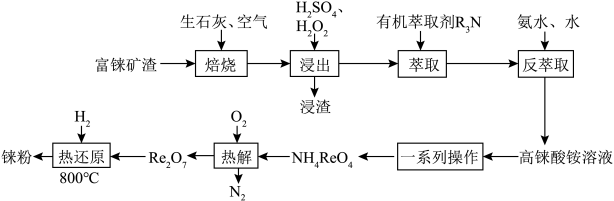
7 . 铼是一种稀有贵重金属,广泛用于制造飞机、卫星和火箭的外壳等。工业上一种利用富铼矿渣(主要成分ReS2)提取铼的工艺流程如图所示:
②Re2O7是酸性氧化物,HReO4的性质与HClO4的性质相似;高铼酸铵( )微溶于冷水,易溶于热水;
)微溶于冷水,易溶于热水;
③室温下, 。
。
回答下列问题:
(1)Re2O7与水反应的离子方程式为___________ ;室温下,加入氨水后,测得溶液pH约为11,则溶液中
___________ (填“>”“<”或“=”)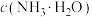 。
。
(2)“焙烧”时,空气从焙烧炉底部通入,粉碎后的矿渣从顶部加入,目的是___________ 。
(3)写出“热解”时发生反应的主要化学方程式:___________ 。
(4)测得制得的铼粉(含少量Re2O7)中Re与O的原子个数比为1∶0.35,则该产品的纯度为___________ %(保留三位有效数字)。
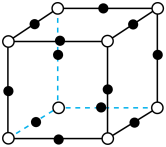
(5)已知ReO3的立方晶胞结构如图所示,则Re在晶胞中的位置为___________ ;晶体中一个Re周围与其最近的O的个数为___________ 。
②Re2O7是酸性氧化物,HReO4的性质与HClO4的性质相似;高铼酸铵(
 )微溶于冷水,易溶于热水;
)微溶于冷水,易溶于热水;③室温下,
 。
。回答下列问题:
(1)Re2O7与水反应的离子方程式为

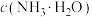 。
。(2)“焙烧”时,空气从焙烧炉底部通入,粉碎后的矿渣从顶部加入,目的是
(3)写出“热解”时发生反应的主要化学方程式:
(4)测得制得的铼粉(含少量Re2O7)中Re与O的原子个数比为1∶0.35,则该产品的纯度为
(5)已知ReO3的立方晶胞结构如图所示,则Re在晶胞中的位置为
您最近一年使用:0次
名校
解题方法
8 . 碳酸锂是制备锂电池的重要原料。一种由α—锂辉石(主要成分可用 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下: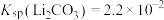 ,各离子沉淀pH范围:
,各离子沉淀pH范围:
回答下列问题:
(1)“煅烧”过程中 转化为
转化为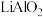 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式_______ 。
(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是_______ ;“调节pH”步骤应当控制的pH范围为_______ ,
(3)写出“除锰”过程中的离子反应方程式_______ 。若“除钙”后滤液中Li+浓度为0.2mol/L,则该步骤后 浓度应该低于
浓度应该低于_______ mol/L。
(4)已知 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:
“沉锂”后应该选择_______ ℃(选填“20”、“50”和“80”)蒸馏水洗涤,写出检验沉淀是否洗涤干净的操作_______ 。
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是_______ 。将碳酸锂与 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式_______ 。
 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
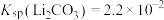 ,各离子沉淀pH范围:
,各离子沉淀pH范围:离子 |
|
|
|
|
开始沉淀pH | 7.6 | 2.7 | 3.8 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 5.2 | 9.8 |
(1)“煅烧”过程中
 转化为
转化为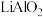 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是
(3)写出“除锰”过程中的离子反应方程式
 浓度应该低于
浓度应该低于(4)已知
 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:T/℃ | 20 | 50 | 80 |
| 1.33 | 1.10 | 0.85 |
| 34.2 | 32.5 | 30.7 |
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是
 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式
您最近一年使用:0次
2024-06-11更新
|
184次组卷
|
3卷引用:2024届四川省眉山市高三下学期第三次诊断考试理科综合试题 -高中化学
9 . 氮化钒(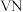 )作为一种有效、经济的合金添加剂被广泛应用。实验室探究制取氮化钒并测定所得氮化钒的纯度的实验装置如图(夹持装置略去)。
)作为一种有效、经济的合金添加剂被广泛应用。实验室探究制取氮化钒并测定所得氮化钒的纯度的实验装置如图(夹持装置略去)。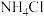 溶液与
溶液与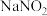 溶液反应制取
溶液反应制取 。
。
(1)检验装置的气密性方法是___________ 。
(2)制备氮化钒的一种方法为将 先用碳还原后再氮化,此法需将
先用碳还原后再氮化,此法需将 与焦炭混合放入石英管,关闭
与焦炭混合放入石英管,关闭___________ (填开关代号,下同),打开___________ 和真空泵,加热热电偶。
(3)氮化反应为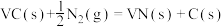 ,
,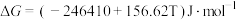 ,则此反应能自发进行的上限温度(反应截止温度)为
,则此反应能自发进行的上限温度(反应截止温度)为___________ K(T的单位为K)。氮化过程中,反应截止温度 还受氮气分压的影响,其影响如下图,则
还受氮气分压的影响,其影响如下图,则___________ (填“增大”或“减小”)氮气分压有利于氮化反应进行。 热还原时通入氮气使氮化反应同时进行,可以降低成本提高产率。此反应过程中,生成的
热还原时通入氮气使氮化反应同时进行,可以降低成本提高产率。此反应过程中,生成的 与
与 的物质的量比为3:1,则装置C中反应的化学方程式为
的物质的量比为3:1,则装置C中反应的化学方程式为___________ ,每生成 氮化钒,转移电子
氮化钒,转移电子___________  。
。
(5)向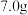 所得
所得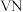 中加入足量
中加入足量 溶液,将产生的
溶液,将产生的 用
用 1mol/L
1mol/L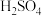 溶液恰好完全吸收生成正盐,则所得产品中
溶液恰好完全吸收生成正盐,则所得产品中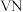 的质量分数为
的质量分数为___________ (结果保留三位有效数字)。
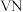 )作为一种有效、经济的合金添加剂被广泛应用。实验室探究制取氮化钒并测定所得氮化钒的纯度的实验装置如图(夹持装置略去)。
)作为一种有效、经济的合金添加剂被广泛应用。实验室探究制取氮化钒并测定所得氮化钒的纯度的实验装置如图(夹持装置略去)。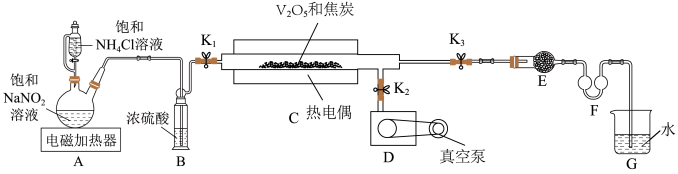
 溶液与
溶液与 溶液反应制取
溶液反应制取 。
。(1)检验装置的气密性方法是
(2)制备氮化钒的一种方法为将
 先用碳还原后再氮化,此法需将
先用碳还原后再氮化,此法需将 与焦炭混合放入石英管,关闭
与焦炭混合放入石英管,关闭(3)氮化反应为
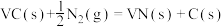 ,
,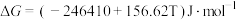 ,则此反应能自发进行的上限温度(反应截止温度)为
,则此反应能自发进行的上限温度(反应截止温度)为 还受氮气分压的影响,其影响如下图,则
还受氮气分压的影响,其影响如下图,则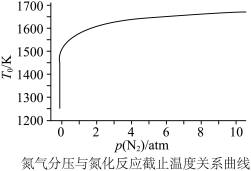
 热还原时通入氮气使氮化反应同时进行,可以降低成本提高产率。此反应过程中,生成的
热还原时通入氮气使氮化反应同时进行,可以降低成本提高产率。此反应过程中,生成的 与
与 的物质的量比为3:1,则装置C中反应的化学方程式为
的物质的量比为3:1,则装置C中反应的化学方程式为 氮化钒,转移电子
氮化钒,转移电子 。
。(5)向
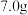 所得
所得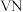 中加入足量
中加入足量 溶液,将产生的
溶液,将产生的 用
用 1mol/L
1mol/L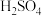 溶液恰好完全吸收生成正盐,则所得产品中
溶液恰好完全吸收生成正盐,则所得产品中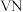 的质量分数为
的质量分数为
您最近一年使用:0次
10 . 对氯甲苯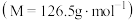 常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
I.CuCl沉淀的制备
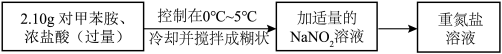
(1)将 、NaCl、
、NaCl、 、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。
、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。 俗称
俗称________ ,请写出该反应的离子方程式________ 。
Ⅱ.重氮盐溶液的制备 溶液过量可能带来的弊端是
溶液过量可能带来的弊端是________ ;可用尿素 将其除去,生成的气体无污染,请写出该反应的离子方程式
将其除去,生成的气体无污染,请写出该反应的离子方程式________ 。
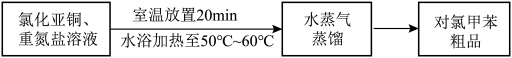
Ⅲ.对氯甲苯的制备________ ;________ (填序号)。
①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水
(4)CuCl催化机理分两步进行,请补充完整:________ 。
(5)对氯甲苯粗品经过精制后,得到1.50g产品,本实验的产率最接近于________(填标号)。
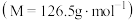 常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下: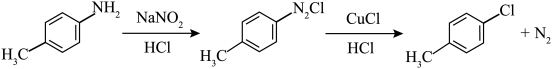
I.CuCl沉淀的制备
(1)将
 、NaCl、
、NaCl、 、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。
、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。 俗称
俗称Ⅱ.重氮盐溶液的制备
 溶液过量可能带来的弊端是
溶液过量可能带来的弊端是 将其除去,生成的气体无污染,请写出该反应的离子方程式
将其除去,生成的气体无污染,请写出该反应的离子方程式Ⅲ.对氯甲苯的制备
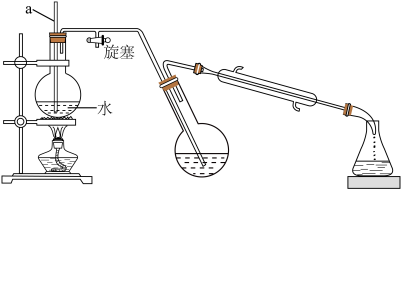
①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水
(4)CuCl催化机理分两步进行,请补充完整:
①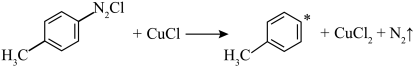
(5)对氯甲苯粗品经过精制后,得到1.50g产品,本实验的产率最接近于________(填标号)。
| A.55% | B.60% | C.65% | D.70% |
您最近一年使用:0次