名校
1 . 红树林沉积物中微生物驱动的硫循环过程原理如图所示,下列叙述错误的是
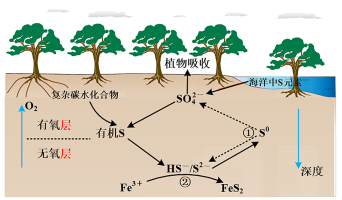
A.海洋中疏元素主要以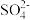 形式存在 形式存在 |
B.依据价态及图示分析,在无氧层,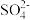 是重要的氧化剂 是重要的氧化剂 |
| C.硫循环与金属元素的耦合可以有效固定沉积物中的重金属元素 |
| D.反应①与反应②过程中硫元素均被氧化 |
您最近一年使用:0次
名校
2 . T℃时,某化学兴趣小组将1.0mL0.015mol/LKMnO4和1.5mol/LH2SO4的混合溶液与1.0mL0.15mol/L乙醛(CH3CHO)溶液混合后,得到c( )随时间变化的关系如图,已知反应原理为
)随时间变化的关系如图,已知反应原理为 +CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
+CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
 )随时间变化的关系如图,已知反应原理为
)随时间变化的关系如图,已知反应原理为 +CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
+CH3CHO+H+→Mn2++CH3COOH+H2O(未配平)。下列说法正确的是
| A.可用浓盐酸和KMnO4配制成酸性KMnO4溶液 |
B.30.0~50.0s内, 的平均速率为0.54mol/(L·h) 的平均速率为0.54mol/(L·h) |
| C.0~30s的平均反应速率大于30~50s的原因是0~30s内生成物的浓度更小 |
D.该实验中反应的离子方程式为2 +5CH3CHO+6H+=2Mn2++5CH3COOH+3H2O +5CH3CHO+6H+=2Mn2++5CH3COOH+3H2O |
您最近一年使用:0次
名校
解题方法
3 . I.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
(1)结合上表的数据,写出工业上合成氨反应的热化学方程式_______ 。分离器中压强约为15MPa,温度约为-20°C,分离氨应用了氨的_____ 性质。
(2)在吸收塔中不断补充空气的目的是_____ 。
(3)吸收塔中出来的尾气会含有NO、NO2等氮氧化物,为了防止污染空气,通常有以下两种方法处理:
①Na2CO3溶液吸收法:反应原理为NO+NO2 + Na2CO3 =___ +CO2 (请完成化学方程式);根据反应,每产生22.4L(标准状况下)CO2,吸收液质量将增加____ g。
②氨催化还原法。以NO2为例,NH3可将NO2还原为无污染N2,该反应的方程式为____ 。

| 共价键 | N≡N | H−H | N−H |
| 断开1 mol共价键所需能量(kJ) | 946 | 436 | 391 |
(1)结合上表的数据,写出工业上合成氨反应的热化学方程式
(2)在吸收塔中不断补充空气的目的是
(3)吸收塔中出来的尾气会含有NO、NO2等氮氧化物,为了防止污染空气,通常有以下两种方法处理:
①Na2CO3溶液吸收法:反应原理为NO+NO2 + Na2CO3 =
②氨催化还原法。以NO2为例,NH3可将NO2还原为无污染N2,该反应的方程式为
您最近一年使用:0次
名校
解题方法
4 . 以下是一系列非金属元素间的置换反应,其中不能说明反应前的非金属单质的氧化性强于产物中非金属单质的氧化性的是
A. | B.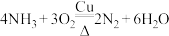 |
C. | D. |
您最近一年使用:0次
名校
解题方法
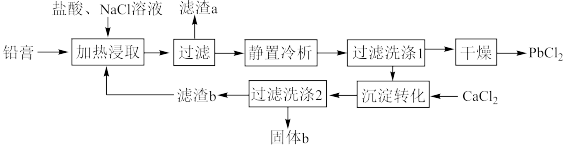
5 . 铅酸蓄电池是全球使用最广泛的化学电源,废铅酸蓄电池铅膏湿法回收铅的工艺研究是当前再生铅回收的重要研究方向,一种利用铅酸蓄电池中铅膏(主要成分为PbSO4、PbO,还含有一些不与流程中试剂反应的物质)制备PbCl2的工艺流程如图所示。请回答下列问题:
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为___________ (填“Pb”或“PbO2”),正极的电极反应式为___________ ;写出提高“加热浸取”速率的一种方法:___________ 。
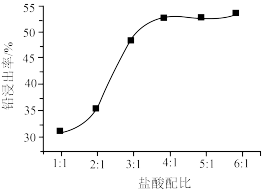
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为___________ ;盐酸配比(盐酸配比是指盐酸实际用量与理论用量之比)对铅浸出率的影响如图所示,则工业上一般选择的盐酸配比为___________ ,选择该配比的原因是___________ 。___________ ;“过滤洗涤1”时,可以用___________ (填标号)检验PbCl2是否洗涤干净;“沉淀转化”的目的是降低滤液b中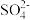 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为___________ (填化学式)。
A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为
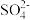 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
您最近一年使用:0次
6 . 常温下,往烧杯中加入10mL1mol/LFeCl3溶液和10mL2mol/LKI溶液,c(I-)随时间变化如图所示,不考虑溶液混合时体积的改变。下列说法正确的是
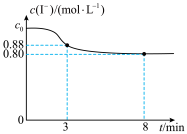
| A.c0=2 |
| B.3~8min内,Fe3+的平均反应速率为0.08mol/(L·min) |
| C.8min时,往烧杯中滴加KSCN溶液,溶液不变红 |
D.烧杯中发生反应的离子方程式为2Fe3++2I- 2Fe2++I2 2Fe2++I2 |
您最近一年使用:0次
名校
解题方法
7 . 按要求写出下列反应的方程式:
(1)实验室制氨气的化学方程式:___________ 。
(2)浓硝酸久置呈黄色的原因用化学方程式解释:___________ 。
(3)工业制粗硅的化学方程式:___________ 。
(4)往硅酸钠溶液中通入过量二氧化碳的离子方程式:___________ 。
(5) 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:___________ 。
(6)澄清石灰水中通入少量 的离子方程式:
的离子方程式:___________ 。
(7)银锌电池是一种常见的化学电源,其反应原理: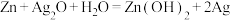 ,其工作原理如图所示。
,其工作原理如图所示。 电极反应式为
电极反应式为___________ 。
(8)将用导线相连的两个铂电极插入 溶液中,然后向两极分别通入
溶液中,然后向两极分别通入 和
和 ,则发生了原电池反应,该原电池中的负极反应式为
,则发生了原电池反应,该原电池中的负极反应式为___________ 。
(1)实验室制氨气的化学方程式:
(2)浓硝酸久置呈黄色的原因用化学方程式解释:
(3)工业制粗硅的化学方程式:
(4)往硅酸钠溶液中通入过量二氧化碳的离子方程式:
(5)
 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:(6)澄清石灰水中通入少量
 的离子方程式:
的离子方程式:(7)银锌电池是一种常见的化学电源,其反应原理:
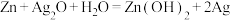 ,其工作原理如图所示。
,其工作原理如图所示。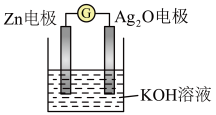
 电极反应式为
电极反应式为(8)将用导线相连的两个铂电极插入
 溶液中,然后向两极分别通入
溶液中,然后向两极分别通入 和
和 ,则发生了原电池反应,该原电池中的负极反应式为
,则发生了原电池反应,该原电池中的负极反应式为
您最近一年使用:0次
解题方法
8 . 下列反应不符合哲学中“量变引起质变”观点的是
| A.锌与硫酸 | B.FeBr2溶液和氯水 |
| C.铜和硝酸 | D.氨气和氯化氢 |
您最近一年使用:0次
解题方法
9 . 草酸(H2C2O4)、草酸铵[(NH4)2C2O4]是重要的化合物。回答下列问题:
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:_______________ (装置可重复利用)。装置F中发生的化学反应方程式为_______________ 。
②能证明草酸晶体分解产物中有CO的现象是_______________ 。
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为 。该反应中,还原剂为
。该反应中,还原剂为______________ (填化学式),若称取mg草酸晶体(H2C2O4·2H2O)粗产品,配成100mL溶液于锥形瓶中,加入V mL a mol·L-1KMnO4溶液,恰好完全反应,则该草酸晶体的纯度为______________ %[M(H2C2O4·2H2O)=126g·mol-1]。
(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:______________ (填化学式)。
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示:_______________ ;“高温分解”需控制的最低温度为_______________ (经测定290~890℃过程中产生的气体只有CO2)。
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:
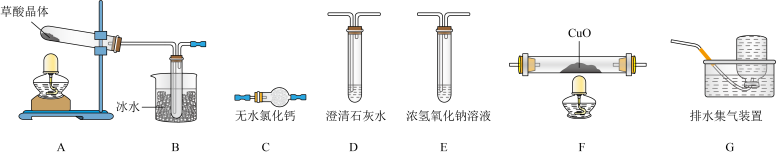
②能证明草酸晶体分解产物中有CO的现象是
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为
 。该反应中,还原剂为
。该反应中,还原剂为(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:
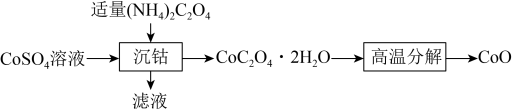
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示: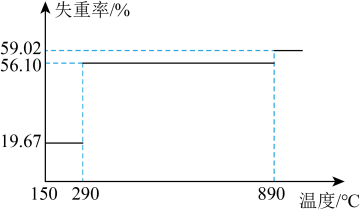
您最近一年使用:0次
10 . 下列关于氮及其化合物的叙述错误的是
| A.大多数铵盐易溶于水,在农业上常用作氮肥 |
| B.NO在化学反应中,既能做还原剂,又能做氧化剂 |
C. 为红棕色气体,因此将少量 为红棕色气体,因此将少量 通入水中,溶液显红棕色 通入水中,溶液显红棕色 |
D.在 与水的反应中氧化剂与还原剂的物质的量之比为1:2 与水的反应中氧化剂与还原剂的物质的量之比为1:2 |
您最近一年使用:0次



