1 . I.某些常见无机物质存在如图的化学转化关系(部分生成物和反应条件略去),回答下列问题:________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为________ ,当 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为________ 。
(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式________ 。戊是氢氧化物,既能和强酸反应又能和强碱反应,则甲的化学式为________ 。
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:____________ 。
(5)X的化学式为________ ,X能和浓盐酸反应生成黄绿色气体,X在反应中作________ (填“氧化剂”或“还原剂”),若反应了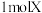 ,该反应转移电子的个数为
,该反应转移电子的个数为________ 。
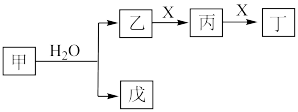
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为
 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水
 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题: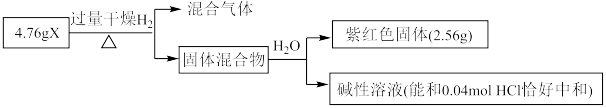
(5)X的化学式为
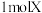 ,该反应转移电子的个数为
,该反应转移电子的个数为
您最近一年使用:0次
2 . 实验室可用干燥的氯气与亚氯酸钠 固体反应来制备
固体反应来制备 ,装置如图所示,已知
,装置如图所示,已知 常温下为黄绿色气体,熔点
常温下为黄绿色气体,熔点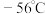 ,沸点
,沸点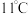 ,极易溶于水且不与水反应,高浓度的
,极易溶于水且不与水反应,高浓度的 受热时易爆炸,下列说法正确的是
受热时易爆炸,下列说法正确的是
 固体反应来制备
固体反应来制备 ,装置如图所示,已知
,装置如图所示,已知 常温下为黄绿色气体,熔点
常温下为黄绿色气体,熔点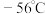 ,沸点
,沸点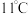 ,极易溶于水且不与水反应,高浓度的
,极易溶于水且不与水反应,高浓度的 受热时易爆炸,下列说法正确的是
受热时易爆炸,下列说法正确的是
| A.导气管K的作用是平衡气压,保证液体顺利流下 |
| B.C和F中可选用同一种物质 |
C.D中通入一定量的干燥空气,目的主要是将生成的 带入到E中,便于收集. 带入到E中,便于收集. |
D.D中发生的化学反应中氧化剂与还原剂的物质的量之比为 |
您最近一年使用:0次
3 . 用光催化技术,可将 在光照条件下分解为
在光照条件下分解为 和
和 ,该反应
,该反应
 在光照条件下分解为
在光照条件下分解为 和
和 ,该反应
,该反应| A.为复分解反应 | B.将化学能转化为太阳能 |
| C.过程中,电子由H转移到O | D.过程中, 既做氧化剂又做还原剂 既做氧化剂又做还原剂 |
您最近一年使用:0次
名校
解题方法
4 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)请写出硫在元素周期表的位置:___________ 。
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径: 转化成
转化成 的化学方程式:
的化学方程式:___________ 。
你认为减少酸雨产生的无效措施是___________ (填字母序号)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:___________ 。
(5)当观察到②中溶液颜色变浅时,①中的现象是___________ 。
(6)装置③的作用是___________ 。
(7)②中的现象说明二氧化硫具有的性质是___________ 。
(8)从氧化还原角度制备硫代硫酸钠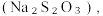 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。
(9)为进一步减少 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)请写出硫在元素周期表的位置:
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
A.热稳定性: | B.溶解度:  |
C.单质的熔点: | D.酸性:  |
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径:

 转化成
转化成 的化学方程式:
的化学方程式:你认为减少酸雨产生的无效措施是
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
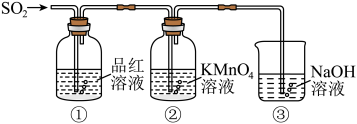
(5)当观察到②中溶液颜色变浅时,①中的现象是
(6)装置③的作用是
(7)②中的现象说明二氧化硫具有的性质是
(8)从氧化还原角度制备硫代硫酸钠
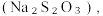 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。A.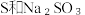 | B. 和浓 和浓 | C. 和 和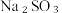 | D.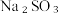 和 和 |
(9)为进一步减少
 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
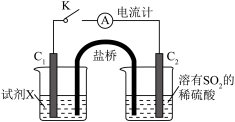
5 . 某小组按如下步骤探究二氧化硫与铜单质、Cu2+的反应:
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为___________ ,该反应中硫酸体现出的化学性质为___________ ;装置C的作用是___________ ,试剂m可选择___________ (填标号)。
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为___________ ;步骤ⅳ中发生反应的离子方程式为[CuCl3]2-⇌CuCl↓+2Cl-,下列有关该反应的说法正确的是___________ (填标号)。
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为___________ ;不考虑其他副反应及Cu2+进入盐桥,实验②中,电路中转移0.02mole-时,左侧烧杯溶液中Cu2+的质量减少___________ g。
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为
| 实验装置图 |
| ||
| 序号 | 试剂X | 实验现象 | |
| 电流计 | C1附近溶液 | ||
| ① | 0.1mol·L-1CuSO4溶液 | 指针几乎不偏转 | 无明显现象 |
| ② | 0.1mol·L-1NaCl和0.1mol·L-1CuSO4的混合溶液(足量) | 指针明显偏转 | 溶液变棕黄色 |
您最近一年使用:0次
名校
解题方法
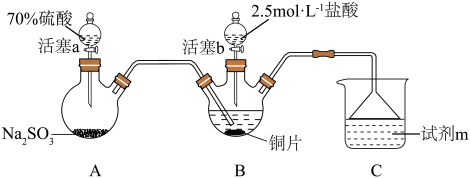
6 . 回答下列问题
(1)图1记录了1940~2000的60年间 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因______ 。 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:
①工业生产中的 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
碱液吸收法中沙及到的主要反应为: ,
, 。
。
若碱液回收尾气以后,溶液中 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为______ 。
氨还原法是在催化剂作用下,用 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为______ 、______ 。
若在相同条件下消耗的 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为______ 。
②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为______ 。
③结合社会生活中交通工具的变化,你认为 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?______ (请至少例举一条)
(1)图1记录了1940~2000的60年间
 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因
 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:①工业生产中的
 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。碱液吸收法中沙及到的主要反应为:
 ,
, 。
。若碱液回收尾气以后,溶液中
 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为氨还原法是在催化剂作用下,用
 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为若在相同条件下消耗的
 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为
③结合社会生活中交通工具的变化,你认为
 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?
您最近一年使用:0次
名校
7 . 红树林沉积物中微生物驱动的硫循环过程原理如图所示,下列叙述错误的是
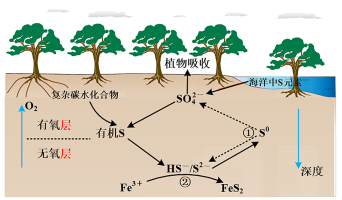
A.海洋中疏元素主要以 形式存在 形式存在 |
B.依据价态及图示分析,在无氧层, 是重要的氧化剂 是重要的氧化剂 |
| C.硫循环与金属元素的耦合可以有效固定沉积物中的重金属元素 |
| D.反应①与反应②过程中硫元素均被氧化 |
您最近一年使用:0次
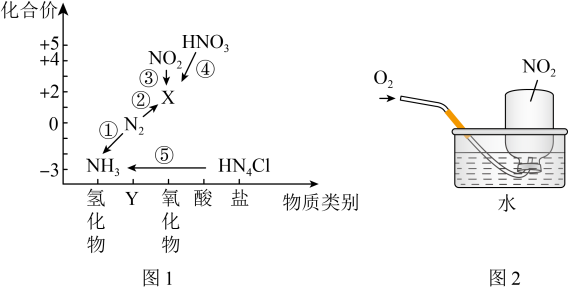
8 . 氮元素是高中化学学习的一种重要非金属元素,其价类二维图如图1所示。________ ,反应①~⑤中不属于氧化还原反应的是________ (填序号)。
(2)反应①中每消耗1mol氢气,转移电子________ mol。
(3)除去X中混有的少量 的方法是
的方法是________ 。
(4)工业以氨气为原料制备硝酸的第一步反应为氨的催化氧化,写出该反应的化学方程式________ 。
(5)用集气瓶收集 气体并倒置在水槽中,然后缓慢通入适量
气体并倒置在水槽中,然后缓慢通入适量 ,如图2所示。一段时间后,集气瓶中充满溶液。
,如图2所示。一段时间后,集气瓶中充满溶液。
①写出该过程总反应的化学方程式________ 。该实验对工业上生产硝酸的启示是________ 。
②假设该实验条件下,气体摩尔体积为 ,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为________ mol/L。
(2)反应①中每消耗1mol氢气,转移电子
(3)除去X中混有的少量
 的方法是
的方法是(4)工业以氨气为原料制备硝酸的第一步反应为氨的催化氧化,写出该反应的化学方程式
(5)用集气瓶收集
 气体并倒置在水槽中,然后缓慢通入适量
气体并倒置在水槽中,然后缓慢通入适量 ,如图2所示。一段时间后,集气瓶中充满溶液。
,如图2所示。一段时间后,集气瓶中充满溶液。①写出该过程总反应的化学方程式
②假设该实验条件下,气体摩尔体积为
 ,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
您最近一年使用:0次
名校
解题方法
9 . 海水是资源宝库,下图是对海水资源的综合利用的部分片段(其中某些操作或试剂已省略)。 、
、 、
、 等杂质离子,需加入NaOH、
等杂质离子,需加入NaOH、 和
和 试剂,其中加入
试剂,其中加入 的作用是
的作用是______ 。
据国家海洋信息中心提供的数据,每kg海水中各种离子的含量(已经折算成物质的量)如下表所示。
有同学认为在除杂试剂的选择上,可以用 代替
代替 和NaOH,这样可以起到一举两得的作用,你认为是否合理?
和NaOH,这样可以起到一举两得的作用,你认为是否合理?______ ,理由是______ 。
根据以上数据,至少可以判断海水中还存在没有列出的其它______ (填“阳离子”、“阴离子”)。
(2)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ将之转变成化合态的溴,其目的是______ 。
实验室模拟上述反应过程,将 水逐滴加到
水逐滴加到 溶液中,
溶液中, 水褪色,直至
水褪色,直至 不再褪色,未见有气泡产生;请写出
不再褪色,未见有气泡产生;请写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式______ 。
再仿照步骤Ⅲ,向上述试管里的溶液中加入硫酸酸化,溶液中有大量气体产生,同时溶液重新再现 水的橙黄色。此时产生的气体是
水的橙黄色。此时产生的气体是______ 。

 、
、 、
、 等杂质离子,需加入NaOH、
等杂质离子,需加入NaOH、 和
和 试剂,其中加入
试剂,其中加入 的作用是
的作用是据国家海洋信息中心提供的数据,每kg海水中各种离子的含量(已经折算成物质的量)如下表所示。
离子 | 物质的量含量(mol/kg) |
| 0.51 |
| 0.46 |
| 0.028 |
| 0.054 |
| 0.01 |
| -0.01 |
 代替
代替 和NaOH,这样可以起到一举两得的作用,你认为是否合理?
和NaOH,这样可以起到一举两得的作用,你认为是否合理?根据以上数据,至少可以判断海水中还存在没有列出的其它
(2)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ将之转变成化合态的溴,其目的是
实验室模拟上述反应过程,将
 水逐滴加到
水逐滴加到 溶液中,
溶液中, 水褪色,直至
水褪色,直至 不再褪色,未见有气泡产生;请写出
不再褪色,未见有气泡产生;请写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式再仿照步骤Ⅲ,向上述试管里的溶液中加入硫酸酸化,溶液中有大量气体产生,同时溶液重新再现
 水的橙黄色。此时产生的气体是
水的橙黄色。此时产生的气体是
您最近一年使用:0次
名校
解题方法
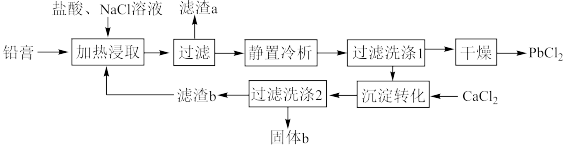
10 . 铅酸蓄电池是全球使用最广泛的化学电源,废铅酸蓄电池铅膏湿法回收铅的工艺研究是当前再生铅回收的重要研究方向,一种利用铅酸蓄电池中铅膏(主要成分为PbSO4、PbO,还含有一些不与流程中试剂反应的物质)制备PbCl2的工艺流程如图所示。请回答下列问题:
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为___________ (填“Pb”或“PbO2”),正极的电极反应式为___________ ;写出提高“加热浸取”速率的一种方法:___________ 。
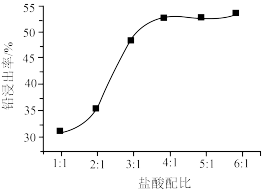
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为___________ ;盐酸配比(盐酸配比是指盐酸实际用量与理论用量之比)对铅浸出率的影响如图所示,则工业上一般选择的盐酸配比为___________ ,选择该配比的原因是___________ 。___________ ;“过滤洗涤1”时,可以用___________ (填标号)检验PbCl2是否洗涤干净;“沉淀转化”的目的是降低滤液b中 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为___________ (填化学式)。
A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为
 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
您最近一年使用:0次