解题方法
1 . 下列有关物质性质和用途的解释正确的是
| 性质或用途 | 解释 | |
| A |  制成的玻璃纤维被用于制造通信光缆 制成的玻璃纤维被用于制造通信光缆 |  导电能力强 导电能力强 |
| B | 工业上常用液氨作制冷剂 | 断裂 中 中 键需要吸收能量 键需要吸收能量 |
| C | 补铁剂(硫酸亚铁)常加入维生素C | 维生素C有氧化性 |
| D | 无水醋酸在冬天易凝固成冰醋酸 |  分子间能形成氢键 分子间能形成氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-05-16更新
|
341次组卷
|
2卷引用:辽宁省沈阳市2021届高三年级教学质量监测(三)化学试题
2 . 钼(Mo)是重要的过渡金属元素,具有广泛用途。由钼精矿(主要成分是MoS2)湿法回收钼酸铵[(NH4)2MoO4]部分工艺流程如图:

请回答下列问题:
(1)“氧化焙烧”时通常采用粉碎矿石、逆流焙烧或增大空气量等措施,除了增大氧化焙烧速率,其作用还有______ 。MoS2焙烧时得到+6价钼的氧化物,焙烧时的化学方程式为______ 。
(2)已知MoO3在碱性溶液中溶解度增大,“浸出”操作时加入Na2CO3溶液会有气体产生,用离子方程式表示气泡产生的原因______ 。
(3)向“滤液1”中加入硝酸,调节pH为5~7,加热到65℃~70℃过滤除硅。则滤渣2的成分为______ 。
(4)为了提高原料的利用率,工艺流程中“滤渣1”应循环到______ 操作。
(5)“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是______ 。
(6)“酸沉”中析出钼酸铵晶体时,加入HNO3调节pH为1.5~3,其原因是______ 。
(7)Na2MoO4·2H2O是一种无公害型冷却水系统的金属缓蚀剂,常用钼酸铵和氢氧化钠反应来制取。写出制备Na2MoO4·2H2O的化学方程式是______ 。

请回答下列问题:
(1)“氧化焙烧”时通常采用粉碎矿石、逆流焙烧或增大空气量等措施,除了增大氧化焙烧速率,其作用还有
(2)已知MoO3在碱性溶液中溶解度增大,“浸出”操作时加入Na2CO3溶液会有气体产生,用离子方程式表示气泡产生的原因
(3)向“滤液1”中加入硝酸,调节pH为5~7,加热到65℃~70℃过滤除硅。则滤渣2的成分为
(4)为了提高原料的利用率,工艺流程中“滤渣1”应循环到
(5)“滤液2”先加入有机溶剂“萃取”,再加氨水“反萃取”,进行“萃取”和“反萃取”操作的目的是
(6)“酸沉”中析出钼酸铵晶体时,加入HNO3调节pH为1.5~3,其原因是
(7)Na2MoO4·2H2O是一种无公害型冷却水系统的金属缓蚀剂,常用钼酸铵和氢氧化钠反应来制取。写出制备Na2MoO4·2H2O的化学方程式是
您最近一年使用:0次
名校
3 . 根据物质的组成、结构等信息可以预测其性质或用途。下列预测中,明显不合理 的是
A.根据化合价预测,高铜酸钠(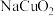 )与 )与 可生成硫酸盐 可生成硫酸盐 |
B.根据组成预测,铝酸三钙(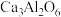 )溶于足量盐酸,生成白色沉淀 )溶于足量盐酸,生成白色沉淀 |
| C.根据在周期表中位置预测,单质砷(第ⅤA族)是重要的半导体材料 |
D.根据结构预测,葡萄糖[ ]溶液中加入新制氢氧化铜,溶液呈绛蓝色 ]溶液中加入新制氢氧化铜,溶液呈绛蓝色 |
您最近一年使用:0次
2021-05-10更新
|
524次组卷
|
3卷引用:浙江省金华十校2021届高三4月模拟考试化学试题
浙江省金华十校2021届高三4月模拟考试化学试题(已下线)专题讲座(五) “位-构-性”综合推断题的解题方法(精练)-2022年高考化学一轮复习讲练测浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题
4 . 银及其化合物在制造钱币、电子工业、医药等方面具有广泛用途。
Ⅰ.银的冶炼及性质
(1)热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为__ 。
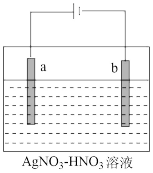
(2)电解精炼银的工作原理如图所示,___ (填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为___ 。
Ⅱ.银的化合物的性质
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式__ 。
(4)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为__ 。
(5)纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式__ 。
Ⅰ.银的冶炼及性质
(1)热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为
(2)电解精炼银的工作原理如图所示,

Ⅱ.银的化合物的性质
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式
(4)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为
(5)纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式
您最近一年使用:0次
2021-05-03更新
|
600次组卷
|
4卷引用:北京市丰台区2021届高三第二次模拟考试化学试题
北京市丰台区2021届高三第二次模拟考试化学试题(已下线)第二章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)北京市第三中学2021-2022学年高三上学期期中考试化学试题
5 .  在生产、生活中用途广泛。工业上,通常以软锰矿(主要成分是
在生产、生活中用途广泛。工业上,通常以软锰矿(主要成分是 )与
)与 的混合物在铁坩埚中混合均匀,在空气中小火加热至熔融,得到
的混合物在铁坩埚中混合均匀,在空气中小火加热至熔融,得到 ,然后按下列流程生产
,然后按下列流程生产 。
。

已知:温度高于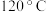 时
时 会发生分解反应。回答下列问题:
会发生分解反应。回答下列问题:
(1) 中
中 元素的化合价为
元素的化合价为_______ ,工业上用铁坩埚而不用瓷坩埚加热混合物的原因是_______ ,加热至熔融得到 的化学方程式为
的化学方程式为_______ 。
(2)上述流程中,调节 用
用 不用浓盐酸的原因是
不用浓盐酸的原因是_______ 。
(3)实验室中利用固体 进行如图所示实验:
进行如图所示实验:
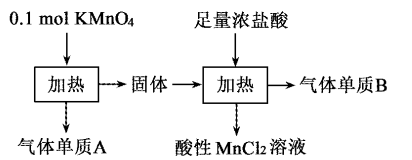
①气体单质 与
与 的化学式分别为
的化学式分别为_______ 、_______ ,加入浓盐酸并加热时 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
②若 完全分解,
完全分解, 和
和 物质的量之和为
物质的量之和为_______  。
。
 在生产、生活中用途广泛。工业上,通常以软锰矿(主要成分是
在生产、生活中用途广泛。工业上,通常以软锰矿(主要成分是 )与
)与 的混合物在铁坩埚中混合均匀,在空气中小火加热至熔融,得到
的混合物在铁坩埚中混合均匀,在空气中小火加热至熔融,得到 ,然后按下列流程生产
,然后按下列流程生产 。
。
已知:温度高于
 时
时 会发生分解反应。回答下列问题:
会发生分解反应。回答下列问题:(1)
 中
中 元素的化合价为
元素的化合价为 的化学方程式为
的化学方程式为(2)上述流程中,调节
 用
用 不用浓盐酸的原因是
不用浓盐酸的原因是(3)实验室中利用固体
 进行如图所示实验:
进行如图所示实验:
①气体单质
 与
与 的化学式分别为
的化学式分别为 发生反应的离子方程式为
发生反应的离子方程式为②若
 完全分解,
完全分解, 和
和 物质的量之和为
物质的量之和为 。
。
您最近一年使用:0次
解题方法
6 . 钒具有广泛用途,利用含钒废催化剂(主要含有 、
、 和不溶性硅酸盐)制备
和不溶性硅酸盐)制备 的新工艺流程如图:
的新工艺流程如图:

已知:滤液1和滤液2中钒以 的形式存在。回答下列问题:
的形式存在。回答下列问题:
(1)在实验室中操作Ⅰ用到的玻璃仪器有_______ 。
(2)在滤渣1中加入 和过量
和过量 溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为
溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为_______ 。
(3)混合溶液中加入 ,发生反应的离子方程式是
,发生反应的离子方程式是_______ 。
(4)钒最后以 的形式沉淀出来。沉钒率(
的形式沉淀出来。沉钒率( 沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是
沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是_______ (写一条即可)。

(5)称取w g所得产品,先用硫酸溶解,得到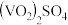 溶液,再加入
溶液,再加入 的
的 溶液,最后用
溶液,最后用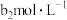 酸性
酸性 溶液滴定过量的
溶液滴定过量的 至终点,消耗溶液
至终点,消耗溶液 的体积为
的体积为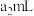 。假设杂质不参与反应,锰被还原为
。假设杂质不参与反应,锰被还原为 。则产品中
。则产品中 的质量分数为
的质量分数为_______ ,(已知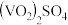 和
和 溶液反应的离子方程式为
溶液反应的离子方程式为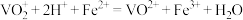 )
)
 、
、 和不溶性硅酸盐)制备
和不溶性硅酸盐)制备 的新工艺流程如图:
的新工艺流程如图:
已知:滤液1和滤液2中钒以
 的形式存在。回答下列问题:
的形式存在。回答下列问题:(1)在实验室中操作Ⅰ用到的玻璃仪器有
(2)在滤渣1中加入
 和过量
和过量 溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为
溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为(3)混合溶液中加入
 ,发生反应的离子方程式是
,发生反应的离子方程式是(4)钒最后以
 的形式沉淀出来。沉钒率(
的形式沉淀出来。沉钒率( 沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是
沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是
(5)称取w g所得产品,先用硫酸溶解,得到
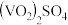 溶液,再加入
溶液,再加入 的
的 溶液,最后用
溶液,最后用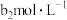 酸性
酸性 溶液滴定过量的
溶液滴定过量的 至终点,消耗溶液
至终点,消耗溶液 的体积为
的体积为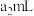 。假设杂质不参与反应,锰被还原为
。假设杂质不参与反应,锰被还原为 。则产品中
。则产品中 的质量分数为
的质量分数为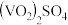 和
和 溶液反应的离子方程式为
溶液反应的离子方程式为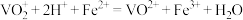 )
)
您最近一年使用:0次
名校
7 .  是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、
是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、 、MnOOH、
、MnOOH、 、
、 等)为原料制备
等)为原料制备 的过程如下:
的过程如下:

已知:i.锰酸钾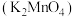 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
ii.已知相关物质的溶解度如图所示

回答下列问题:
(1)步骤Ⅰ的操作包括往废电池糊状填充物中加水,过滤、洗涤、灼烧。其中灼烧的目的主要是_______ (用化学方程式表示)。
(2)步骤Ⅱ中先将一定比例的KOH和 固体放于
固体放于_______ (填仪器名称)中加热至熔融,再分多次小心加入 粉末,搅拌并继续加热可得墨绿色固体,其主要成分为
粉末,搅拌并继续加热可得墨绿色固体,其主要成分为 ,加水溶解得到
,加水溶解得到 的强碱性溶液。写出
的强碱性溶液。写出 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)步骤Ⅲ的实验装置如图所示。
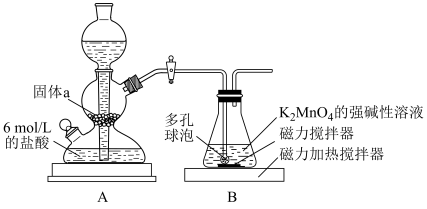
①固体a可以为_______ (填字母序号)。
A. B.
B. C.
C.
②装置B中随着 通入可观察到的现象是
通入可观察到的现象是_______ ,实验需控制 的用量,可能原因是
的用量,可能原因是_______ 。实验结束后,将装置B中溶液过滤,对滤液蒸发浓缩,冷却结晶,过滤、洗涤、干燥即可得到 晶体。
晶体。
③实验装置存在一处缺陷,可能会导致 产率降低,改进的方法是
产率降低,改进的方法是_______ 。
(4)测定 纯度的步骤如下:
纯度的步骤如下:
①称取1.5000g产物晶体,用适量稀硫酸溶解后配成250mL溶液。
②配制0.1000mol/L的标准草酸 溶液250mL。
溶液250mL。
③移取标准草酸溶液25.00mL于锥形瓶中,用所配 溶液滴定至终点,记录消耗的溶液体积。
溶液滴定至终点,记录消耗的溶液体积。
④重复3次,平均消耗 溶液29.80mL。
溶液29.80mL。
则产品中 的纯度(质量分数)为
的纯度(质量分数)为_______ %(保留小数点后两位)。
 是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、
是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、 、MnOOH、
、MnOOH、 、
、 等)为原料制备
等)为原料制备 的过程如下:
的过程如下:
已知:i.锰酸钾
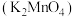 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
ii.已知相关物质的溶解度如图所示

回答下列问题:
(1)步骤Ⅰ的操作包括往废电池糊状填充物中加水,过滤、洗涤、灼烧。其中灼烧的目的主要是
(2)步骤Ⅱ中先将一定比例的KOH和
 固体放于
固体放于 粉末,搅拌并继续加热可得墨绿色固体,其主要成分为
粉末,搅拌并继续加热可得墨绿色固体,其主要成分为 ,加水溶解得到
,加水溶解得到 的强碱性溶液。写出
的强碱性溶液。写出 发生反应的化学方程式为
发生反应的化学方程式为(3)步骤Ⅲ的实验装置如图所示。

①固体a可以为
A.
 B.
B. C.
C.
②装置B中随着
 通入可观察到的现象是
通入可观察到的现象是 的用量,可能原因是
的用量,可能原因是 晶体。
晶体。③实验装置存在一处缺陷,可能会导致
 产率降低,改进的方法是
产率降低,改进的方法是(4)测定
 纯度的步骤如下:
纯度的步骤如下:①称取1.5000g产物晶体,用适量稀硫酸溶解后配成250mL溶液。
②配制0.1000mol/L的标准草酸
 溶液250mL。
溶液250mL。③移取标准草酸溶液25.00mL于锥形瓶中,用所配
 溶液滴定至终点,记录消耗的溶液体积。
溶液滴定至终点,记录消耗的溶液体积。④重复3次,平均消耗
 溶液29.80mL。
溶液29.80mL。则产品中
 的纯度(质量分数)为
的纯度(质量分数)为
您最近一年使用:0次
名校
解题方法
8 . I.铁、铝是生活中常见金属,用途广泛。完成下列填空:
(1)在碱性溶液中,Al(OH)3的电离方程式为:___________ 。
(2)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝_____ 。
II.高铁酸钾 是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。
是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。 在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用
在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用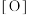 表示):___________
表示):___________ ___________
___________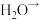 ___________
___________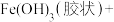 ___________
___________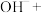 ___________
___________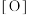
(3)配平上述反应_______ 。此过程中氧化剂是_________ 。(填化学物质)。
(4) 本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?
本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?_______ 。
III.溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生,流程如下(部分物质有省略):
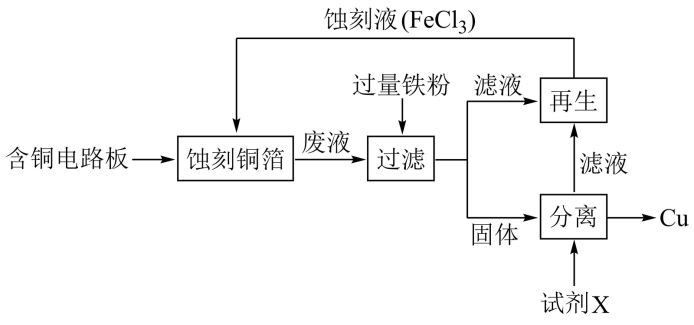
(5) 蚀刻铜箔反应的离子方程式为
蚀刻铜箔反应的离子方程式为___________ 。
(6)从固体中分离出铜,加入的试剂X可以是___________ 。
(7)使滤液再生为蚀刻液可采用的方法是___________ 。
(1)在碱性溶液中,Al(OH)3的电离方程式为:
(2)铝和氧化铁高温下反应得到的熔融物通常为铁铝合金,设计实验证明其含金属铝
II.高铁酸钾
 是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。
是一种集氧化、杀菌、吸附、凝聚等新型多功能高效水处理剂。 在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用
在水中发生发如下反应生成具有很强氧化、杀菌能力的新生态氧原子(用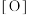 表示):___________
表示):___________ ___________
___________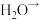 ___________
___________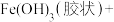 ___________
___________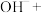 ___________
___________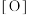
(3)配平上述反应
(4)
 本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?
本身不具有吸附性,作为水处理剂为何具有吸附、凝聚等功能?III.溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生,流程如下(部分物质有省略):

(5)
 蚀刻铜箔反应的离子方程式为
蚀刻铜箔反应的离子方程式为(6)从固体中分离出铜,加入的试剂X可以是
(7)使滤液再生为蚀刻液可采用的方法是
您最近一年使用:0次
2021-10-08更新
|
187次组卷
|
2卷引用:上海市杨浦高级中学2020-2021学年高二上学期第一次月考化学试题
解题方法
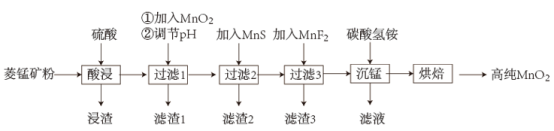
9 . 锰及其化合物在生产生活中有着重要的用途。一种以菱锰矿(主要成分为MnCO3,还含有少量FeCO3、CaCO3、ZnCO3)为原料生产高纯MnO2的工艺流程如下
已知:溶液中金属离子浓度小于等于1×10-5mol·L-1时,认为该离子沉淀完全。部分物质25℃的溶度积常数如下:
(1)“酸浸”过程中不能用硝酸代替硫酸的原因是_______ ,浸渣中主要含有_______ 。
(2)假设酸浸后,溶液中Mn2+浓度为0.1mol/L,则调节pH时应将溶液pH控制在_______ 。加入MnO2时发生反应的离子方程式为_______ 。
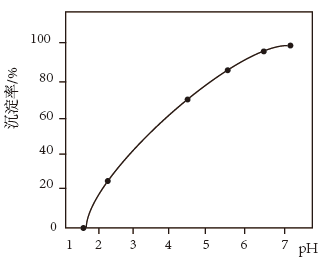
(3)加入MnF2的目的是除去溶液中Ca2+,下图为溶液pH与Ca2+去除率之间的关系。随着溶液pH变小,Ca2+去除率逐渐下降的原因可能是_______ 。
(4)“焙烧”过程中可能存在的反应有①MnCO3=MnO+CO2↑,②2MnO+O2=2MnO2,分解过程开始后,反应速率逐渐加快,通过电镜扫描发现块状固体逐渐变成疏松多孔结构。推测反应速率逐渐加快的原因是_______ 。
(5)电解MnSO4溶液也可以在阳极获得MnO2,写出相应的电极反应式_______ 。
(6)MnO2可在碱性条件下与空气反应生成K2MnO4,将产物溶于水中,并通入足量CO2气体,溶液变为紫红色并生成黑色固体,写出生成黑色固体的离子方程式_______ 。

已知:溶液中金属离子浓度小于等于1×10-5mol·L-1时,认为该离子沉淀完全。部分物质25℃的溶度积常数如下:
| 物质 | Mn(OH)2 | Fe(OH)3 | Zn(OH)2 | Ca(OH)2 |
| Ksp | 1.0×10-13.6 | 1.0×10-38.6 | 1.0×10-13.4 | 1.0×10-5.3 |
(2)假设酸浸后,溶液中Mn2+浓度为0.1mol/L,则调节pH时应将溶液pH控制在
(3)加入MnF2的目的是除去溶液中Ca2+,下图为溶液pH与Ca2+去除率之间的关系。随着溶液pH变小,Ca2+去除率逐渐下降的原因可能是

(4)“焙烧”过程中可能存在的反应有①MnCO3=MnO+CO2↑,②2MnO+O2=2MnO2,分解过程开始后,反应速率逐渐加快,通过电镜扫描发现块状固体逐渐变成疏松多孔结构。推测反应速率逐渐加快的原因是
(5)电解MnSO4溶液也可以在阳极获得MnO2,写出相应的电极反应式
(6)MnO2可在碱性条件下与空气反应生成K2MnO4,将产物溶于水中,并通入足量CO2气体,溶液变为紫红色并生成黑色固体,写出生成黑色固体的离子方程式
您最近一年使用:0次
解题方法
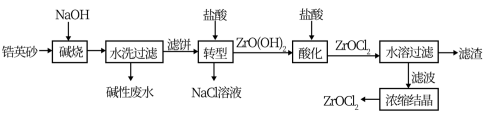
10 . 锆产品的主要原料是锆英砂,全球90%的氧氯化锆(ZrOCl2)来源于中国。氧氯化锆可溶于水,微溶于盐酸,工业上以锆英砂(含91.5%ZrSiO4,杂质不与NaOH溶液反应)为原料生产ZrOCl2的一种工艺流程如图所示。
已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是____ ,“碱烧”时ZrSiO4生成了Na2ZrO3和另一种钠盐X,X的化学式为___ ,X的用途是___ (写一种)。
(2)“转型”时发生反应的化学方程式为___ 。
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是___ 。
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是___ 。
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成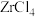 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为___ 。
(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为___ t。

已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是
(2)“转型”时发生反应的化学方程式为
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成
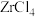 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为
您最近一年使用:0次
2021-10-01更新
|
517次组卷
|
5卷引用:河南省偃师市第一高级中学2022届高三阶段性测试化学试题
河南省偃师市第一高级中学2022届高三阶段性测试化学试题福建省南平市2022届高三10月联考化学试卷重庆市2021-2022学年高二上学期期中考试化学试题贵州省黔西南州2021~2022学年高二上学期期中考试化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-测试



