名校
解题方法
1 . 含氮物质是中学化学中的一类常见物质,在人们的生产、生活活动中有重要作用,并产生了深远的影响。
(1)实验室中,采用一定浓度的 溶液和
溶液和 溶液作为反应物,通过加热可制备少量
溶液作为反应物,通过加热可制备少量 ,反应的离子方程式是
,反应的离子方程式是_______ ,收集 的方法是
的方法是_______ (填标号)。
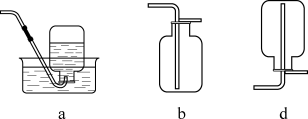
(2)“侯氏制碱法”是中国人的骄傲。某学习小组模拟“侯氏制碱法”原理,在实验室中制备少量 ,使用的装置如图:
,使用的装置如图:
装置接口正确的连接顺序为_______ (填接口序号),由该装置可知,该实验中制备 的试剂是
的试剂是_______ (填化学式)。
(3)该学习小组在实验中,将 溶液滴入
溶液滴入 的
的 溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①实验目的:通过实验探究溶液产生棕色的原因。
②查阅资料:常温下, 在溶液中能稳定存在,溶液为棕色,受热分解释放出
在溶液中能稳定存在,溶液为棕色,受热分解释放出 。
。
③提出猜想:溶液中 的棕色掩盖了
的棕色掩盖了 的黄色。
的黄色。
④设计实验、验证猜想
⑤现象分析、交流讨论滴加 溶液变红,说明溶液中存在的离子是
溶液变红,说明溶液中存在的离子是_______ (写离子符号),若猜想成立,则“实验2”还应有的现象是_______ 。溶液变棕色的离子方程式是_______ 、 。
。
⑥优化实验:请你设计一个简单的实验,验证“猜想”是否成立。实验设计:_______ ,预期的实验现象及结论:_______ 。
(1)实验室中,采用一定浓度的
 溶液和
溶液和 溶液作为反应物,通过加热可制备少量
溶液作为反应物,通过加热可制备少量 ,反应的离子方程式是
,反应的离子方程式是 的方法是
的方法是
(2)“侯氏制碱法”是中国人的骄傲。某学习小组模拟“侯氏制碱法”原理,在实验室中制备少量
 ,使用的装置如图:
,使用的装置如图:
装置接口正确的连接顺序为
 的试剂是
的试剂是(3)该学习小组在实验中,将
 溶液滴入
溶液滴入 的
的 溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。①实验目的:通过实验探究溶液产生棕色的原因。
②查阅资料:常温下,
 在溶液中能稳定存在,溶液为棕色,受热分解释放出
在溶液中能稳定存在,溶液为棕色,受热分解释放出 。
。③提出猜想:溶液中
 的棕色掩盖了
的棕色掩盖了 的黄色。
的黄色。④设计实验、验证猜想
| 实验序号 | 操作方法 | 现象 |
| 1 | 取上述滴有 溶液的棕色混合液,向其中滴加稀 溶液的棕色混合液,向其中滴加稀 溶液 溶液 | 溶液迅速变为红色 |
| 2 | 取上述棕色混合液,按如图所示加热 | 试管口处有红棕色气体逸出 |
 溶液变红,说明溶液中存在的离子是
溶液变红,说明溶液中存在的离子是 。
。⑥优化实验:请你设计一个简单的实验,验证“猜想”是否成立。实验设计:
您最近一年使用:0次
2022-03-13更新
|
288次组卷
|
2卷引用:广东省碧桂园学校2021-2022学年高三下学期 3月综合能力测试化学试题
解题方法
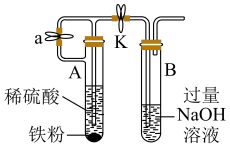
2 . 某化学小组对铁及其化合物的性质、制备进行如下探究。请按要求回答下列问题。
(一) 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液
(1)同学甲探究铁具有还原性,可选择试剂: 粉、
粉、 溶液、
溶液、_______ 。
(2)同学乙为探究 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是_______ ;欲获得更充分证据,此实验操作应该完善为_______ 。
(3)同学丙欲探究 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为_______ 。
(二) 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
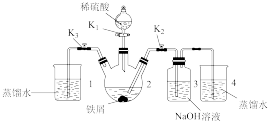
(4)为达到实验目的,需进行的操作:先打开 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再_______ ,_______ ,发现溶液从装置2进入装置3中,关闭 。
。
(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:_______ 。
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ. 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。
①从原子结构解释步骤I很容易发生的原因:_______ 。
②上述过程属于氧化还原反应的步骤为_______ (填序号)。
(7)化学修复过程探究:研究发现, 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生 。将铁器浸没在盛有
。将铁器浸没在盛有
 、
、
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。
①加热目的是_______ 。
②检测 洗涤干净与否的操作:
洗涤干净与否的操作:_______ 。
③铁器表面的 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:_______ 。
④修复中 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:_______ 。
(一)
 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液(1)同学甲探究铁具有还原性,可选择试剂:
 粉、
粉、 溶液、
溶液、(2)同学乙为探究
 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是(3)同学丙欲探究
 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为(二)
 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
(4)为达到实验目的,需进行的操作:先打开
 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再 。
。(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ.
 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。①从原子结构解释步骤I很容易发生的原因:
②上述过程属于氧化还原反应的步骤为
(7)化学修复过程探究:研究发现,
 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生 。将铁器浸没在盛有
。将铁器浸没在盛有
 、
、
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。①加热目的是
②检测
 洗涤干净与否的操作:
洗涤干净与否的操作:③铁器表面的
 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:④修复中
 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近一年使用:0次
解题方法
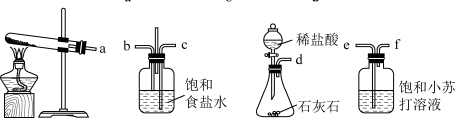
3 . 化学兴趣小组利用下图装置(夹持仪器已略去)验证浓、稀硝酸氧化性的相对强弱。已知:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
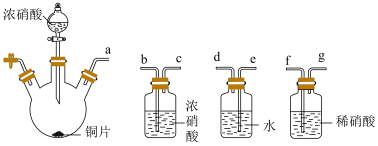
(1)为实现实验目的,上述装置的接口连接顺序依次为a________________ (填装置接口序号,装置不能重复使用),C的作用是__________ (用化学方程式表示)。
(2)该小组要得出“浓硝酸的氧化性强于稀硝酸”的实验结论,所依据的实验现象是__________ 。
(3)开始实验应进行的操作为__________ 。该实验装置存在明显缺陷,应该__________ 。
(4)实验过程中,小组同学发现A中铜片溶解,得到绿色溶液Ⅰ,放置较长时间后得到蓝色溶液Ⅱ。
①甲认为溶液呈现绿色的原因是Cu2+浓度较大,乙根据实验记录,认为观点不正确。乙的依据是__________ 。
②乙认为溶液呈绿色是由溶解的NO2引起的。实验验证:先将NO2通入溶液Ⅱ中,再鼓入N2,结果证实假设成立。则以上两步操作对应的现象分别是__________ 、__________ 。

(1)为实现实验目的,上述装置的接口连接顺序依次为a
(2)该小组要得出“浓硝酸的氧化性强于稀硝酸”的实验结论,所依据的实验现象是
(3)开始实验应进行的操作为
(4)实验过程中,小组同学发现A中铜片溶解,得到绿色溶液Ⅰ,放置较长时间后得到蓝色溶液Ⅱ。
①甲认为溶液呈现绿色的原因是Cu2+浓度较大,乙根据实验记录,认为观点不正确。乙的依据是
②乙认为溶液呈绿色是由溶解的NO2引起的。实验验证:先将NO2通入溶液Ⅱ中,再鼓入N2,结果证实假设成立。则以上两步操作对应的现象分别是
您最近一年使用:0次
4 . 某小组为探究 和
和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
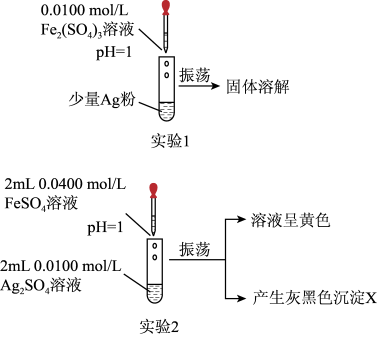
(1)实验1:如图所示,可得出的实验结论是___________ 。该实验不选用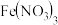 的原因是
的原因是___________ 。
(2)实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。
①写出实验2试管中发生反应的离子方程式:___________ 。
②请用离子方程式解释产生红棕色气体的原因:___________ 。
(3)实验3:为进一步证明实验1反应是可逆的,用如图装置进行验证。闭合开关K,电流计指针向右偏转,一段时间后指针归零。
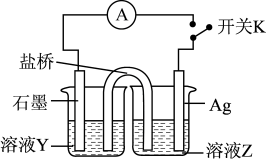
①溶液Y为___________ 。
②为实现该实验目的,接下来的操作及现象为___________ 。
(4)实验4:为定量认识实验2中反应限度情况,查阅资料知, 下,
下,  (白色)
(白色) 
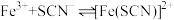 (红色)
(红色) 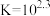
 ,取实验2试管中充分反应静置后的上层清液
,取实验2试管中充分反应静置后的上层清液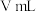 ,用
,用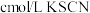 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗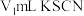 标准溶液。
标准溶液。
①判断滴定终点现象为___________ ;
②实验2试管中反应的平衡常数
___________ 。
③不取用实验1反应后所得清液测定反应的平衡常数的原因:___________ 。
 和
和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
(1)实验1:如图所示,可得出的实验结论是
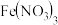 的原因是
的原因是(2)实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。
①写出实验2试管中发生反应的离子方程式:
②请用离子方程式解释产生红棕色气体的原因:
(3)实验3:为进一步证明实验1反应是可逆的,用如图装置进行验证。闭合开关K,电流计指针向右偏转,一段时间后指针归零。

①溶液Y为
②为实现该实验目的,接下来的操作及现象为
(4)实验4:为定量认识实验2中反应限度情况,查阅资料知,
 下,
下,  (白色)
(白色) 
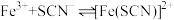 (红色)
(红色) 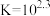
 ,取实验2试管中充分反应静置后的上层清液
,取实验2试管中充分反应静置后的上层清液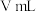 ,用
,用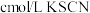 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗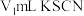 标准溶液。
标准溶液。①判断滴定终点现象为
②实验2试管中反应的平衡常数

③不取用实验1反应后所得清液测定反应的平衡常数的原因:
您最近一年使用:0次
名校
5 . 下列“实验目的”与“实验操作及现象”不完全正确的一组是
| 编号 | 实验目的 | 实验操作及现象 |
| A | 证明氯水中有 | 把红色的鲜花花瓣放入氯水中,花瓣褪色 |
| B | 探究维生素C的还原性 | 向盛有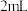 氯化铁溶液的试管中滴加维生素C溶液,溶液颜色由黄色逐渐变为浅绿色 氯化铁溶液的试管中滴加维生素C溶液,溶液颜色由黄色逐渐变为浅绿色 |
| C | 证明氯气可以支持燃烧 | 氢气点燃后在氯气中安静燃烧,发出苍白色火焰,有白烟生成 |
| D | 制备 胶体 胶体 | 将饱和 溶液滴入沸水中,继续加热至液体呈红褐色 溶液滴入沸水中,继续加热至液体呈红褐色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 硫酸亚铁晶体 俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的
俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的 。硫酸亚铁的用途广泛,可以制备如下图所示物质。
。硫酸亚铁的用途广泛,可以制备如下图所示物质。
回答下列问题:
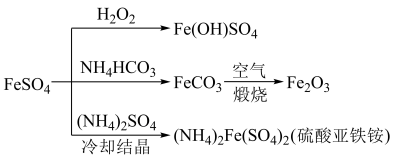
(1)实验室保存硫酸亚铁溶液时,往往加入一定量的铁粉,其目的是___________ ,通过做实验发现,用 氧化硫酸亚铁获得
氧化硫酸亚铁获得 比在空气中被氧化速率快很多,但是
比在空气中被氧化速率快很多,但是 的用量比理论值高很多,其原因是
的用量比理论值高很多,其原因是___________ 。
(2)获取氧化铁过程中,向硫酸亚铁溶液逐滴加入 溶液,控制
溶液,控制 小于6,经过滤、洗涤、干燥获取纯净的
小于6,经过滤、洗涤、干燥获取纯净的 ,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使
,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使 充分反应,则该反应中氧化剂与还原剂的物质的量之比为
充分反应,则该反应中氧化剂与还原剂的物质的量之比为___________ 。请写出 一种用途是
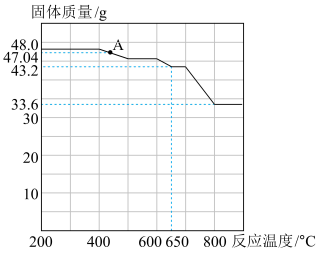
一种用途是___________ 。查阅资料知,在不同温度下 被
被 还原的产物不同。固体质量与反应温度的关系如图所示。则
还原的产物不同。固体质量与反应温度的关系如图所示。则 点时对应固体化学式为
点时对应固体化学式为___________ 。
(3)实验室还可以利用如图所示装置制备并较长时间观察 白色沉淀。
白色沉淀。
①为了完成实验目的,则装置 中长玻璃管伸到的位置是
中长玻璃管伸到的位置是___________ (填“实线”或“虚线”);
②向装置 先加入铁粉,再加入稀硫酸,在装置
先加入铁粉,再加入稀硫酸,在装置 端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是___________ 。
 俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的
俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的 。硫酸亚铁的用途广泛,可以制备如下图所示物质。
。硫酸亚铁的用途广泛,可以制备如下图所示物质。回答下列问题:

(1)实验室保存硫酸亚铁溶液时,往往加入一定量的铁粉,其目的是
 氧化硫酸亚铁获得
氧化硫酸亚铁获得 比在空气中被氧化速率快很多,但是
比在空气中被氧化速率快很多,但是 的用量比理论值高很多,其原因是
的用量比理论值高很多,其原因是(2)获取氧化铁过程中,向硫酸亚铁溶液逐滴加入
 溶液,控制
溶液,控制 小于6,经过滤、洗涤、干燥获取纯净的
小于6,经过滤、洗涤、干燥获取纯净的 ,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使
,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使 充分反应,则该反应中氧化剂与还原剂的物质的量之比为
充分反应,则该反应中氧化剂与还原剂的物质的量之比为 一种用途是
一种用途是 被
被 还原的产物不同。固体质量与反应温度的关系如图所示。则
还原的产物不同。固体质量与反应温度的关系如图所示。则 点时对应固体化学式为
点时对应固体化学式为
(3)实验室还可以利用如图所示装置制备并较长时间观察
 白色沉淀。
白色沉淀。
①为了完成实验目的,则装置
 中长玻璃管伸到的位置是
中长玻璃管伸到的位置是②向装置
 先加入铁粉,再加入稀硫酸,在装置
先加入铁粉,再加入稀硫酸,在装置 端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
您最近一年使用:0次
7 . 氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)工业干法制备高铁酸钾的第一步反应为: 。该反应中氧化产物为
。该反应中氧化产物为_______ 。
(2)已知下列三个氧化还原反应:①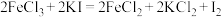 ;②
;②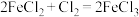 ;③
;③ 。若溶质中
。若溶质中 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还可用反应中的
不被氧化,除单质外,还可用反应中的_______ (从下列三个反应中选择)作氧化剂。
(3)无水情况下, 可以和
可以和 发生如下反应:_______
发生如下反应:_______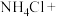 _______
_______ _______
_______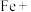 _______
_______ _______
_______ _______
_______ 。配平上述反应方程式,单线桥法标出电子转移的方向和数目
。配平上述反应方程式,单线桥法标出电子转移的方向和数目_______ ;
(4)向含有 、
、 的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性
的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性 ;②KSCN溶液可用于检验
;②KSCN溶液可用于检验 的存在,溶液呈红色。则下列叙述中正确的是
的存在,溶液呈红色。则下列叙述中正确的是_______ 。
①氧化性: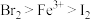
②原溶液中 一定被氧化
一定被氧化
③通入氯气后,原溶液中的 一定被氧化
一定被氧化
④不能确定通入氯气后的溶液中是否还存在
(5)下列转化中,需要加入还原剂才能实现的是_______。
(6)2020年8月初,某海外港口因硝酸铵分解引发剧烈爆炸,已知: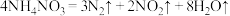 ,则该反应中被还原和被氧化的N原子数之比为
,则该反应中被还原和被氧化的N原子数之比为_______ 。
(7)用如图装置可验证 是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为_______ (填序号)。
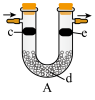
①干燥的有色布条 ②湿润的有色布条 ③浓硫酸 ④碱石灰 ⑤无水
(1)工业干法制备高铁酸钾的第一步反应为:
 。该反应中氧化产物为
。该反应中氧化产物为(2)已知下列三个氧化还原反应:①
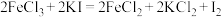 ;②
;②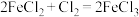 ;③
;③ 。若溶质中
。若溶质中 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还可用反应中的
不被氧化,除单质外,还可用反应中的(3)无水情况下,
 可以和
可以和 发生如下反应:_______
发生如下反应:_______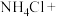 _______
_______ _______
_______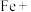 _______
_______ _______
_______ _______
_______ 。配平上述反应方程式,单线桥法标出电子转移的方向和数目
。配平上述反应方程式,单线桥法标出电子转移的方向和数目(4)向含有
 、
、 的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性
的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性 ;②KSCN溶液可用于检验
;②KSCN溶液可用于检验 的存在,溶液呈红色。则下列叙述中正确的是
的存在,溶液呈红色。则下列叙述中正确的是①氧化性:
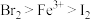
②原溶液中
 一定被氧化
一定被氧化③通入氯气后,原溶液中的
 一定被氧化
一定被氧化④不能确定通入氯气后的溶液中是否还存在

(5)下列转化中,需要加入还原剂才能实现的是_______。
A. | B. |
C. | D. |
(6)2020年8月初,某海外港口因硝酸铵分解引发剧烈爆炸,已知:
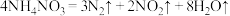 ,则该反应中被还原和被氧化的N原子数之比为
,则该反应中被还原和被氧化的N原子数之比为(7)用如图装置可验证
 是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
①干燥的有色布条 ②湿润的有色布条 ③浓硫酸 ④碱石灰 ⑤无水

您最近一年使用:0次
8 . 化学为疫情防控提供了强有力的支撑。许多含氯物质既是重要化工原料,又是高效、广谱的灭菌消毒剂。
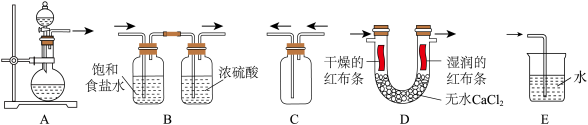
(1)舍勒用软锰矿(主要成分为二氧化锰)为原料得到氯气,反应的化学方程式为_______ 。
(2)应用以上原理制备、净化、收集氯气并进行性质检验和尾气处理,下列装置(“→”表示气流方向)不能达到实验目的的是_______ 。
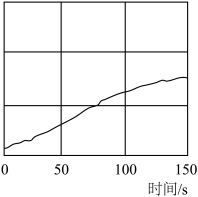
(3)为验证氯水中HClO分解的产物,现用强光照射氯水,并用氯离子浓度传感器、氧气传感器(测体积分数)、pH传感器等仪器进行数据采集,获得相关变化曲线如图。图中纵坐标可表示的物理量是_______ (任写两个)。
(4)下列物质常用于杀菌消毒,其中消毒原理与HClO相同的是_______
(5)84消毒液的主要成分为NaClO和NaCl,不能与酸性清洁剂混合使用,其原因是_______ 。
(6)二氧化氯( )是常用消毒剂,但其稳定性差,通常把它通入
)是常用消毒剂,但其稳定性差,通常把它通入 和NaOH的混合溶液中,使之转化成
和NaOH的混合溶液中,使之转化成 ,便于运输储存。写出对应的离子方程式
,便于运输储存。写出对应的离子方程式_______ 。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克 的氧化能力,NaClO、
的氧化能力,NaClO、 、
、 作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为_______ 。
(1)舍勒用软锰矿(主要成分为二氧化锰)为原料得到氯气,反应的化学方程式为
(2)应用以上原理制备、净化、收集氯气并进行性质检验和尾气处理,下列装置(“→”表示气流方向)不能达到实验目的的是

(3)为验证氯水中HClO分解的产物,现用强光照射氯水,并用氯离子浓度传感器、氧气传感器(测体积分数)、pH传感器等仪器进行数据采集,获得相关变化曲线如图。图中纵坐标可表示的物理量是

(4)下列物质常用于杀菌消毒,其中消毒原理与HClO相同的是_______
A. | B.酒精 | C.熟石灰 | D. |
(6)二氧化氯(
 )是常用消毒剂,但其稳定性差,通常把它通入
)是常用消毒剂,但其稳定性差,通常把它通入 和NaOH的混合溶液中,使之转化成
和NaOH的混合溶液中,使之转化成 ,便于运输储存。写出对应的离子方程式
,便于运输储存。写出对应的离子方程式(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力,NaClO、
的氧化能力,NaClO、 、
、 作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
您最近一年使用:0次
9 . 某学习小组拟研究FeSO4的分解实验探究,请你利用所学知识帮该小组完成以下实验方案。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2 ;
假设2:FeO、SO3、SO2;
假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
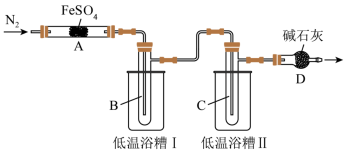
回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是_______ 。
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是_______ ,(只填操作),当A处固体完全分解后通入N2的目的是_______ 。
(3)实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备N2,该反应的离子方程式为_______ 。
(4)低温浴槽Ⅰ收集的物质是_______ (填化学式),低温浴槽Ⅱ控制的温度范围为_______ 。
(5)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
甲组实验中A装置得到固体产物是_______ (填化学式)。
(6)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是_______ 。
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(7)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案_______ (填“1”或“2”)可行。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2 ;
假设2:FeO、SO3、SO2;
假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
| 物质 | SO3 | SO2 | O2 | N2 |
| 熔点/℃ | 16.8 | - 72.4 | -218.4 | -209.9 |
| 沸点/℃ | 44.8 | - 10 | -182.9 | - 195.8 |

回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是
(3)实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备N2,该反应的离子方程式为
(4)低温浴槽Ⅰ收集的物质是
(5)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
| 实验 | A处温度/℃ | FeSO4质量/g | 低温浴槽Ⅰ净增质量/g | 低温浴槽Ⅱ净增质量/g |
| 甲 | T1 | 3.04 | 0.80 | 0.64 |
| 乙 | T2 | 4.56 | 1.60 | 0.64 |
(6)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(7)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案
您最近一年使用:0次
名校
解题方法
10 . 氯气是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、染料和药品等。
(1)氯离子结构示意图是___________ 。
(2)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为 混合加热,发现了氯气。右图为实验室制取
混合加热,发现了氯气。右图为实验室制取 的装置,请回答:
的装置,请回答:
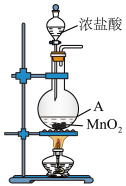
盛放浓盐酸的仪器名称是___________ ,A中反应的化学方程式为___________ ,其中,被氧化的 与参加反应的
与参加反应的 两者的物质的量之比为
两者的物质的量之比为___________ 。
(3)制取氯气时,实验室通常选用浓硫酸、饱和食盐水净化 。饱和食盐水的作用是
。饱和食盐水的作用是___________ ;浓硫酸的作用是___________ 。
(4)下列制取氯气的净化、收集、尾气处理的装置不能达到实验目的的是___________ 。
A净化
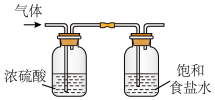 B.收集
B.收集
 C.尾气处理
C.尾气处理
(5)1867年,英国化学家Deacon用空气中的 在锰盐或铜盐(氯化铜)催化和430~475℃条件下,将
在锰盐或铜盐(氯化铜)催化和430~475℃条件下,将 氧化制备得到
氧化制备得到 ,这种催化氧化法制取氯气的方法称为Deacon法。写出其化学方程式
,这种催化氧化法制取氯气的方法称为Deacon法。写出其化学方程式___________ ,并用双线桥标明电子转移的方向和数目___________ 。
(6)已知:常温下用 和市售浓盐酸
和市售浓盐酸 反应制取
反应制取 难以进行,理论上盐酸的浓度需达到
难以进行,理论上盐酸的浓度需达到 。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取
。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取 。
。
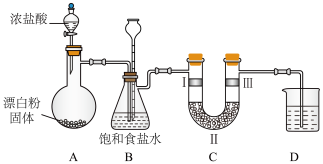
①已知,上图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式:___________ 。
②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是___________ (填“干燥的有色布条”或“湿润的有色布条”)。装置C的Ⅱ处的试剂是___________ (填序号)。
a、碱石灰(氢氧化钠和氧化钙的混合物) b、无水氯化钙 c、浓硫酸
③装置D中若用澄清石灰水吸收多余的氯气,是否可行?___________ (填“可行”或“不可行”)。理由是___________ 。
④以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为___________ 。写出电解饱和食盐水的化学方程式,并用单线桥标明电子转移的方向和数目:___________ 。
⑤若电解饱和食盐水时有 被电解,理论上最多可生成氯气多少升(标准状况)
被电解,理论上最多可生成氯气多少升(标准状况)___________ ?(写出根据化学方程式计算的过程)
(1)氯离子结构示意图是
(2)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为
 混合加热,发现了氯气。右图为实验室制取
混合加热,发现了氯气。右图为实验室制取 的装置,请回答:
的装置,请回答:
盛放浓盐酸的仪器名称是
 与参加反应的
与参加反应的 两者的物质的量之比为
两者的物质的量之比为(3)制取氯气时,实验室通常选用浓硫酸、饱和食盐水净化
 。饱和食盐水的作用是
。饱和食盐水的作用是(4)下列制取氯气的净化、收集、尾气处理的装置不能达到实验目的的是
A净化

 B.收集
B.收集
 C.尾气处理
C.尾气处理
(5)1867年,英国化学家Deacon用空气中的
 在锰盐或铜盐(氯化铜)催化和430~475℃条件下,将
在锰盐或铜盐(氯化铜)催化和430~475℃条件下,将 氧化制备得到
氧化制备得到 ,这种催化氧化法制取氯气的方法称为Deacon法。写出其化学方程式
,这种催化氧化法制取氯气的方法称为Deacon法。写出其化学方程式(6)已知:常温下用
 和市售浓盐酸
和市售浓盐酸 反应制取
反应制取 难以进行,理论上盐酸的浓度需达到
难以进行,理论上盐酸的浓度需达到 。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取
。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取 。
。
①已知,上图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式:
②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是
a、碱石灰(氢氧化钠和氧化钙的混合物) b、无水氯化钙 c、浓硫酸
③装置D中若用澄清石灰水吸收多余的氯气,是否可行?
④以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为
⑤若电解饱和食盐水时有
 被电解,理论上最多可生成氯气多少升(标准状况)
被电解,理论上最多可生成氯气多少升(标准状况)
您最近一年使用:0次
2022-11-18更新
|
176次组卷
|
2卷引用:江苏省常州市第三中学等十校2022`2023学年高一上学期期中联考化学试题



