1 . 某实验小组制备高铁酸钾(K2FeO4),并探究其性质。
已知:K2FeO4为紫色固体,微溶于KOH溶液中呈紫色溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)装置A为氯气发生装置,装置C中得到紫色固体和溶液。请写出C中由Cl2参加反应生成高铁酸钾的化学方程式___ 。
(2)将装置C中所得混合物进行抽滤,请选择合适的操作并排序___ 。
a.倾析法转移溶液
b.转移固体至漏斗
c.使用玻璃砂漏斗
d.开大抽气装置水龙头
e.关闭抽气装置水龙头
f.断开抽气泵和吸滤瓶之间的橡皮管
g.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
h.用蒸馏水润湿滤纸,微开水龙头,使滤纸与漏斗瓷板紧贴
Ⅱ.探究K2FeO4的性质
(3)取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
①用KOH溶液充分洗涤装置C中所得固体
②再用KOH溶液将固体K2FeO4溶出,得到紫色溶液a取少量a,滴加盐酸,有Cl2产生。该方案可证明K2FeO4氧化了Cl-,①中用KOH溶液洗涤的目的是___ 。
(4)资料表明,酸性溶液中的氧化性FeO >MnO
>MnO 。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO
。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO >MnO
>MnO 。请说明理由
。请说明理由___ 。
Ⅲ.K2FeO4产品纯度的测定
(5)准确称取3.00gK2FeO4样品于锥形瓶中,加入足量KOH溶液和50.00mL0.4200mol•L-1Na3AsO3溶液,充分反应后加入稀硫酸酸化,用0.1000mol•L-1KBrO3标准溶液滴定剩余的Na3AsO3溶液,恰好完全反应时消耗KBrO3标准溶液的体积为20.00mL。(K2FeO4摩尔质量为198gmol•L-1)
已知测定过程中发生的反应有:
FeO +AsO
+AsO +H2O→Fe(OH)3+AsO
+H2O→Fe(OH)3+AsO +OH-(未配平)
+OH-(未配平)
AsO +BrO
+BrO →AsO
→AsO +Br-(未配平)
+Br-(未配平)
样品中K2FeO4的质量分数为___ (保留三位有效数字,杂质不参与化学反应)。
已知:K2FeO4为紫色固体,微溶于KOH溶液中呈紫色溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)装置A为氯气发生装置,装置C中得到紫色固体和溶液。请写出C中由Cl2参加反应生成高铁酸钾的化学方程式
(2)将装置C中所得混合物进行抽滤,请选择合适的操作并排序
a.倾析法转移溶液
b.转移固体至漏斗
c.使用玻璃砂漏斗
d.开大抽气装置水龙头
e.关闭抽气装置水龙头
f.断开抽气泵和吸滤瓶之间的橡皮管
g.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
h.用蒸馏水润湿滤纸,微开水龙头,使滤纸与漏斗瓷板紧贴
Ⅱ.探究K2FeO4的性质
(3)取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
①用KOH溶液充分洗涤装置C中所得固体
②再用KOH溶液将固体K2FeO4溶出,得到紫色溶液a取少量a,滴加盐酸,有Cl2产生。该方案可证明K2FeO4氧化了Cl-,①中用KOH溶液洗涤的目的是
(4)资料表明,酸性溶液中的氧化性FeO
 >MnO
>MnO 。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO
。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO >MnO
>MnO 。请说明理由
。请说明理由Ⅲ.K2FeO4产品纯度的测定
(5)准确称取3.00gK2FeO4样品于锥形瓶中,加入足量KOH溶液和50.00mL0.4200mol•L-1Na3AsO3溶液,充分反应后加入稀硫酸酸化,用0.1000mol•L-1KBrO3标准溶液滴定剩余的Na3AsO3溶液,恰好完全反应时消耗KBrO3标准溶液的体积为20.00mL。(K2FeO4摩尔质量为198gmol•L-1)
已知测定过程中发生的反应有:
FeO
 +AsO
+AsO +H2O→Fe(OH)3+AsO
+H2O→Fe(OH)3+AsO +OH-(未配平)
+OH-(未配平)AsO
 +BrO
+BrO →AsO
→AsO +Br-(未配平)
+Br-(未配平)样品中K2FeO4的质量分数为
您最近一年使用:0次
解题方法
2 . 全球气候变化对全球人类社会构成重大威胁。政府气候变化专门委员会(IPCC)报告认为,为了避免极端危害,世界必须将全球变暖幅度控制在1.5℃以内。只有全球都在21世纪中叶实现温室气体净零排放,才能有可能实现这一目标。请根据二氧化碳的利用回答下列问题:
(1)CO2催化氢化制甲烷的研究过程如图1:
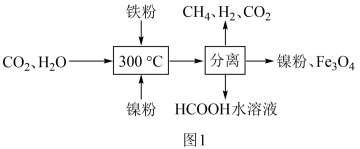
①上述过程中,加入铁粉的作用是__ 。
②HCOOH是CO2转化为CH4的中间体:CO2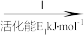 HCOOH
HCOOH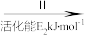 CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是__ 。
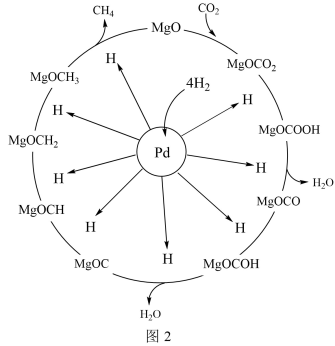
(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为__ 。
(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=__ k正。
②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强__ (填“>”“<”或“=”)T1℃时平衡压强。
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l) MDEAH+(aq)+HCO
MDEAH+(aq)+HCO (aq) △H。
(aq) △H。
①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显__ 性(填酸,碱,中)。
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g) C(g)+D(aq)的Kθ=
C(g)+D(aq)的Kθ=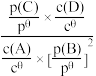 ,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=
,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=__ (计算结果保留两位小数)。
(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:
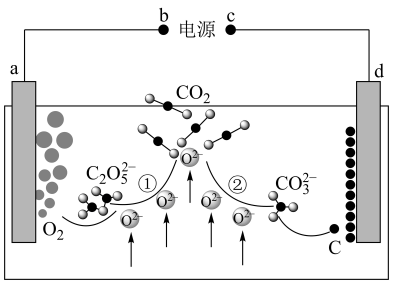
a极的电极反应式为__ 。
(1)CO2催化氢化制甲烷的研究过程如图1:

①上述过程中,加入铁粉的作用是
②HCOOH是CO2转化为CH4的中间体:CO2
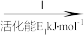 HCOOH
HCOOH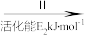 CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为

(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l)
 MDEAH+(aq)+HCO
MDEAH+(aq)+HCO (aq) △H。
(aq) △H。①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g)
 C(g)+D(aq)的Kθ=
C(g)+D(aq)的Kθ=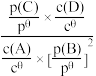 ,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=
,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:

a极的电极反应式为
您最近一年使用:0次
3 . 焦亚硫酸钠(Na2S2O5)常用作葡萄酒、果脯等食品的抗氧化剂。
Ⅰ.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为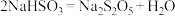 。
。
③水溶液中 、
、 、
、 的物质的量分数随
的物质的量分数随 的分布如图1所示。
的分布如图1所示。
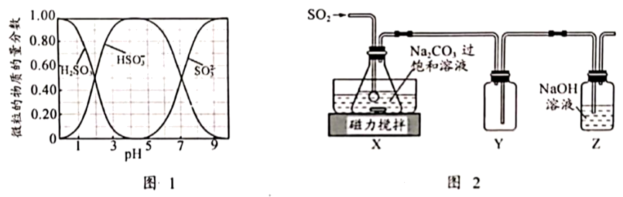
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为___________ 。
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右___________ 。20℃静置结晶,经减压抽滤、洗涤、 ℃干燥,可获得Na2S2O5固体。
℃干燥,可获得Na2S2O5固体。
(3)装置Y的作用是___________ ;实验制得的Na2S2O5固体中含有一定量的Na2SO4,其原因是___________
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数 %。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
 (未配平)
(未配平)

准确称取 样品,快速置于预先加入
样品,快速置于预先加入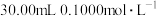 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置 ;用
;用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液 。
。
(4)滴定终点现象是___________
(5)通过计算判断该样品是否为优质品。(写出计算过程)___________
Ⅰ.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为
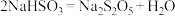 。
。③水溶液中
 、
、 、
、 的物质的量分数随
的物质的量分数随 的分布如图1所示。
的分布如图1所示。
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右
 ℃干燥,可获得Na2S2O5固体。
℃干燥,可获得Na2S2O5固体。(3)装置Y的作用是
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数
 %。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为: (未配平)
(未配平)
准确称取
 样品,快速置于预先加入
样品,快速置于预先加入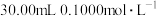 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置 ;用
;用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液 。
。(4)滴定终点现象是
(5)通过计算判断该样品是否为优质品。(写出计算过程)
您最近一年使用:0次
2021-09-11更新
|
476次组卷
|
4卷引用:江苏省苏州市2021-2022学年高三上学期期初调研考试化学试题
名校
解题方法
4 . 生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅。硅可由石英砂(主要成分是二氧化硅)制得,制备高纯硅的主要工艺流程如图所示:

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量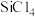 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)
(1)流程①焦炭体现了___________ (填“氧化性”或“还原性”)。
(2)流程③提纯SiHCl3的操作是___________ 。
(3)流程④的化学反应为置换反应,写出其化学方程式:___________ 。
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是___________ (填选项编号):
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是___________ (填试剂名称);装置C中的烧瓶需要加热,其目的是___________ 。
(5)反应一段时间后,装置D中观察到的现象是___________ 。
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________ ,该流程中能够循环利用的物质是___________ 。

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量
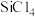 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)(1)流程①焦炭体现了
(2)流程③提纯SiHCl3的操作是
(3)流程④的化学反应为置换反应,写出其化学方程式:
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是
(5)反应一段时间后,装置D中观察到的现象是
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
您最近一年使用:0次
名校
5 . 回答下列问题:
Ⅰ.请根据下列实验装置回答问题:

(1)请写出装置图B中编号①仪器的名称:___________ 。
(2)实验室用高锰酸钾制取较纯净的氧气时,选择发生装置和收集装置的组合为___________ ,(填装置序号)该反应的化学方程式_____ ,制备一分子氧气时转移的电子数目为_____ 个。
Ⅱ.实验探究
探究双氧水的氧化性和还原性
(3)实验室用二氧化锰催化双氧水可以快速反应制备氧气,请用双线桥法来表示该反应中电子转移情况___________ ,该反应中氧化产物和还原产物的个数比为___________ ,该反应中体现了双氧水的性质是___________ 。
(4)向盛有硫酸酸化的 溶液的试管中滴加
溶液的试管中滴加 溶液,振荡。溶液紫红色褪去,产生大量无色气泡,把带火星的木条伸入试管口木条复燃。已知反应生成了无色的
溶液,振荡。溶液紫红色褪去,产生大量无色气泡,把带火星的木条伸入试管口木条复燃。已知反应生成了无色的 溶液,则该反应的离子方程式为
溶液,则该反应的离子方程式为___________ ,双氧水作___________ 剂。
(5)向双氧水中通入 气体,有淡黄色S沉淀产生,则该反应中氧化剂和还原剂的的个数比为
气体,有淡黄色S沉淀产生,则该反应中氧化剂和还原剂的的个数比为___________ 。
结论:双氧水既有氧化性又有还原性。
Ⅰ.请根据下列实验装置回答问题:

(1)请写出装置图B中编号①仪器的名称:
(2)实验室用高锰酸钾制取较纯净的氧气时,选择发生装置和收集装置的组合为
Ⅱ.实验探究
探究双氧水的氧化性和还原性
(3)实验室用二氧化锰催化双氧水可以快速反应制备氧气,请用双线桥法来表示该反应中电子转移情况
(4)向盛有硫酸酸化的
 溶液的试管中滴加
溶液的试管中滴加 溶液,振荡。溶液紫红色褪去,产生大量无色气泡,把带火星的木条伸入试管口木条复燃。已知反应生成了无色的
溶液,振荡。溶液紫红色褪去,产生大量无色气泡,把带火星的木条伸入试管口木条复燃。已知反应生成了无色的 溶液,则该反应的离子方程式为
溶液,则该反应的离子方程式为(5)向双氧水中通入
 气体,有淡黄色S沉淀产生,则该反应中氧化剂和还原剂的的个数比为
气体,有淡黄色S沉淀产生,则该反应中氧化剂和还原剂的的个数比为结论:双氧水既有氧化性又有还原性。
您最近一年使用:0次
名校
6 . 实验室利用如图所示的装置制备干燥、纯净的氯气。
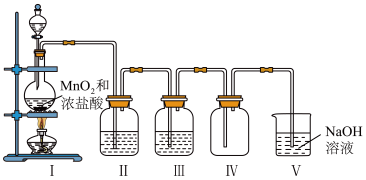
(1)写出装置I中制备氯气的化学方程式:_______ ,其中氧化剂与还原剂的个数比是_______ 。
(2)装置III中的药品是浓硫酸,其作用是_______ 。
(3)若用湿润的淀粉-KI试纸检验装置IV中收集的氯气,实验现象是_______ 。
(4)装置Ⅴ的作用是_______ ,发生反应的离子方程式为_______ ,当1个氯气分子参加反应时,转移的电子数是_______ 。
(5)若用10.0克软锰矿(主要成分是二氧化锰)与足量的浓盐酸反应制得7.1克氯气,则软锰矿中二氧化锰的质量分数是_______ 。

(1)写出装置I中制备氯气的化学方程式:
(2)装置III中的药品是浓硫酸,其作用是
(3)若用湿润的淀粉-KI试纸检验装置IV中收集的氯气,实验现象是
(4)装置Ⅴ的作用是
(5)若用10.0克软锰矿(主要成分是二氧化锰)与足量的浓盐酸反应制得7.1克氯气,则软锰矿中二氧化锰的质量分数是
您最近一年使用:0次
名校
7 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效广谱的灭菌消毒剂。棕黄色的 气体是次氯酸的酸酐,溶于水生成次氯酸,实验室模拟工业制备次氯酸的装置如图所示(夹持装置已略)。
气体是次氯酸的酸酐,溶于水生成次氯酸,实验室模拟工业制备次氯酸的装置如图所示(夹持装置已略)。

已知:
① 气体在42℃以上会发生分解,浓度过大会发生爆炸;
气体在42℃以上会发生分解,浓度过大会发生爆炸;
②工业上用氯气与潮湿的碳酸钠反应制得 ,同时生成两种钠盐该反应放热。
,同时生成两种钠盐该反应放热。
(1)仪器m的名称___________ ;装置A中发生反应的离子反应方程式___________ ;
(2)装置B中盛放的适宜试剂是___________ ;B中通入空气的原因是___________ ;
(3)装置C中主要发生反应的化学方程式___________ ;
(4)实验中,装置C需要冷却的原因是___________ ;
(5)装置D中多孔球泡的作用___________ ;装置E中碱石灰的作用是___________ ;
(6)此法相对于用氯气直接溶于水制备次氯酸溶液的优点是___________ (答出一条即可)。
 气体是次氯酸的酸酐,溶于水生成次氯酸,实验室模拟工业制备次氯酸的装置如图所示(夹持装置已略)。
气体是次氯酸的酸酐,溶于水生成次氯酸,实验室模拟工业制备次氯酸的装置如图所示(夹持装置已略)。
已知:
①
 气体在42℃以上会发生分解,浓度过大会发生爆炸;
气体在42℃以上会发生分解,浓度过大会发生爆炸;②工业上用氯气与潮湿的碳酸钠反应制得
 ,同时生成两种钠盐该反应放热。
,同时生成两种钠盐该反应放热。(1)仪器m的名称
(2)装置B中盛放的适宜试剂是
(3)装置C中主要发生反应的化学方程式
(4)实验中,装置C需要冷却的原因是
(5)装置D中多孔球泡的作用
(6)此法相对于用氯气直接溶于水制备次氯酸溶液的优点是
您最近一年使用:0次
2021-12-04更新
|
540次组卷
|
3卷引用:内蒙古自治区呼和浩特市2021-2022学年高三上学期月考调研化学试题
解题方法
8 . 回答下列问题
(1)在汽车尾气系统中装置催化转化器,可有效降低 NOx 的排放,当尾气中空气不足时,NOx在催化转化器中被还原成 N2 排出。 写出 NO 被 CO 还原的化学方程式:_____ 。
(2)实验室里迅速制备少量氯气可利用以下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①用双线桥法表示出电子转移情况:_____ 。
②用单线桥法表示出电子转移情况:_____ 。
③该反应中氧化剂是_____ ,发生氧化反应的是_____ 。
(1)在汽车尾气系统中装置催化转化器,可有效降低 NOx 的排放,当尾气中空气不足时,NOx在催化转化器中被还原成 N2 排出。 写出 NO 被 CO 还原的化学方程式:
(2)实验室里迅速制备少量氯气可利用以下反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①用双线桥法表示出电子转移情况:
②用单线桥法表示出电子转移情况:
③该反应中氧化剂是
您最近一年使用:0次
2021-10-28更新
|
99次组卷
|
2卷引用:山西省陵川县平城中学2021-2022学年高一上学期第一次月考化学试题
名校
解题方法
9 . 次氯酸(HClO)消毒液高效安全,适用于一般物体表面消毒、手部消毒,以及地面、空间和环境消毒。下图装置在D中制得颜色类似于氯气的Cl2O气体,E中得到次氯酸(HClO)。已知Cl2O气体45℃可分解,与水反应生成HClO。

(1)A装置圆底烧瓶中固体物质是___________ 。
(2)C装置、F装置中分别盛装___________ 、___________ 。
(3)实验时,一直要通入干燥的空气,其体积大约是氯气的3倍,主要作用是___________ ,同时还可以抑制Cl2O的分解,保证实验安全。
(4)D中盛装含水碳酸钠(即Na2CO3与水按照质量106:9调制而成),用来吸收氯气制备Cl2O。
①如果用Na2CO3·xH2O表示含水碳酸钠,则x为___________ 。
②D中生成的气体中含有CO2,则生成Cl2O的化学方程式为___________ 。
(5)次氯酸含量分析:取E装置中试管内黄绿色溶液两等分,一份是通过与足量KI溶液反应生成n(I2),来测定n(HClO)与n(Cl2)两者之和;另一份是把氯元素全部转化为AgCl,通过n(AgCl)计算氯元素含量。实验结果是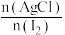 为17:16,则黄绿色溶液
为17:16,则黄绿色溶液 为
为___________ 。

(1)A装置圆底烧瓶中固体物质是
(2)C装置、F装置中分别盛装
(3)实验时,一直要通入干燥的空气,其体积大约是氯气的3倍,主要作用是
(4)D中盛装含水碳酸钠(即Na2CO3与水按照质量106:9调制而成),用来吸收氯气制备Cl2O。
①如果用Na2CO3·xH2O表示含水碳酸钠,则x为
②D中生成的气体中含有CO2,则生成Cl2O的化学方程式为
(5)次氯酸含量分析:取E装置中试管内黄绿色溶液两等分,一份是通过与足量KI溶液反应生成n(I2),来测定n(HClO)与n(Cl2)两者之和;另一份是把氯元素全部转化为AgCl,通过n(AgCl)计算氯元素含量。实验结果是
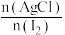 为17:16,则黄绿色溶液
为17:16,则黄绿色溶液 为
为
您最近一年使用:0次
2021-10-24更新
|
232次组卷
|
3卷引用:安徽省皖南八校2021-2022学年高三上学期10月第一次联考化学试题
名校
10 .  是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、
是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、 、MnOOH、
、MnOOH、 、
、 等)为原料制备
等)为原料制备 的过程如下:
的过程如下:

已知:i.锰酸钾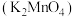 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
ii.已知相关物质的溶解度如图所示

回答下列问题:
(1)步骤Ⅰ的操作包括往废电池糊状填充物中加水,过滤、洗涤、灼烧。其中灼烧的目的主要是_______ (用化学方程式表示)。
(2)步骤Ⅱ中先将一定比例的KOH和 固体放于
固体放于_______ (填仪器名称)中加热至熔融,再分多次小心加入 粉末,搅拌并继续加热可得墨绿色固体,其主要成分为
粉末,搅拌并继续加热可得墨绿色固体,其主要成分为 ,加水溶解得到
,加水溶解得到 的强碱性溶液。写出
的强碱性溶液。写出 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)步骤Ⅲ的实验装置如图所示。
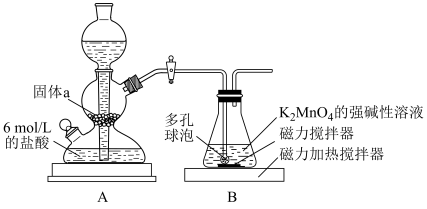
①固体a可以为_______ (填字母序号)。
A. B.
B. C.
C.
②装置B中随着 通入可观察到的现象是
通入可观察到的现象是_______ ,实验需控制 的用量,可能原因是
的用量,可能原因是_______ 。实验结束后,将装置B中溶液过滤,对滤液蒸发浓缩,冷却结晶,过滤、洗涤、干燥即可得到 晶体。
晶体。
③实验装置存在一处缺陷,可能会导致 产率降低,改进的方法是
产率降低,改进的方法是_______ 。
(4)测定 纯度的步骤如下:
纯度的步骤如下:
①称取1.5000g产物晶体,用适量稀硫酸溶解后配成250mL溶液。
②配制0.1000mol/L的标准草酸 溶液250mL。
溶液250mL。
③移取标准草酸溶液25.00mL于锥形瓶中,用所配 溶液滴定至终点,记录消耗的溶液体积。
溶液滴定至终点,记录消耗的溶液体积。
④重复3次,平均消耗 溶液29.80mL。
溶液29.80mL。
则产品中 的纯度(质量分数)为
的纯度(质量分数)为_______ %(保留小数点后两位)。
 是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、
是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、 、MnOOH、
、MnOOH、 、
、 等)为原料制备
等)为原料制备 的过程如下:
的过程如下:
已知:i.锰酸钾
 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
ii.已知相关物质的溶解度如图所示

回答下列问题:
(1)步骤Ⅰ的操作包括往废电池糊状填充物中加水,过滤、洗涤、灼烧。其中灼烧的目的主要是
(2)步骤Ⅱ中先将一定比例的KOH和
 固体放于
固体放于 粉末,搅拌并继续加热可得墨绿色固体,其主要成分为
粉末,搅拌并继续加热可得墨绿色固体,其主要成分为 ,加水溶解得到
,加水溶解得到 的强碱性溶液。写出
的强碱性溶液。写出 发生反应的化学方程式为
发生反应的化学方程式为(3)步骤Ⅲ的实验装置如图所示。

①固体a可以为
A.
 B.
B. C.
C.
②装置B中随着
 通入可观察到的现象是
通入可观察到的现象是 的用量,可能原因是
的用量,可能原因是 晶体。
晶体。③实验装置存在一处缺陷,可能会导致
 产率降低,改进的方法是
产率降低,改进的方法是(4)测定
 纯度的步骤如下:
纯度的步骤如下:①称取1.5000g产物晶体,用适量稀硫酸溶解后配成250mL溶液。
②配制0.1000mol/L的标准草酸
 溶液250mL。
溶液250mL。③移取标准草酸溶液25.00mL于锥形瓶中,用所配
 溶液滴定至终点,记录消耗的溶液体积。
溶液滴定至终点,记录消耗的溶液体积。④重复3次,平均消耗
 溶液29.80mL。
溶液29.80mL。则产品中
 的纯度(质量分数)为
的纯度(质量分数)为
您最近一年使用:0次



