1 .  在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。
在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。
I. 的性质探究
的性质探究
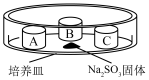
装置如下表(图)所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向 固体上滴加
固体上滴加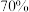 硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。
硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。
(1)70%浓硫酸溶液和 固体反应制备
固体反应制备 的化学方程式为
的化学方程式为________________________________ 。
(2)瓶盖A中发生反应的化学方程式为________________________________ 。
(3)瓶盖A中无明显变化,若要证明A中发生了化学反应,可先在蒸馏水中滴入少量试剂X,X是_______ (填字母)。
a. 溶液 b.
溶液 b. 溶液 c.石蕊溶液
溶液 c.石蕊溶液
(4)瓶盖_______ (填字母)中的实验现象能证明 具有还原性,反应的离子方程式为
具有还原性,反应的离子方程式为______________ 。
(5)综合上述实验信息可证明 具有还原性、
具有还原性、___________________________________ 等性质。
(6)增加瓶盖D可验证 具有氧化性,则D中盛装的试剂及现象是
具有氧化性,则D中盛装的试剂及现象是__________________________ 。
II.化石燃料燃烧会产生大量的 ,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。
,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。
(7)如果不对燃煤烟气脱硫,易形成硫酸型酸雨,酸雨一般指的是 小于
小于_______________ 的降雨。
(8)方法I中氨水吸收燃煤烟气中 的化学反应为:
的化学反应为: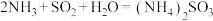 、
、__________ 。
(9)方法II中用 将
将 还原为S时,
还原为S时, 转化为
转化为_______________ (填化学式)。
(10)对方法III吸收 后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
后的溶液加热可使吸收液再生,其反应属于基本反应类型中的___________ 反应。
 在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。
在工农业生产生活中都有重要的用途。某化学研究小组设计如下过程,请你参与探究,回答相关问题。I.
 的性质探究
的性质探究装置如下表(图)所示,培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向
 固体上滴加
固体上滴加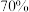 硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。
硫酸,迅速用玻璃片将培养皿盖严,实验现象记录如下。实验装置 | 㼛盖 | 物质 | 实验现象 |
| A | 蒸馏水 | 无明显变化 |
B |
| 溶液褪色 | |
C | 蘸有品红溶液的棉花 | 品红溶液褪色 |
(1)70%浓硫酸溶液和
 固体反应制备
固体反应制备 的化学方程式为
的化学方程式为(2)瓶盖A中发生反应的化学方程式为
(3)瓶盖A中无明显变化,若要证明A中发生了化学反应,可先在蒸馏水中滴入少量试剂X,X是
a.
 溶液 b.
溶液 b. 溶液 c.石蕊溶液
溶液 c.石蕊溶液(4)瓶盖
 具有还原性,反应的离子方程式为
具有还原性,反应的离子方程式为(5)综合上述实验信息可证明
 具有还原性、
具有还原性、(6)增加瓶盖D可验证
 具有氧化性,则D中盛装的试剂及现象是
具有氧化性,则D中盛装的试剂及现象是II.化石燃料燃烧会产生大量的
 ,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。
,造成环境污染,某化学研究小组设计如下表列出的3种燃煤烟气脱硫方法的原理。方法1 | 用氨水将 转化为 转化为 ,再氧化成 ,再氧化成 |
方法2 | 用生物质热解气(主要成分 、 、 、 、 )将 )将 在高温下还原成单质硫,其他生成物均可直接排放 在高温下还原成单质硫,其他生成物均可直接排放 |
方法3 | 用 溶液吸收 溶液吸收 ,再经电解转化为 ,再经电解转化为 |
(7)如果不对燃煤烟气脱硫,易形成硫酸型酸雨,酸雨一般指的是
 小于
小于(8)方法I中氨水吸收燃煤烟气中
 的化学反应为:
的化学反应为: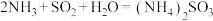 、
、(9)方法II中用
 将
将 还原为S时,
还原为S时, 转化为
转化为(10)对方法III吸收
 后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
您最近一年使用:0次
2024-01-17更新
|
125次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题
名校
2 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:

(1)乙装置的作用是___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ 。
(3)实验完毕后,对甲装置中混合液蒸发浓缩、___________ 、过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入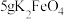 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
(4)根据上述实验现象,可以判断产生的气体中含有___________ ,产生该气体的原因是___________ ,经测定所得气体中还含有 。
。
(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。
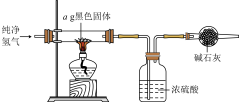
当黑色固体完全反应后,测得浓硫酸质量净增bg,当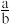 等于
等于___________ (用分数表示)时,黑色固体为 。
。
(6)在其他条件相同时,测得一定浓度的 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
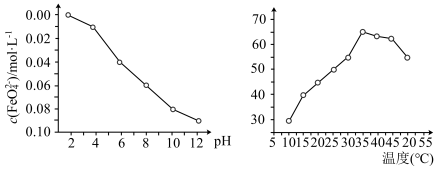
①根据左图得出结论是___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(7)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“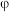 ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验___________ (填“1”或“2”)能证明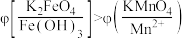 。
。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示:
(1)乙装置的作用是
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:(3)实验完毕后,对甲装置中混合液蒸发浓缩、
实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。(4)根据上述实验现象,可以判断产生的气体中含有
 。
。(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。

当黑色固体完全反应后,测得浓硫酸质量净增bg,当
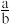 等于
等于 。
。(6)在其他条件相同时,测得一定浓度的
 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
①根据左图得出结论是
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(7)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“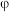 ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验
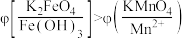 。
。
您最近一年使用:0次
解题方法
3 . 某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验,请回答下列问题:

(1)制备氯气的化学方程式为___________ 。
(2)淀粉—KI溶液中观察到的现象是___________ ,反应的化学方程式为___________ 。
(3)若干燥的有色布条不褪色,潮湿的有色布条褪色,则说明___________ 。
(4)工业上常用廉价的石灰乳吸收氯气制得漂白粉。漂白粉溶于水后,遇到空气中CO2的,即产生漂白、杀菌作用,用化学方程式表示漂白粉的漂白原理___________ 。
(5)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(b、c、d、e中重合部分代表物质间反应,且氯水足量)。

①a过程的化学方程式___________ 。
②d过程所观察到的现象为___________ ;c过程证明了氯水中存在的微粒是___________ 。
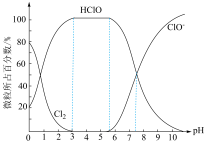
③已知25℃时,氯水中Cl2(溶于水的氯气分子)、HClO、ClO三种微粒所占百分数与pH的关系如图,则用Cl2处理饮用水时,溶液的pH最佳控制范围是___________ 。
(6)实验室制取Cl2还可采用KMnO4与浓盐酸混合,其原理为: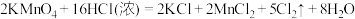 ,试回答下列问题:
,试回答下列问题:
①请用双线桥表示反应中电子转移:___________ ;
②反应中氧化剂与还原剂的物质的量之比___________ ,在标准状况下,当生成11.2LCl2时,被氧化的HCl的物质的量为___________ 。

(1)制备氯气的化学方程式为
(2)淀粉—KI溶液中观察到的现象是
(3)若干燥的有色布条不褪色,潮湿的有色布条褪色,则说明
(4)工业上常用廉价的石灰乳吸收氯气制得漂白粉。漂白粉溶于水后,遇到空气中CO2的,即产生漂白、杀菌作用,用化学方程式表示漂白粉的漂白原理
(5)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(b、c、d、e中重合部分代表物质间反应,且氯水足量)。

①a过程的化学方程式
②d过程所观察到的现象为
③已知25℃时,氯水中Cl2(溶于水的氯气分子)、HClO、ClO三种微粒所占百分数与pH的关系如图,则用Cl2处理饮用水时,溶液的pH最佳控制范围是

(6)实验室制取Cl2还可采用KMnO4与浓盐酸混合,其原理为:
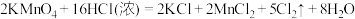 ,试回答下列问题:
,试回答下列问题:①请用双线桥表示反应中电子转移:
②反应中氧化剂与还原剂的物质的量之比
您最近一年使用:0次
名校
4 . 二氧化氯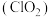 是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下
是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下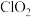 是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备
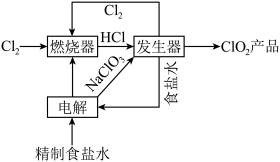
是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备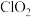 ,其工序包括制备氯酸钠,盐酸合成和
,其工序包括制备氯酸钠,盐酸合成和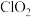 制取,主要工艺流程如图所示。
制取,主要工艺流程如图所示。
回答下列问题:
(1)工艺流程图涉及到的物质化学式或物质名称,其中能导电的是___________ ,属于电解质的是___________ 。
(2)实验室模拟“燃烧器”中发生的反应,观察到的现象有___________ 。
(3)“发生器”中发生反应的离子方程式为___________ ,若整个过程制得 ,则理论上分别向装置中补充
,则理论上分别向装置中补充___________ (填质量和物质名称)恢复至起始状态。
(4)粗盐中常常含有泥沙、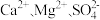 等杂质,粗盐提纯的步骤中加入稍过量的
等杂质,粗盐提纯的步骤中加入稍过量的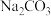 的目的是
的目的是___________ ,经一系列操作可得制食盐水,电解精制食盐水制得 同时还会获取轻质燃料氢气,则离子方程式为
同时还会获取轻质燃料氢气,则离子方程式为___________ 。
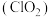 是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下
是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下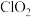 是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备
是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备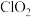 ,其工序包括制备氯酸钠,盐酸合成和
,其工序包括制备氯酸钠,盐酸合成和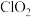 制取,主要工艺流程如图所示。
制取,主要工艺流程如图所示。
回答下列问题:
(1)工艺流程图涉及到的物质化学式或物质名称,其中能导电的是
(2)实验室模拟“燃烧器”中发生的反应,观察到的现象有
(3)“发生器”中发生反应的离子方程式为
 ,则理论上分别向装置中补充
,则理论上分别向装置中补充(4)粗盐中常常含有泥沙、
 等杂质,粗盐提纯的步骤中加入稍过量的
等杂质,粗盐提纯的步骤中加入稍过量的 的目的是
的目的是 同时还会获取轻质燃料氢气,则离子方程式为
同时还会获取轻质燃料氢气,则离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,·些水管的活塞会“自动”熔化,喷出水来。由一种铋矿[主要成分为 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
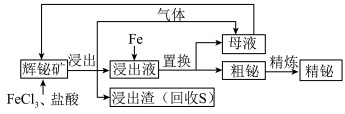
已知:酸性条件下的氧化性: 。
。
(1)“浸出”过程中,溶液中放出的气体是_________ ;放出该气体的离子方程式是________ 。
(2)加入 溶液的目的是
溶液的目的是___________ ,该反应的离子方程式是___________ 。
(3)检验母液中所含有的主要金属阳离子的方法是___________ 。
(4)铋的+5价盐类(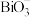 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究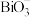 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:
据图回答下面的问题:
①上述试剂的氧化性强弱顺序为:___________ 。
②写出 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向_________ ,已知 不溶于水。)
不溶于水。)
 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
已知:酸性条件下的氧化性:
 。
。(1)“浸出”过程中,溶液中放出的气体是
(2)加入
 溶液的目的是
溶液的目的是(3)检验母液中所含有的主要金属阳离子的方法是
(4)铋的+5价盐类(
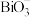 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究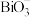 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:| 加入溶液 | ①适量铋酸钠固体 | ②过量的双氧水 | ③加入淀粉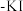 溶液 溶液 |
| 实验现象 | 溶液呈现紫红色 | 紫红色消失,产生气泡 | 溶液变为蓝色 |
①上述试剂的氧化性强弱顺序为:
②写出
 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向 不溶于水。)
不溶于水。)
您最近一年使用:0次
6 . 连四硫酸钠( )能延长血液凝结时间,是生物酶、生物键的修复剂。某研究小组设计实验探究连四硫酸钠的性质,装置如图所示,回答下列问题:
)能延长血液凝结时间,是生物酶、生物键的修复剂。某研究小组设计实验探究连四硫酸钠的性质,装置如图所示,回答下列问题:
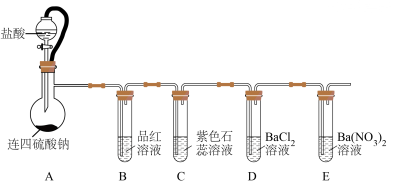
实验中,发现A中产生气体和浅黄色固体。B中溶液褪色,C中溶液变红色,D中不产生沉淀,E中产生白色沉淀。
(1)工业上用双氧水和 反应制备连四硫酸钠。写出该反应的化学方程式
反应制备连四硫酸钠。写出该反应的化学方程式___________ 。
(2)B中现象说明A中产生了___________ (填化学式),用文字解释C中现象___________ 。
(3)分析D和E中现象说明E中产生的白色沉淀是___________ (填化学式)。从环保角度分析,本实验需要改进之处是___________ 。
(4)实验完毕后,取E中上层清液于试管中,加入铜片,片刻后,溶液变为蓝绿色,并产生气泡,由此推知,E中主要发生的反应是___________ (填序号)。
①
②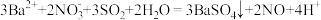
(5)写出A中发生反应的离子方程式___________ 。
(6)连四硫酸钠保存不善会变质,设计简单实验证明连四硫酸钠已变质:___________ 。
 )能延长血液凝结时间,是生物酶、生物键的修复剂。某研究小组设计实验探究连四硫酸钠的性质,装置如图所示,回答下列问题:
)能延长血液凝结时间,是生物酶、生物键的修复剂。某研究小组设计实验探究连四硫酸钠的性质,装置如图所示,回答下列问题:
实验中,发现A中产生气体和浅黄色固体。B中溶液褪色,C中溶液变红色,D中不产生沉淀,E中产生白色沉淀。
(1)工业上用双氧水和
 反应制备连四硫酸钠。写出该反应的化学方程式
反应制备连四硫酸钠。写出该反应的化学方程式(2)B中现象说明A中产生了
(3)分析D和E中现象说明E中产生的白色沉淀是
(4)实验完毕后,取E中上层清液于试管中,加入铜片,片刻后,溶液变为蓝绿色,并产生气泡,由此推知,E中主要发生的反应是
①

②
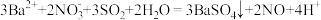
(5)写出A中发生反应的离子方程式
(6)连四硫酸钠保存不善会变质,设计简单实验证明连四硫酸钠已变质:
您最近一年使用:0次
解题方法
7 . 二氧化氯 具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为
具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为 。某实验小组利用如下装置制备、收集
。某实验小组利用如下装置制备、收集 并验证其化学性质,化学方程式为
并验证其化学性质,化学方程式为 。请回答下列问题:
。请回答下列问题:
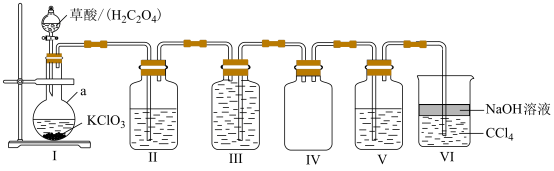
(1)装置I中仪器a的名称为___________ 。
(2)同学们查找数据发现:
① 在
在 溶液中的溶解度较小;
溶液中的溶解度较小;
② 与
与 溶液发生反应:____
溶液发生反应:____ ____
____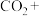 ____
____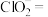 ____
____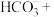 ____
____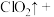 ____
____ 。
。
请配平该离子方程式___________ 。
(3)装置II和III中均盛有饱和 溶液,请指出它们的作用。
溶液,请指出它们的作用。
装置II:___________ ,装置III:___________ 。
(4)装置V中盛有淀粉碘化钾溶液,实验时观察到的现象为___________ ;装置VI中 的作用是
的作用是___________ 。
(5)消毒效率一般以单位质量氧化剂所得的电子数表示,则 和
和 消毒效率更高的是
消毒效率更高的是___________ 。
 具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为
具有强氧化性,常用于饮用水的消毒,是国际上公认的绿色消毒剂,在水处理时自身被还原为 。某实验小组利用如下装置制备、收集
。某实验小组利用如下装置制备、收集 并验证其化学性质,化学方程式为
并验证其化学性质,化学方程式为 。请回答下列问题:
。请回答下列问题:
(1)装置I中仪器a的名称为
(2)同学们查找数据发现:
①
 在
在 溶液中的溶解度较小;
溶液中的溶解度较小;②
 与
与 溶液发生反应:____
溶液发生反应:____ ____
____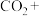 ____
____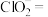 ____
____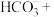 ____
____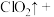 ____
____ 。
。请配平该离子方程式
(3)装置II和III中均盛有饱和
 溶液,请指出它们的作用。
溶液,请指出它们的作用。装置II:
(4)装置V中盛有淀粉碘化钾溶液,实验时观察到的现象为
 的作用是
的作用是(5)消毒效率一般以单位质量氧化剂所得的电子数表示,则
 和
和 消毒效率更高的是
消毒效率更高的是
您最近一年使用:0次
8 . 某小组同学利用如图装置制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:_______ ;装置B可贮存多余的气体,则B中所盛装的液体是_______ 。
(2)装置C的作用是证明 无漂白性,但其水溶液具有漂白性,则Ⅱ、Ⅲ处依次应放入的物质是
无漂白性,但其水溶液具有漂白性,则Ⅱ、Ⅲ处依次应放入的物质是_______ (填标号)。
a.干燥的石蕊试纸 b.湿润的石蕊试纸 c.碱石灰 d.氯化钙
(3)实验发现装置E中溶液显浅棕色。查阅资料: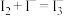 ,
, 在溶液中显棕黄色,能使淀粉变蓝:
在溶液中显棕黄色,能使淀粉变蓝: 可被
可被 氧化为
氧化为 (红色)和
(红色)和 (黄色),两种离子可被氧化成
(黄色),两种离子可被氧化成 (无色)。为探究溶液显浅棕色的原因进行如下实验:
(无色)。为探究溶液显浅棕色的原因进行如下实验:
①操作a的实验目的是_______ ;由实验可知,E中溶液显浅棕色可能的原因是_______ 。
②实验证明 与
与 反应的最终产物是
反应的最终产物是 ,其离子方程式为
,其离子方程式为_______ 。
(4)室温下测得装置F的溶液中,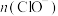 、
、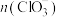 与反应时间t的关系如图。
与反应时间t的关系如图。 、
、 外,其他各离子浓度由大到小的顺序是
外,其他各离子浓度由大到小的顺序是_______ ;用离子方程式说明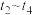 时间内,
时间内,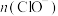 逐渐减小的原因
逐渐减小的原因_______ 。
 并探究其性质。回答下列问题:
并探究其性质。回答下列问题: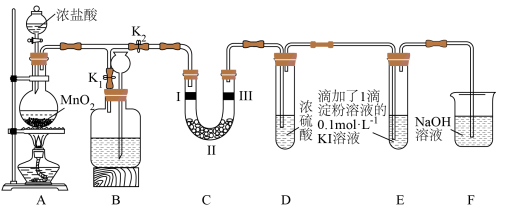
(2)装置C的作用是证明
 无漂白性,但其水溶液具有漂白性,则Ⅱ、Ⅲ处依次应放入的物质是
无漂白性,但其水溶液具有漂白性,则Ⅱ、Ⅲ处依次应放入的物质是a.干燥的石蕊试纸 b.湿润的石蕊试纸 c.碱石灰 d.氯化钙
(3)实验发现装置E中溶液显浅棕色。查阅资料:
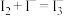 ,
, 在溶液中显棕黄色,能使淀粉变蓝:
在溶液中显棕黄色,能使淀粉变蓝: 可被
可被 氧化为
氧化为 (红色)和
(红色)和 (黄色),两种离子可被氧化成
(黄色),两种离子可被氧化成 (无色)。为探究溶液显浅棕色的原因进行如下实验:
(无色)。为探究溶液显浅棕色的原因进行如下实验:| 操作 | 现象 | |
| a | 取E中的溶液1 ,滴入1滴碘水 ,滴入1滴碘水 | 溶液变蓝 |
取E中的溶液1 ,滴入1滴淀粉 ,滴入1滴淀粉 | 溶液没有明显变化 | |
| b | 将 溶于 溶于 溶液,取该溶液1 溶液,取该溶液1 ,滴入1滴淀粉;持续通入 ,滴入1滴淀粉;持续通入 | 溶液先变蓝;通入 后蓝色褪去,溶液变为浅棕色,随后溶液变无色,最后溶液略显浅黄绿色。 后蓝色褪去,溶液变为浅棕色,随后溶液变无色,最后溶液略显浅黄绿色。 |
②实验证明
 与
与 反应的最终产物是
反应的最终产物是 ,其离子方程式为
,其离子方程式为(4)室温下测得装置F的溶液中,
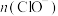 、
、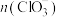 与反应时间t的关系如图。
与反应时间t的关系如图。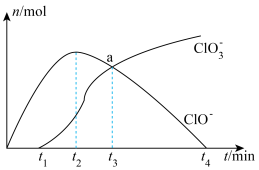
 、
、 外,其他各离子浓度由大到小的顺序是
外,其他各离子浓度由大到小的顺序是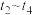 时间内,
时间内, 逐渐减小的原因
逐渐减小的原因
您最近一年使用:0次
2023-12-04更新
|
115次组卷
|
2卷引用:山东省烟台市2023-2024学年高一上学期期中考试化学试题
名校
解题方法
9 . 硫代尿素[(NH2)2CS]在工业上常用作还原剂,该物质易溶于水,温度较高时易发生异构化,实验室合成少量硫代尿素如图所示。回答下列问题:
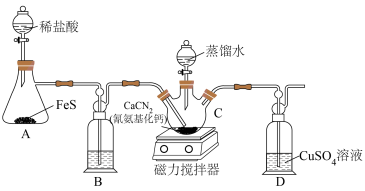
(1)工业上制备硫代尿素时,常利用碳将 高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与
高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与 发生反应的化学方程式
发生反应的化学方程式___________ 。
(2)装置B中盛放的是___________ (填写试剂名称),其作用是___________ 。
(3)实验开始时,先让A中反应一段时间,以便排出装置中的空气。当D中___________ (填写实验现象),则证明装置中的空气被排出。
(4)将蒸馏水滴入___________ 中(填写仪器C的名称),同时开启磁力搅拌器, 与
与 的水溶液反应生成硫代尿素。
的水溶液反应生成硫代尿素。
(5)C中反应结束后,将混合物过滤,将滤液减压蒸发浓缩、___________ (填写操作名称)、过滤、洗涤、低温烘干得到产品。蒸发浓缩时需要在减压条件下进行,其目的是___________ 。
(6)取2.0g制得的产品溶于水配成100mL溶液,量取25.00mL溶液,用0.50mol/L的酸性高锰酸钾溶液滴定,滴定至终点消耗酸性高锰酸钾溶液28.00mL,则产品的纯度为___________ %。已知滴定反应: 。
。

(1)工业上制备硫代尿素时,常利用碳将
 高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与
高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与 发生反应的化学方程式
发生反应的化学方程式(2)装置B中盛放的是
(3)实验开始时,先让A中反应一段时间,以便排出装置中的空气。当D中
(4)将蒸馏水滴入
 与
与 的水溶液反应生成硫代尿素。
的水溶液反应生成硫代尿素。(5)C中反应结束后,将混合物过滤,将滤液减压蒸发浓缩、
(6)取2.0g制得的产品溶于水配成100mL溶液,量取25.00mL溶液,用0.50mol/L的酸性高锰酸钾溶液滴定,滴定至终点消耗酸性高锰酸钾溶液28.00mL,则产品的纯度为
 。
。
您最近一年使用:0次
2023-11-15更新
|
206次组卷
|
3卷引用:湖北省名校联考2023-2024学年高三上学期11月期中考试化学试题
10 . 为探究不同价态铜的氧化物对电化学还原CO2产生的影响,某兴趣小组进行以下活动。
Ⅰ.制备过氧化铜(CuO2)
在含有0.5 gPVP(做稳定剂)的5 mL 0.01 mmol·L−1的CuCl2水溶液中,加入5 mL 0.03 mmol·L−1的NaOH溶液反应得到Cu(OH)2。随后在强磁力搅拌和0℃条件下,逐滴加入1 mL 30% H2O2反应0.5h,经一系列操作得到黄褐色的CuO2沉淀。
(1)由Cu(OH)2生成CuO2的化学方程式为___________ 。
(2)反应控制在0℃,原因是___________ 。
(3)为了探究CuO2的性质,分别向一定量的KMnO4溶液中缓慢加入(滴入)CuO2样品或H2O2溶液,实验结果如下 (已知:实验4与实验7均恰好反应完全):
CuO2样品和H2O2与酸性KMnO4溶液反应的用量及现象
①1mg CuO2样品与___________ μL的H2O2溶液还原能力相当
②若CuO2纯度为96%,过氧化氢物质的量浓度约为___________ mol·L−1.(1μL = 10−6L)
③“实验4”中,最终溶液的颜色是___________ 。
Ⅱ.制备CuO
将CuO2置于管式炉中(如下图所示),在O2气氛下300℃处理2 h,得到黑色的CuO。

已知:a. 加热时试管内会产生少量黄绿色单质气体
b. 高温下有如下反应:4CuO(s) 2Cu2O(s) + O2(g)。
2Cu2O(s) + O2(g)。
(4)装置D中盛放的试剂为___________ 。
(5)管式炉中CuO2反应的化学方程式为___________ 。
(6)通入氧气的目的是___________ 。
Ⅲ.探究CuO2催化电化学还原CO2的结果
(7)以KHCO3溶液为电解液,在指定的电势区间,利用CuO2催化还原CO2,测得阴极产物组成及电流效率(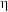 )如下表所示:(
)如下表所示:(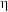 =
= )
)
①该条件下,CO2还原产物有___________ 种
②CH4与C2H4物质的量之比为___________ 。
Ⅰ.制备过氧化铜(CuO2)
在含有0.5 gPVP(做稳定剂)的5 mL 0.01 mmol·L−1的CuCl2水溶液中,加入5 mL 0.03 mmol·L−1的NaOH溶液反应得到Cu(OH)2。随后在强磁力搅拌和0℃条件下,逐滴加入1 mL 30% H2O2反应0.5h,经一系列操作得到黄褐色的CuO2沉淀。
(1)由Cu(OH)2生成CuO2的化学方程式为
(2)反应控制在0℃,原因是
(3)为了探究CuO2的性质,分别向一定量的KMnO4溶液中缓慢加入(滴入)CuO2样品或H2O2溶液,实验结果如下 (已知:实验4与实验7均恰好反应完全):
CuO2样品和H2O2与酸性KMnO4溶液反应的用量及现象
| 编号 | m(CuO2)/mg | V(H2O2)/ μL | V(H2SO4)/mL | V(KMnO4)/ μL | 实验结束时溶液的颜色 |
| 1 | - | - | 2 | 10 | 紫色 |
| 2 | 1 | - | 2 | 10 | 浅紫色 |
| 3 | 2 | - | 2 | 10 | 浅紫色 |
| 4 | 4 | - | 2 | 10 | - |
| 5 | - | 10 | 2 | 10 | 浅紫色 |
| 6 | - | 20 | 2 | 10 | 浅紫色 |
| 7 | - | 40 | 2 | 10 | 无色 |
②若CuO2纯度为96%,过氧化氢物质的量浓度约为
③“实验4”中,最终溶液的颜色是
Ⅱ.制备CuO
将CuO2置于管式炉中(如下图所示),在O2气氛下300℃处理2 h,得到黑色的CuO。

已知:a. 加热时试管内会产生少量黄绿色单质气体
b. 高温下有如下反应:4CuO(s)
 2Cu2O(s) + O2(g)。
2Cu2O(s) + O2(g)。 (4)装置D中盛放的试剂为
(5)管式炉中CuO2反应的化学方程式为
(6)通入氧气的目的是
Ⅲ.探究CuO2催化电化学还原CO2的结果
(7)以KHCO3溶液为电解液,在指定的电势区间,利用CuO2催化还原CO2,测得阴极产物组成及电流效率(
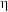 )如下表所示:(
)如下表所示:(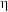 =
= )
)| 阴极产物 | CO | CH4 | C2H4 | H2 |
| 电流效率/% | 5 | 18 | 30 | 15 |
②CH4与C2H4物质的量之比为
您最近一年使用:0次
2023-05-09更新
|
335次组卷
|
2卷引用:福建省龙岩市2023届高中毕业班五月教学质量检测化学试题