1 . 氧钒碱式碳酸铵晶体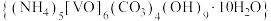 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。
Ⅰ.制备
步骤1:向 中加入足量盐酸酸化的
中加入足量盐酸酸化的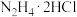 溶液,微沸数分钟。
溶液,微沸数分钟。
步骤2:向足量 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。
步骤3:反应结束后抽滤,先后用饱和 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。
(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为______ 。
(2)用无水乙醇洗涤的目的是______ 。
(3)“步骤2”可在如图装置中进行。______ 。(按气流方向,用字母标号表示)。
②检查装置气密性,加入试剂。先打开 ,通入一段时间气体目的是
,通入一段时间气体目的是______ ,当观察到______ (填实验现象)时,再关闭 ,打开
,打开 ,进行实验。
,进行实验。
③生成氧钒碱式碳酸铵晶体的化学方程式为______ 。
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用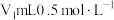 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗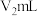 盐酸。
盐酸。
已知: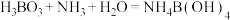 ,
, 。
。
(4)“冰盐水”的作用是______ 。
(5)样品中氮元素质量分数的表达式为______ 。
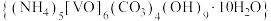 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。Ⅰ.制备
步骤1:向
 中加入足量盐酸酸化的
中加入足量盐酸酸化的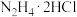 溶液,微沸数分钟。
溶液,微沸数分钟。步骤2:向足量
 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。步骤3:反应结束后抽滤,先后用饱和
 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为
(2)用无水乙醇洗涤的目的是
(3)“步骤2”可在如图装置中进行。
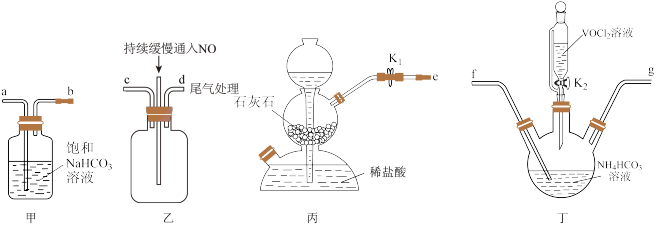
②检查装置气密性,加入试剂。先打开
 ,通入一段时间气体目的是
,通入一段时间气体目的是 ,打开
,打开 ,进行实验。
,进行实验。③生成氧钒碱式碳酸铵晶体的化学方程式为
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用
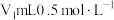 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗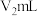 盐酸。
盐酸。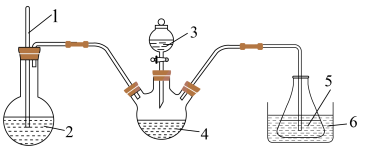
已知:
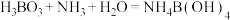 ,
, 。
。(4)“冰盐水”的作用是
(5)样品中氮元素质量分数的表达式为
您最近一年使用:0次
2 . NH4CuSO3(亚硫酸亚铜铵)是一种白色难溶于水的化工产品,在空气中易变质,难溶于酒精。某小组设计实验制备NH4CuSO3,并探究SO2的漂白原理。已知:品红易溶于酒精、水。
回答下列问题:
(1)装饱和NaHSO3溶液的仪器是___________ (填名称),C装置的作用是___________ 。
(2)写出A中化学反应方程式:___________ 。
(3)从环保角度考虑,上述方案不足之处是___________ 。
(4)实验完毕后,分离B中产品的操作是___________ 、酒精洗涤、干燥。用酒精替代水洗涤的目的是___________ 。
(5)由D、E中实验现象说明:SO2漂白品红必须在___________ (填化学式)存在条件下进行。
(6)探究 NH4CuSO3的性质。取少量产品于试管中,滴加稀硫酸,发现溶液变蓝色,生成红色固体,产生的气体通入酸性KMnO4溶液中,溶液由紫红色变为无色。写出NH4CuSO3和稀硫酸反应的离子方程式:___________ 。
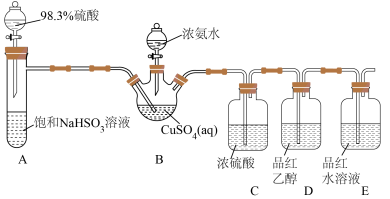
(7)取mg NH4CuSO3产品于锥形瓶中,加入适量稀硫酸,充分反应后,加蒸馏水稀释至250mL,取25.00mL,加入足量KI溶液,滴几滴淀粉溶液,用标准0.1mol/LNa2S2O3溶液滴定至终点,消耗滴定液20.00mL。该产品纯度为___________ %(用含m的代数式表示)。如果加入硫酸过多,会导致测得结果___________ (填“偏高”“偏低”或“无影响”)。有关滴定反应: ,
, ,
,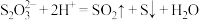 。
。
回答下列问题:
(1)装饱和NaHSO3溶液的仪器是
(2)写出A中化学反应方程式:
(3)从环保角度考虑,上述方案不足之处是
(4)实验完毕后,分离B中产品的操作是
(5)由D、E中实验现象说明:SO2漂白品红必须在
(6)探究 NH4CuSO3的性质。取少量产品于试管中,滴加稀硫酸,发现溶液变蓝色,生成红色固体,产生的气体通入酸性KMnO4溶液中,溶液由紫红色变为无色。写出NH4CuSO3和稀硫酸反应的离子方程式:
(7)取mg NH4CuSO3产品于锥形瓶中,加入适量稀硫酸,充分反应后,加蒸馏水稀释至250mL,取25.00mL,加入足量KI溶液,滴几滴淀粉溶液,用标准0.1mol/LNa2S2O3溶液滴定至终点,消耗滴定液20.00mL。该产品纯度为
 ,
, ,
,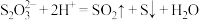 。
。
您最近一年使用:0次
2023-10-08更新
|
123次组卷
|
2卷引用:湖南省名校联考联合体2023-2024学年高三上学期第二次联考化学试题
解题方法
3 . Ⅰ.铁及其化合物在生产生活中有极其重要的用途。 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
(1)由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:______ 。
Ⅱ.高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: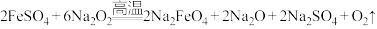 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是______ 。
(3)高铁酸钾可通过次氯酸钾氧化 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
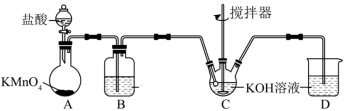
回答下列问题:
①装置A中 与盐酸反应生成
与盐酸反应生成 和
和 ,其化学方程式为
,其化学方程式为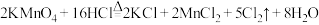 。
。
a.请用双线桥法标出电子转移方向与数目_______ 。
b.上述反应中的HCl体现了什么性质?_______ 。
②将制备的 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为_____ 。
③ 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是______ 。
④若实验制得的次氯酸钾溶液中 (N代表微粒个数),则
(N代表微粒个数),则
_______ 。
⑤装置D的作用是_______ 。
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:________ 。
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
(1)由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:Ⅱ.高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
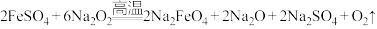 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是(3)高铁酸钾可通过次氯酸钾氧化
 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
回答下列问题:
①装置A中
 与盐酸反应生成
与盐酸反应生成 和
和 ,其化学方程式为
,其化学方程式为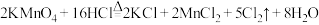 。
。a.请用双线桥法标出电子转移方向与数目
b.上述反应中的HCl体现了什么性质?
②将制备的
 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为③
 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是④若实验制得的次氯酸钾溶液中
 (N代表微粒个数),则
(N代表微粒个数),则
⑤装置D的作用是
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将
 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
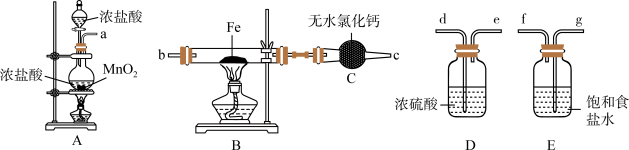
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近一年使用:0次
2024-03-02更新
|
88次组卷
|
2卷引用:内蒙古自治区乌兰浩特第一中学2023-2024学年高一上学期期末考试化学试题
解题方法
5 . 氯化锰常用于医药合成、染料制造等工业,熔点为650℃,沸点为1190℃,易溶于水,能溶于乙醇,能发生水解,易潮解。实验室中,先用锌粒(含有ZnS等)制得的氢气还原二氧化锰制得白色金属锰,再用金属锰与氯气反应制备 ,装置如图所示(加热和夹持装置略)。回答下列问题:
,装置如图所示(加热和夹持装置略)。回答下列问题:_________ ,硫酸铜溶液的作用为(用离子方程式表示)__________ 。
(2)检查装置气密性后加入药品。先通 ,一段时间后,打开
,一段时间后,打开 ,使稀硫酸滴入三颈烧瓶中,产生的
,使稀硫酸滴入三颈烧瓶中,产生的 与硬质玻璃管中
与硬质玻璃管中 反应。证明
反应。证明 已被完全还原的现象是
已被完全还原的现象是___________ 。
(3) 完全还原后,再进行的操作为:①冷却D后,关闭
完全还原后,再进行的操作为:①冷却D后,关闭 ;②打开
;②打开 ,通
,通 一段时间;③先……,后……;④观察现象。操作②通
一段时间;③先……,后……;④观察现象。操作②通 的目的是
的目的是___________ ;操作③先___________ ,后___________ 。
(4)装置中存在的一处缺陷是___________ 。
(5)分离提纯 的操作:取粗产品
的操作:取粗产品 ,将其溶于乙醇,过滤,加热蒸发溶液。说明不用水溶解而用乙醇溶解
,将其溶于乙醇,过滤,加热蒸发溶液。说明不用水溶解而用乙醇溶解 的理由:
的理由:___________ 。
(6)设计实验证明 中
中 的还原性的操作:①取少量
的还原性的操作:①取少量 溶于水;②滴加足量
溶于水;②滴加足量 溶液,过滤;③滤液中加入
溶液,过滤;③滤液中加入 溶液,反应后溶液显紫色。③中反应的离子方程式是
溶液,反应后溶液显紫色。③中反应的离子方程式是___________ 。
 ,装置如图所示(加热和夹持装置略)。回答下列问题:
,装置如图所示(加热和夹持装置略)。回答下列问题:
(2)检查装置气密性后加入药品。先通
 ,一段时间后,打开
,一段时间后,打开 ,使稀硫酸滴入三颈烧瓶中,产生的
,使稀硫酸滴入三颈烧瓶中,产生的 与硬质玻璃管中
与硬质玻璃管中 反应。证明
反应。证明 已被完全还原的现象是
已被完全还原的现象是(3)
 完全还原后,再进行的操作为:①冷却D后,关闭
完全还原后,再进行的操作为:①冷却D后,关闭 ;②打开
;②打开 ,通
,通 一段时间;③先……,后……;④观察现象。操作②通
一段时间;③先……,后……;④观察现象。操作②通 的目的是
的目的是(4)装置中存在的一处缺陷是
(5)分离提纯
 的操作:取粗产品
的操作:取粗产品 ,将其溶于乙醇,过滤,加热蒸发溶液。说明不用水溶解而用乙醇溶解
,将其溶于乙醇,过滤,加热蒸发溶液。说明不用水溶解而用乙醇溶解 的理由:
的理由:(6)设计实验证明
 中
中 的还原性的操作:①取少量
的还原性的操作:①取少量 溶于水;②滴加足量
溶于水;②滴加足量 溶液,过滤;③滤液中加入
溶液,过滤;③滤液中加入 溶液,反应后溶液显紫色。③中反应的离子方程式是
溶液,反应后溶液显紫色。③中反应的离子方程式是
您最近一年使用:0次
名校
6 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:

(1)乙装置的作用是___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ 。
(3)实验完毕后,对甲装置中混合液蒸发浓缩、___________ 、过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入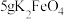 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
(4)根据上述实验现象,可以判断产生的气体中含有___________ ,产生该气体的原因是___________ ,经测定所得气体中还含有 。
。
(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。
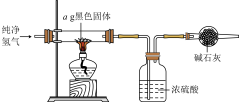
当黑色固体完全反应后,测得浓硫酸质量净增bg,当 等于
等于___________ (用分数表示)时,黑色固体为 。
。
(6)在其他条件相同时,测得一定浓度的 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
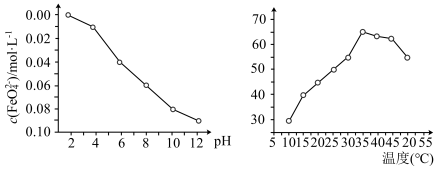
①根据左图得出结论是___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(7)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验___________ (填“1”或“2”)能证明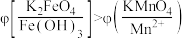 。
。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示:
(1)乙装置的作用是
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:(3)实验完毕后,对甲装置中混合液蒸发浓缩、
实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
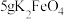 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。(4)根据上述实验现象,可以判断产生的气体中含有
 。
。(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。

当黑色固体完全反应后,测得浓硫酸质量净增bg,当
 等于
等于 。
。(6)在其他条件相同时,测得一定浓度的
 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
①根据左图得出结论是
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(7)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验
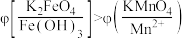 。
。
您最近一年使用:0次
解题方法
7 . 实验室用下图所示装置制备氯气,并进行氯气性质实验,请回答下列问题:
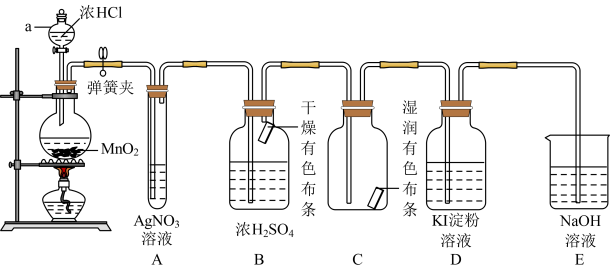
(1)仪器a的名称是___________ 。
(2)B和C中出现的不同现象可得出的结论是___________ 。
(3)D中产生现象是___________ 发生反应的离子方程式___________ 。
(4)使用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物对人体有害,现已发现新的自来水消毒剂,如 :
:
①实验室可以用下列方法制备 :
: 若反应中有0.1mol电子转移,则产生的
若反应中有0.1mol电子转移,则产生的 的物质的量为
的物质的量为___________ 。
②用 在处理含有
在处理含有 废水时,
废水时, 可将废水中的
可将废水中的 转化为
转化为 除去,本身还原为
除去,本身还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为___________ 。
(5)某实验小组探究新制氯水与铁的反应。实验操作过程及实验现象如图所示。

①实验i中产生小量无色无味气体,该反应的离子方程式是___________ 。
②实验ii中观察到溶液变为红色,可推知上层清液中含有Fe3+,该试剂X是___________ 。
③实验iii中观察到溶液无明显变化,可推知上层清液中不含Fe3+,其原因是___________ (用离子方程式表示)。

(1)仪器a的名称是
(2)B和C中出现的不同现象可得出的结论是
(3)D中产生现象是
(4)使用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物对人体有害,现已发现新的自来水消毒剂,如
 :
:①实验室可以用下列方法制备
 :
: 若反应中有0.1mol电子转移,则产生的
若反应中有0.1mol电子转移,则产生的 的物质的量为
的物质的量为②用
 在处理含有
在处理含有 废水时,
废水时, 可将废水中的
可将废水中的 转化为
转化为 除去,本身还原为
除去,本身还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为(5)某实验小组探究新制氯水与铁的反应。实验操作过程及实验现象如图所示。

①实验i中产生小量无色无味气体,该反应的离子方程式是
②实验ii中观察到溶液变为红色,可推知上层清液中含有Fe3+,该试剂X是
③实验iii中观察到溶液无明显变化,可推知上层清液中不含Fe3+,其原因是
您最近一年使用:0次
8 . 实验室制备并收集无水 的装置如图所示(部分夹持装置略)。已知
的装置如图所示(部分夹持装置略)。已知 在空气中易潮解,300℃左右升华。
在空气中易潮解,300℃左右升华。
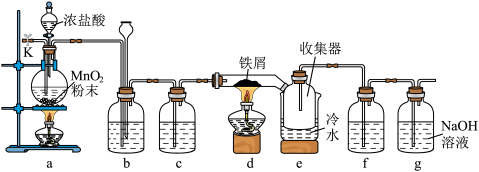
实验步骤如下:
Ⅰ.连接仪器,检查气密性,装入药品:
Ⅱ.打开分液漏斗活塞,点燃装置a处酒精灯,当……点燃装置d处酒精灯;
Ⅲ.反应结束,熄灭装置d处酒精灯,待硬质玻璃管冷却至室温;
Ⅳ.关闭分液漏斗活塞,熄灭装置a处酒精灯;
Ⅴ.从k处通入一段时间干燥空气后,拆卸装置并及时密封收集器。
回答下列问题:
(1)装置a中反应的离子方程式为___________ ;装置b中的试剂为___________ ;
装置d中反应的化学方程式为___________ 。
(2)补全步骤Ⅱ中相应的实验现象___________ ;步骤Ⅴ中通入一段时间干燥空气的目的是___________ ;若操作Ⅲ和Ⅳ调换顺序,可能造成的后果是___________ 。
(3)现有含少量杂质的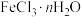 ,为测定
,为测定 值进行如下实验:
值进行如下实验:
①称取 样品配成250mL溶液,加入过量锌粒将
样品配成250mL溶液,加入过量锌粒将 还原为
还原为 ,过滤;取25.00mL所得滤液,恰好与
,过滤;取25.00mL所得滤液,恰好与 的
的 溶液完全反应;
溶液完全反应;
(已知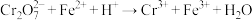 未配平,杂质、
未配平,杂质、 、
、 不参与反应)。
不参与反应)。
②另取 样品,在脱水剂
样品,在脱水剂 蒸汽作用下,加热至恒重,测得固体质量为
蒸汽作用下,加热至恒重,测得固体质量为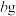 。(
。( 遇水极易反应生成气体,该过程中
遇水极易反应生成气体,该过程中 未升华)。
未升华)。
则配制样品溶液时,用到的玻璃仪器有_________ 、玻璃棒、烧杯和胶头滴管;
__________ ,下列情况会导致 测量值偏小的是
测量值偏小的是____________ (填标号)。
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与 反应时,失水不充分
反应时,失水不充分
 的装置如图所示(部分夹持装置略)。已知
的装置如图所示(部分夹持装置略)。已知 在空气中易潮解,300℃左右升华。
在空气中易潮解,300℃左右升华。
实验步骤如下:
Ⅰ.连接仪器,检查气密性,装入药品:
Ⅱ.打开分液漏斗活塞,点燃装置a处酒精灯,当……点燃装置d处酒精灯;
Ⅲ.反应结束,熄灭装置d处酒精灯,待硬质玻璃管冷却至室温;
Ⅳ.关闭分液漏斗活塞,熄灭装置a处酒精灯;
Ⅴ.从k处通入一段时间干燥空气后,拆卸装置并及时密封收集器。
回答下列问题:
(1)装置a中反应的离子方程式为
装置d中反应的化学方程式为
(2)补全步骤Ⅱ中相应的实验现象
(3)现有含少量杂质的
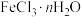 ,为测定
,为测定 值进行如下实验:
值进行如下实验:①称取
 样品配成250mL溶液,加入过量锌粒将
样品配成250mL溶液,加入过量锌粒将 还原为
还原为 ,过滤;取25.00mL所得滤液,恰好与
,过滤;取25.00mL所得滤液,恰好与 的
的 溶液完全反应;
溶液完全反应;(已知
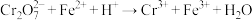 未配平,杂质、
未配平,杂质、 、
、 不参与反应)。
不参与反应)。②另取
 样品,在脱水剂
样品,在脱水剂 蒸汽作用下,加热至恒重,测得固体质量为
蒸汽作用下,加热至恒重,测得固体质量为 。(
。( 遇水极易反应生成气体,该过程中
遇水极易反应生成气体,该过程中 未升华)。
未升华)。则配制样品溶液时,用到的玻璃仪器有

 测量值偏小的是
测量值偏小的是A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与
 反应时,失水不充分
反应时,失水不充分
您最近一年使用:0次
解题方法
9 . 某小组设计实验制备溴单质,装置如图所示。回答下列问题:___________ (填名称),装置B的作用是___________ 。
(2)补充装置C,画出装置图并注明试剂名称___________ 。
(3)装置A中生成溴单质的化学方程式为___________ 。(副产物有 、
、 ,经检验产物中没有
,经检验产物中没有 生成)
生成)
(4)实验完毕后,利用如图装置提取溴单质。已知 、
、 的沸点依次为
的沸点依次为 、
、 。先收集的物质是
。先收集的物质是___________ (填化学式)。 被称为拟卤素单质,具有卤素相似的性质。为了探究
被称为拟卤素单质,具有卤素相似的性质。为了探究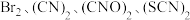 的氧化性强弱,进行实验,实验操作及现象如下:
的氧化性强弱,进行实验,实验操作及现象如下:
已知:拟卤素单质及钾盐水溶液均为无色。
①如果氧化产物为 ,写出操作乙中反应的离子方程式:
,写出操作乙中反应的离子方程式:___________ 。
②某同学得出结论,氧化性: 。该结论
。该结论___________ (填“科学”或“不科学”),理由是___________ (如果填科学,此问不填)。

(2)补充装置C,画出装置图并注明试剂名称
(3)装置A中生成溴单质的化学方程式为
 、
、 ,经检验产物中没有
,经检验产物中没有 生成)
生成)(4)实验完毕后,利用如图装置提取溴单质。已知
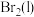 、
、 的沸点依次为
的沸点依次为 、
、 。先收集的物质是
。先收集的物质是
 被称为拟卤素单质,具有卤素相似的性质。为了探究
被称为拟卤素单质,具有卤素相似的性质。为了探究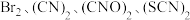 的氧化性强弱,进行实验,实验操作及现象如下:
的氧化性强弱,进行实验,实验操作及现象如下:| 实验操作 | 现象 | |
| 甲 | 向 溶液中滴加几滴溴水,振荡 溶液中滴加几滴溴水,振荡 | 溶液不褪色 |
| 乙 | 向 溶液中滴加溴水,振荡 溶液中滴加溴水,振荡 | 溶液变为无色 |
| 丙 | 向 溶液中滴加溴水,振荡 溶液中滴加溴水,振荡 | 溶液褪色 |
①如果氧化产物为
 ,写出操作乙中反应的离子方程式:
,写出操作乙中反应的离子方程式:②某同学得出结论,氧化性:
 。该结论
。该结论
您最近一年使用:0次
2024-02-04更新
|
232次组卷
|
2卷引用:湖北省十堰市2024届高三元月调考考试化学试题
名校
10 . 探究氨气还原性,设计如下实验:

回答下列问题:
(1)装碱石灰的仪器是______ (填名称);本实验中下列物质可以替代“碱石灰”的是______ (填标号)。
a.氯化钙 b.浓硫酸 c.生石灰 d.五氧化二磷
装置 为制备氨气的发生装置,可选择下列装置。
为制备氨气的发生装置,可选择下列装置。

(2)若选浓氨水,加热制备少量氨气,应选择装置______ (填序号)。
(3)若选择装置Ⅱ,则选择药品是______ 。
(4)若选择氯化铵、熟石灰制备氨气,则选择的装置是______ ;写出该反应的化学方程式:______ 。
(5)C中黑色粉末变为红色,针对红色粉末的成分,提出如下假设:
假设1:它是 ;
;
假设2:它是 ;
;
假设3:它是 和
和 的混合物。
的混合物。
为了探究红色粉末成分,取少量红色粉末溶于足量的稀硫酸中,得到蓝色溶液和红色固体。由此可知,红色粉末一定含______ ,可能含______ (填化学式)。
(6)装置E中收集到的无色气体与空气混合无明显现象,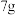 该气体中质子数为
该气体中质子数为______ (用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。

回答下列问题:
(1)装碱石灰的仪器是
a.氯化钙 b.浓硫酸 c.生石灰 d.五氧化二磷
装置
 为制备氨气的发生装置,可选择下列装置。
为制备氨气的发生装置,可选择下列装置。
(2)若选浓氨水,加热制备少量氨气,应选择装置
(3)若选择装置Ⅱ,则选择药品是
(4)若选择氯化铵、熟石灰制备氨气,则选择的装置是
(5)C中黑色粉末变为红色,针对红色粉末的成分,提出如下假设:
假设1:它是
 ;
;假设2:它是
 ;
;假设3:它是
 和
和 的混合物。
的混合物。为了探究红色粉末成分,取少量红色粉末溶于足量的稀硫酸中,得到蓝色溶液和红色固体。由此可知,红色粉末一定含
(6)装置E中收集到的无色气体与空气混合无明显现象,
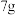 该气体中质子数为
该气体中质子数为 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次



