名校
解题方法
1 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
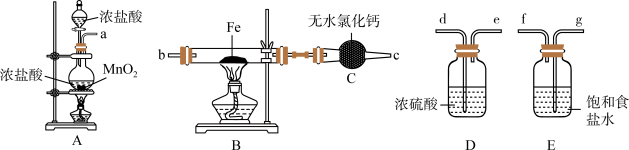
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近一年使用:0次
2024-03-02更新
|
88次组卷
|
2卷引用:内蒙古自治区乌兰浩特第一中学2023-2024学年高一上学期期末考试化学试题
名校
2 . 实验室用粗锌(含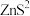 、
、 杂质)制备纯净干燥的
杂质)制备纯净干燥的 ,用以还原
,用以还原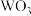 得到金属W的装置如图所示。
得到金属W的装置如图所示。 与水反应的化学方程式为
与水反应的化学方程式为___________ 。
(2)装置a的作用是___________ 。
(3)洗气瓶①、②、③中盛装的试剂分别为足量酸性 溶液、
溶液、___________ 、浓硫酸。为了确保实验科学性,洗气瓶①中的实验现象:有沉淀产生、___________ ;写出酸性 溶液与酸性气体发生反应的离子方程式为
溶液与酸性气体发生反应的离子方程式为___________ 。
(4)管式炉加热前,需要进行的操作是___________ 。
(5)结束反应时,先___________ (填字母)。
a.关闭活塞K b.停止加热
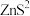 、
、 杂质)制备纯净干燥的
杂质)制备纯净干燥的 ,用以还原
,用以还原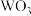 得到金属W的装置如图所示。
得到金属W的装置如图所示。
 与水反应的化学方程式为
与水反应的化学方程式为(2)装置a的作用是
(3)洗气瓶①、②、③中盛装的试剂分别为足量酸性
 溶液、
溶液、 溶液与酸性气体发生反应的离子方程式为
溶液与酸性气体发生反应的离子方程式为(4)管式炉加热前,需要进行的操作是
(5)结束反应时,先
a.关闭活塞K b.停止加热
您最近一年使用:0次
名校
解题方法
3 . 氮是自然界各种生物体生命活动不可缺少的重要元素,下列对氮的化合物进行性质探究实验:
(1)如下图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察到的实验现象为:_______________________ ,振荡注射器,再次观察现象,全过程发生的化学反应,用方程式表示为:___________________________ 。_______________________ 。
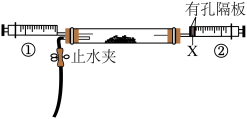
(3)小李同学认为,上述反应分为两阶段,故而一段时间后才观察到有白烟生成。为验证这一猜想,利用注射器重新设计了实验。装置如图所示:
①图1和图2的有孔隔板均可用于干燥气体,则X可为:_____________ 。
A.浓硫酸 B.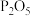 C.碱石灰 D.
C.碱石灰 D.
②图2中反应的方程式为_____________ 。
③将盛有氯气和氨气的注射器按下图连接,进行实验。
(4)小杨同学继续对氨气的还原性进行验证,进行了如下实验。 粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式_____________ 。
(1)如下图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察到的实验现象为:


(3)小李同学认为,上述反应分为两阶段,故而一段时间后才观察到有白烟生成。为验证这一猜想,利用注射器重新设计了实验。装置如图所示:
①图1和图2的有孔隔板均可用于干燥气体,则X可为:
A.浓硫酸 B.
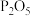 C.碱石灰 D.
C.碱石灰 D.
②图2中反应的方程式为
③将盛有氯气和氨气的注射器按下图连接,进行实验。
操作 | 现象 |
| 向玻璃管中注入12mL氯气,然后再注入 | 玻璃管中黄绿色气体消失,无白烟生成 |
再注入24mL氨气 | 有白烟生成 |
(4)小杨同学继续对氨气的还原性进行验证,进行了如下实验。

 粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
您最近一年使用:0次
名校
解题方法
4 . 某化学兴趣小组利用图1装置(加热和夹持装置已省略)制备氨气并进行喷泉实验.
i.氨气的制备:打开 ,关闭
,关闭 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.
ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备 ,关闭
,关闭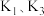 ,打开
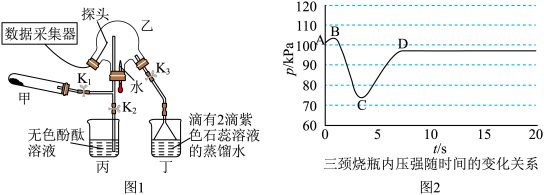
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
请回答下列问题:___________________ ;丁处倒置漏斗的作用是______________ ;氨水中含有的分子有 、
、______________ .
(2)C→D过程中,三颈烧瓶中的现象为_____________ ; 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为_____________ .
(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.__________________________ .
②烧杯中发生反应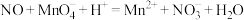 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为__________ (填化学式),氧化产物和还原产物的物质的量之比为__________ (填最简整数比).
i.氨气的制备:打开
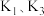 ,关闭
,关闭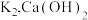 和
和 固体在甲处试管内反应生成
固体在甲处试管内反应生成 .
.ⅱ.氨气的喷泉实验:当丁中溶液变蓝后,停止制备
 ,关闭
,关闭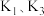 ,打开
,打开 ,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.
,挤压胶头滴管,三颈烧瓶内气体压强随时间的变化关系如图2所示.请回答下列问题:
 、
、(2)C→D过程中,三颈烧瓶中的现象为
 能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为
能灼伤皮肤、眼睛、呼吸器官的黏膜等,若实验室用稀硫酸吸收氨气,则反应的离子方程式为(3)该兴趣小组利用如图3所示装置进行另外一种喷泉实验.
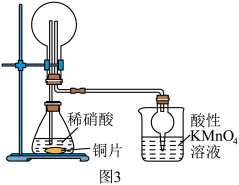
②烧杯中发生反应
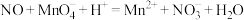 (未配平),该反应的氧化剂为
(未配平),该反应的氧化剂为
您最近一年使用:0次
2024-06-06更新
|
110次组卷
|
3卷引用:甘肃省白银市2023-2024学年高一下学期期中考试化学试题
5 . 硫酸亚硝酰合铁(Ⅱ)在现代化工行业有着广泛的应用,其一种工业制备流程如图所示。回答下列问题:

(1)“洗涤”的具体操作是将废铁屑置于 溶液中并加热至沸腾一段时间,加热至沸腾的好处是
溶液中并加热至沸腾一段时间,加热至沸腾的好处是___________ ,请写出“酸浸”副产物的一种用途:___________ 。
(2)“合成”阶段可在如图所示的装置中完成(加热及夹持装置略)。___________ ,向圆底烧瓶中加入稀硫酸前需要先通入一段时间的 ,否则易出现的不良后果是
,否则易出现的不良后果是___________ 。
②装置 中有
中有 生成,反应的离子方程式为
生成,反应的离子方程式为___________ ,装置 的作用是
的作用是___________ 。
③硫酸亚硝酰合铁(Ⅱ)化学式的确定。
(3)取一定量产品溶于水配制成 溶液,进行实验:
溶液,进行实验:
ⅰ.取 配制的溶液于试管中,加入足量
配制的溶液于试管中,加入足量 溶液,最终可得到
溶液,最终可得到 干燥纯净的白色沉淀。
干燥纯净的白色沉淀。
ⅱ.取 配制的溶液于试管中,用
配制的溶液于试管中,用 酸性
酸性 溶液滴定,滴定至终点时消耗酸性
溶液滴定,滴定至终点时消耗酸性 溶液
溶液 (最终氮元素全部以
(最终氮元素全部以 形式存在)。
形式存在)。
①“步骤ⅱ”滴定终点时的现象为___________ ,产品中
___________ 。
②若要确定产品化学式,则还需要获得一个数据,该数据是___________ 。

(1)“洗涤”的具体操作是将废铁屑置于
 溶液中并加热至沸腾一段时间,加热至沸腾的好处是
溶液中并加热至沸腾一段时间,加热至沸腾的好处是(2)“合成”阶段可在如图所示的装置中完成(加热及夹持装置略)。

 ,否则易出现的不良后果是
,否则易出现的不良后果是②装置
 中有
中有 生成,反应的离子方程式为
生成,反应的离子方程式为 的作用是
的作用是③硫酸亚硝酰合铁(Ⅱ)化学式的确定。
(3)取一定量产品溶于水配制成
 溶液,进行实验:
溶液,进行实验:ⅰ.取
 配制的溶液于试管中,加入足量
配制的溶液于试管中,加入足量 溶液,最终可得到
溶液,最终可得到 干燥纯净的白色沉淀。
干燥纯净的白色沉淀。ⅱ.取
 配制的溶液于试管中,用
配制的溶液于试管中,用 酸性
酸性 溶液滴定,滴定至终点时消耗酸性
溶液滴定,滴定至终点时消耗酸性 溶液
溶液 (最终氮元素全部以
(最终氮元素全部以 形式存在)。
形式存在)。①“步骤ⅱ”滴定终点时的现象为

②若要确定产品化学式,则还需要获得一个数据,该数据是
您最近一年使用:0次
6 . 实验室制备并收集无水 的装置如图所示(部分夹持装置略)。已知
的装置如图所示(部分夹持装置略)。已知 在空气中易潮解,300℃左右升华。
在空气中易潮解,300℃左右升华。
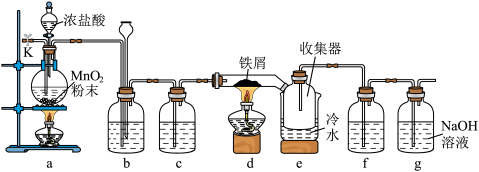
实验步骤如下:
Ⅰ.连接仪器,检查气密性,装入药品:
Ⅱ.打开分液漏斗活塞,点燃装置a处酒精灯,当……点燃装置d处酒精灯;
Ⅲ.反应结束,熄灭装置d处酒精灯,待硬质玻璃管冷却至室温;
Ⅳ.关闭分液漏斗活塞,熄灭装置a处酒精灯;
Ⅴ.从k处通入一段时间干燥空气后,拆卸装置并及时密封收集器。
回答下列问题:
(1)装置a中反应的离子方程式为___________ ;装置b中的试剂为___________ ;
装置d中反应的化学方程式为___________ 。
(2)补全步骤Ⅱ中相应的实验现象___________ ;步骤Ⅴ中通入一段时间干燥空气的目的是___________ ;若操作Ⅲ和Ⅳ调换顺序,可能造成的后果是___________ 。
(3)现有含少量杂质的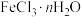 ,为测定
,为测定 值进行如下实验:
值进行如下实验:
①称取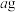 样品配成250mL溶液,加入过量锌粒将
样品配成250mL溶液,加入过量锌粒将 还原为
还原为 ,过滤;取25.00mL所得滤液,恰好与
,过滤;取25.00mL所得滤液,恰好与 的
的 溶液完全反应;
溶液完全反应;
(已知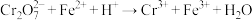 未配平,杂质、
未配平,杂质、 、
、 不参与反应)。
不参与反应)。
②另取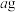 样品,在脱水剂
样品,在脱水剂 蒸汽作用下,加热至恒重,测得固体质量为
蒸汽作用下,加热至恒重,测得固体质量为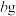 。(
。( 遇水极易反应生成气体,该过程中
遇水极易反应生成气体,该过程中 未升华)。
未升华)。
则配制样品溶液时,用到的玻璃仪器有_________ 、玻璃棒、烧杯和胶头滴管;
__________ ,下列情况会导致 测量值偏小的是
测量值偏小的是____________ (填标号)。
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与 反应时,失水不充分
反应时,失水不充分
 的装置如图所示(部分夹持装置略)。已知
的装置如图所示(部分夹持装置略)。已知 在空气中易潮解,300℃左右升华。
在空气中易潮解,300℃左右升华。
实验步骤如下:
Ⅰ.连接仪器,检查气密性,装入药品:
Ⅱ.打开分液漏斗活塞,点燃装置a处酒精灯,当……点燃装置d处酒精灯;
Ⅲ.反应结束,熄灭装置d处酒精灯,待硬质玻璃管冷却至室温;
Ⅳ.关闭分液漏斗活塞,熄灭装置a处酒精灯;
Ⅴ.从k处通入一段时间干燥空气后,拆卸装置并及时密封收集器。
回答下列问题:
(1)装置a中反应的离子方程式为
装置d中反应的化学方程式为
(2)补全步骤Ⅱ中相应的实验现象
(3)现有含少量杂质的
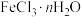 ,为测定
,为测定 值进行如下实验:
值进行如下实验:①称取
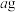 样品配成250mL溶液,加入过量锌粒将
样品配成250mL溶液,加入过量锌粒将 还原为
还原为 ,过滤;取25.00mL所得滤液,恰好与
,过滤;取25.00mL所得滤液,恰好与 的
的 溶液完全反应;
溶液完全反应;(已知
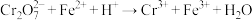 未配平,杂质、
未配平,杂质、 、
、 不参与反应)。
不参与反应)。②另取
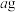 样品,在脱水剂
样品,在脱水剂 蒸汽作用下,加热至恒重,测得固体质量为
蒸汽作用下,加热至恒重,测得固体质量为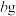 。(
。( 遇水极易反应生成气体,该过程中
遇水极易反应生成气体,该过程中 未升华)。
未升华)。则配制样品溶液时,用到的玻璃仪器有

 测量值偏小的是
测量值偏小的是A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与
 反应时,失水不充分
反应时,失水不充分
您最近一年使用:0次
解题方法
7 . 某小组设计实验制备溴单质,装置如图所示。回答下列问题:___________ (填名称),装置B的作用是___________ 。
(2)补充装置C,画出装置图并注明试剂名称___________ 。
(3)装置A中生成溴单质的化学方程式为___________ 。(副产物有 、
、 ,经检验产物中没有
,经检验产物中没有 生成)
生成)
(4)实验完毕后,利用如图装置提取溴单质。已知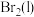 、
、 的沸点依次为
的沸点依次为 、
、 。先收集的物质是
。先收集的物质是___________ (填化学式)。 被称为拟卤素单质,具有卤素相似的性质。为了探究
被称为拟卤素单质,具有卤素相似的性质。为了探究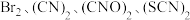 的氧化性强弱,进行实验,实验操作及现象如下:
的氧化性强弱,进行实验,实验操作及现象如下:
已知:拟卤素单质及钾盐水溶液均为无色。
①如果氧化产物为 ,写出操作乙中反应的离子方程式:
,写出操作乙中反应的离子方程式:___________ 。
②某同学得出结论,氧化性: 。该结论
。该结论___________ (填“科学”或“不科学”),理由是___________ (如果填科学,此问不填)。

(2)补充装置C,画出装置图并注明试剂名称
(3)装置A中生成溴单质的化学方程式为
 、
、 ,经检验产物中没有
,经检验产物中没有 生成)
生成)(4)实验完毕后,利用如图装置提取溴单质。已知
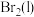 、
、 的沸点依次为
的沸点依次为 、
、 。先收集的物质是
。先收集的物质是
 被称为拟卤素单质,具有卤素相似的性质。为了探究
被称为拟卤素单质,具有卤素相似的性质。为了探究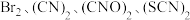 的氧化性强弱,进行实验,实验操作及现象如下:
的氧化性强弱,进行实验,实验操作及现象如下:| 实验操作 | 现象 | |
| 甲 | 向 溶液中滴加几滴溴水,振荡 溶液中滴加几滴溴水,振荡 | 溶液不褪色 |
| 乙 | 向 溶液中滴加溴水,振荡 溶液中滴加溴水,振荡 | 溶液变为无色 |
| 丙 | 向 溶液中滴加溴水,振荡 溶液中滴加溴水,振荡 | 溶液褪色 |
①如果氧化产物为
 ,写出操作乙中反应的离子方程式:
,写出操作乙中反应的离子方程式:②某同学得出结论,氧化性:
 。该结论
。该结论
您最近一年使用:0次
2024-02-04更新
|
232次组卷
|
2卷引用:湖北省十堰市2024届高三元月调考考试化学试题
名校
8 . 探究氨气还原性,设计如下实验:

回答下列问题:
(1)装碱石灰的仪器是______ (填名称);本实验中下列物质可以替代“碱石灰”的是______ (填标号)。
a.氯化钙 b.浓硫酸 c.生石灰 d.五氧化二磷
装置 为制备氨气的发生装置,可选择下列装置。
为制备氨气的发生装置,可选择下列装置。

(2)若选浓氨水,加热制备少量氨气,应选择装置______ (填序号)。
(3)若选择装置Ⅱ,则选择药品是______ 。
(4)若选择氯化铵、熟石灰制备氨气,则选择的装置是______ ;写出该反应的化学方程式:______ 。
(5)C中黑色粉末变为红色,针对红色粉末的成分,提出如下假设:
假设1:它是 ;
;
假设2:它是 ;
;
假设3:它是 和
和 的混合物。
的混合物。
为了探究红色粉末成分,取少量红色粉末溶于足量的稀硫酸中,得到蓝色溶液和红色固体。由此可知,红色粉末一定含______ ,可能含______ (填化学式)。
(6)装置E中收集到的无色气体与空气混合无明显现象,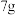 该气体中质子数为
该气体中质子数为______ (用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。

回答下列问题:
(1)装碱石灰的仪器是
a.氯化钙 b.浓硫酸 c.生石灰 d.五氧化二磷
装置
 为制备氨气的发生装置,可选择下列装置。
为制备氨气的发生装置,可选择下列装置。
(2)若选浓氨水,加热制备少量氨气,应选择装置
(3)若选择装置Ⅱ,则选择药品是
(4)若选择氯化铵、熟石灰制备氨气,则选择的装置是
(5)C中黑色粉末变为红色,针对红色粉末的成分,提出如下假设:
假设1:它是
 ;
;假设2:它是
 ;
;假设3:它是
 和
和 的混合物。
的混合物。为了探究红色粉末成分,取少量红色粉末溶于足量的稀硫酸中,得到蓝色溶液和红色固体。由此可知,红色粉末一定含
(6)装置E中收集到的无色气体与空气混合无明显现象,
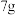 该气体中质子数为
该气体中质子数为 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次
解题方法
9 . 硫脲 易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备
易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备 ,
, 再与
再与 反应制备硫脲,装置(夹持及加热装置略)如下图所示.
反应制备硫脲,装置(夹持及加热装置略)如下图所示.
(1)仪器a的名称为__________ ;试剂X为__________ 。
(2)关闭 、
、 ,打开
,打开 ,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为
,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为__________ 。
(3)关闭 ,打开
,打开 ,通入
,通入 一段时间,目的是
一段时间,目的是__________ 。
(4)关闭 ,撤走搅拌器,打开
,撤走搅拌器,打开 ,控制仪器a中温度为
,控制仪器a中温度为 发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为
发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为__________ ;为减少氧化,减压过滤和干燥时最好采用的仪器是__________ 。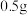 产品配成
产品配成 溶液,取
溶液,取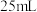 加入碘量瓶中,再加入
加入碘量瓶中,再加入 碘标准溶液和
碘标准溶液和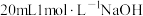 溶液,发生反应:
溶液,发生反应: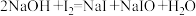 ;
;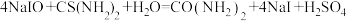 .充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用
.充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用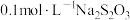 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: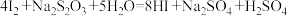 .至终点时消耗
.至终点时消耗 标准溶液
标准溶液 .达到滴定终点的现象为
.达到滴定终点的现象为__________ ;粗产品中硫脲的质量分数为__________ (用含V的代数式表示)。
 易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备
易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备 ,
, 再与
再与 反应制备硫脲,装置(夹持及加热装置略)如下图所示.
反应制备硫脲,装置(夹持及加热装置略)如下图所示.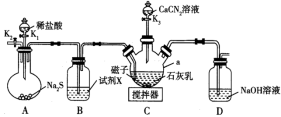
(1)仪器a的名称为
(2)关闭
 、
、 ,打开
,打开 ,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为
,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为(3)关闭
 ,打开
,打开 ,通入
,通入 一段时间,目的是
一段时间,目的是(4)关闭
 ,撤走搅拌器,打开
,撤走搅拌器,打开 ,控制仪器a中温度为
,控制仪器a中温度为 发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为
发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为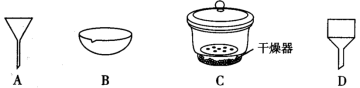
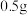 产品配成
产品配成 溶液,取
溶液,取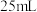 加入碘量瓶中,再加入
加入碘量瓶中,再加入 碘标准溶液和
碘标准溶液和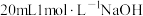 溶液,发生反应:
溶液,发生反应: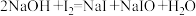 ;
;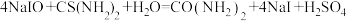 .充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用
.充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用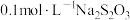 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: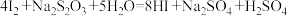 .至终点时消耗
.至终点时消耗 标准溶液
标准溶液 .达到滴定终点的现象为
.达到滴定终点的现象为
您最近一年使用:0次
名校
解题方法
10 . 某化学活动小组利用如下装置制备氯气并进行相关的性质验证。
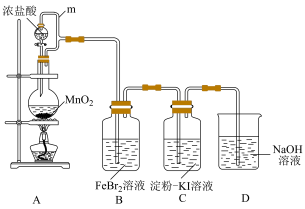
已知:
① 易溶于有机溶剂四氯化碳(
易溶于有机溶剂四氯化碳( ),且所得溶液呈橙红色;
),且所得溶液呈橙红色;
② 不溶于水,密度比水大。
不溶于水,密度比水大。
(1)装置A中发生反应的化学方程式为
(2)m的作用是
(3)装置C中的现象是
(4)装置D中发生反应的离子方程式为
(5)取少量反应后的B中溶液,向其中加入
 ,振荡后静置,若出现
,振荡后静置,若出现 被氧化。
被氧化。(6)另取少量反应后的B中溶液于试管中,向其中加入少量
 被氧化。
被氧化。(7)已知氧化性
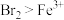 ,向200mL 0.1mol/L
,向200mL 0.1mol/L  溶液中通入标准状况下0.56L
溶液中通入标准状况下0.56L  时反应的离子方程式为
时反应的离子方程式为
您最近一年使用:0次



