解题方法
1 . 根据所学知识,回答下列问题:
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:___________ 。
②过程a中K2FeO4体现___________ (填“氧化”或“还原”)性,反应过程中转移5.418×1022个电子,需要___________ mol K2FeO4。
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:___________ 。
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是___________ ,生产1mol的高铁酸钠,需要转移电子的物质的量是___________ mol。
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:___________ ;反应片刻后,可观察到有气体产生。
(1)K2FeO4是常见的水处理剂,净水原理如图所示。请回答下列问题:
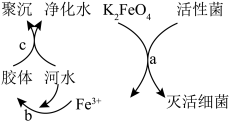
②过程a中K2FeO4体现
(2)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:
___________Fe(OH)3+___________KOH+___________KClO=___________K2FeO4+___________KCl+___________H2O
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是
(4)将铝箔放入NaOH稀溶液中,开始时无气体生成,写出反应的离子方程式:
您最近一年使用:0次
名校
解题方法
2 . 实验室中利用固体 进行如图所示实验,下列说法错误的是
进行如图所示实验,下列说法错误的是
 进行如图所示实验,下列说法错误的是
进行如图所示实验,下列说法错误的是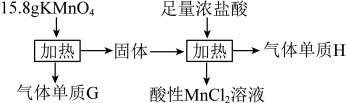
| A.气体G与气体H均为氧化产物 | B.实验中 既是氧化剂,又是还原剂 既是氧化剂,又是还原剂 |
| C.Mn元素至少参与了3个氧化还原反应 | D.G与H在标准状况下的总体积可能为5.6 L |
您最近一年使用:0次
3 . 利用废旧锂电池可回收金属元素。已知废旧锂离子电池的主要成分为 以及
以及  等单质,回收工艺流程如图:
等单质,回收工艺流程如图:
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
(2)“生化反应”后溶液中存在的主要阳离子有 、
、_______ 。“生化反应”最初使用的是 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为_______ ,使用细菌的优点是_______ 。
(3) 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因:_______ 。_______ 。
(5) (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 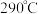 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 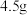 ,所得固体成分为
,所得固体成分为_______ (填化学式)。
(6)金属铜的晶胞如图所示,此晶胞的边长为 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ=_______ g∙cm-3 (用含  的代数式表示)。
的代数式表示)。
 以及
以及  等单质,回收工艺流程如图:
等单质,回收工艺流程如图: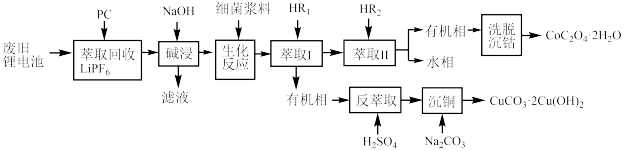
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
| A.漏斗 | B.胶头滴管 | C.分液漏斗 | D.蒸馏烧瓶 |
(2)“生化反应”后溶液中存在的主要阳离子有
 、
、 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为(3)
 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因: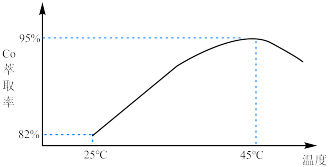
(5)
 (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 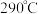 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 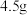 ,所得固体成分为
,所得固体成分为(6)金属铜的晶胞如图所示,此晶胞的边长为
 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ= 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
4 . 氢氧化铈  是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为
是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为 ]制备氢氧化铈的流程如图。下列说法
]制备氢氧化铈的流程如图。下列说法错误 的是
 是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为
是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为 ]制备氢氧化铈的流程如图。下列说法
]制备氢氧化铈的流程如图。下列说法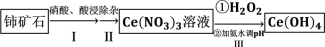
| A.铈是一种常见的稀土元素且属于金属元素 |
B.步骤Ⅰ中发生的反应为 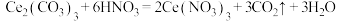 |
| C.步骤Ⅱ中用到的玻璃仪器有漏斗、烧杯、玻璃棒 |
D.步骤Ⅲ中参加反应的氧化剂与还原剂的物质的量之比为 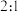 |
您最近一年使用:0次
5 . 在工业上次磷酸 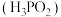 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: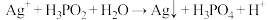 (未配平),已知
(未配平),已知 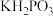 是次磷酸的正盐,请回答下列问题:
是次磷酸的正盐,请回答下列问题:
(1)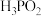 中,
中, 元素的化合价为
元素的化合价为_______ ;该反应中,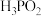 被
被_______ (填“氧化”或“还原”)。
(2)若该反应有 个电子转移,则镀件上银的质量为
个电子转移,则镀件上银的质量为_______  (已知每个银原子质量为
(已知每个银原子质量为 克)。
克)。
(3)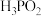 与足量
与足量  溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。
(4)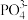 中
中 的价层电子对数为
的价层电子对数为_______ , 采取
采取_______ 杂化方式, 的空间结构为
的空间结构为_______ 。
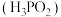 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: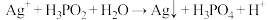 (未配平),已知
(未配平),已知 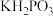 是次磷酸的正盐,请回答下列问题:
是次磷酸的正盐,请回答下列问题:(1)
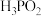 中,
中, 元素的化合价为
元素的化合价为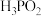 被
被(2)若该反应有
 个电子转移,则镀件上银的质量为
个电子转移,则镀件上银的质量为 (已知每个银原子质量为
(已知每个银原子质量为 克)。
克)。(3)
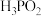 与足量
与足量  溶液反应的离子方程式:
溶液反应的离子方程式:(4)
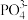 中
中 的价层电子对数为
的价层电子对数为 采取
采取 的空间结构为
的空间结构为
您最近一年使用:0次
名校
6 . 一种新型人工固氮的原理如图所示,下列叙述正确的是
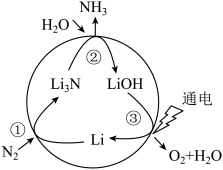
| A.转化过程中所涉及的元素均呈现了两种价态 |
| B.参与反应的物质均只含离子键 |
| C.反应①②③均为氧化还原反应 |
D.假设每一步均完全转化,每生成2mol ,同时生成1.5mol ,同时生成1.5mol |
您最近一年使用:0次
2024-04-20更新
|
230次组卷
|
2卷引用:2024届内蒙古自治区赤峰市高三一模化学试题
7 . 混盐是由一种金属阳离子(或 )与两种酸根阴离子组成的盐,如
)与两种酸根阴离子组成的盐,如 可看成由
可看成由 和
和 组成。向混盐
组成。向混盐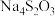 中加入足量稀硫酸,发生如下反应:
中加入足量稀硫酸,发生如下反应: 。下列说法正确的是
。下列说法正确的是
 )与两种酸根阴离子组成的盐,如
)与两种酸根阴离子组成的盐,如 可看成由
可看成由 和
和 组成。向混盐
组成。向混盐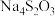 中加入足量稀硫酸,发生如下反应:
中加入足量稀硫酸,发生如下反应: 。下列说法正确的是
。下列说法正确的是A.混盐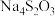 可看成由 可看成由 和 和 组成 组成 |
B.混盐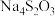 固体中阴阳离子个数比为 固体中阴阳离子个数比为 |
C.向混盐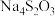 溶液中加入 溶液中加入 溶液,可生成 溶液,可生成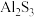 沉淀 沉淀 |
D.向混盐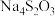 溶液中加入足量稀 溶液中加入足量稀 ,每产生 ,每产生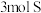 ,转移电子的物质的量为 ,转移电子的物质的量为 |
您最近一年使用:0次
8 .  下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: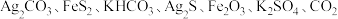 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量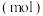 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: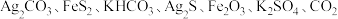 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量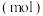 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是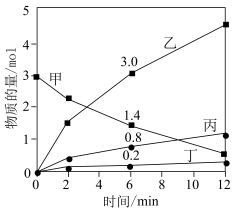
A.甲代表 ,丁为碱性氧化物 ,丁为碱性氧化物 |
B.还原产物、氧化产物的物质的量之比 |
C. 甲完全反应转移电子数为 甲完全反应转移电子数为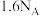 |
D.在该反应中,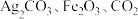 的化学计量数之比为 的化学计量数之比为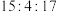 |
您最近一年使用:0次
9 . 实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
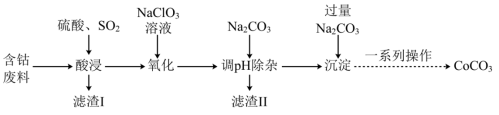
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)基态钴原子的价层电子排布式为_______ ,在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为______ 至______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣II”的主要成分为______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
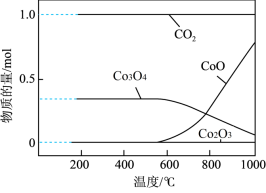
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
(1)基态钴原子的价层电子排布式为
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣II”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

您最近一年使用:0次
10 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)Na2O2的电子式为_______ 。Na2O2可作供氧剂,写出Na2O2与CO2反应的化学方程式_______ 。若有1molNa2O2参加反应则转移电子的物质的量为_______ mol。
(2)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过_______ 、_______ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)天然碱的主要成分为Na2CO3·NaHCO3·2H2O,1molNa2CO3·NaHCO3·2H2O经充分加热得到Na2CO3的质量为_______ g。
(1)Na2O2的电子式为
(2)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)天然碱的主要成分为Na2CO3·NaHCO3·2H2O,1molNa2CO3·NaHCO3·2H2O经充分加热得到Na2CO3的质量为
您最近一年使用:0次



