解题方法
1 . Fe/Fe3O4复合物是一种高密度磁记录材料,磁记录材料有记录和存储信息的功能。制备该材料的一种流程如下:
Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为_____ 。该“反应”中通入氩气的原因_____ 。
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
3.已知参加反应的FeCl2溶液浓度为lmol·L−1。由题给信息分析,25℃时,当pH<2时,Fe/Fe3O4产率极低的原因_____ 。
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。_____ 。
通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
6.从绿色化学角度评价该循环过程(说一点)。_____

Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
| A.SO2 | B.铁粉 |
| C.KSCN溶液 | D.KSCN溶液新制氯水 |
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。

通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
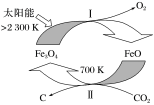
| A.反应物 | B.中间产物 | C.催化剂 | D.产物 |
您最近半年使用:0次
名校
解题方法
2 . 过氧化钠常作漂白剂、消毒剂。过氧化钠经常因为保存不当容易吸收空气中 而变质。某课外小组欲用以下装置探究过氧化钠与
而变质。某课外小组欲用以下装置探究过氧化钠与 反应后的产物。试回答下列问题:
反应后的产物。试回答下列问题:

(1)写出A中反应的化学方程式___________ 。
(2)B装置的作用是___________ 。
(3)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转变为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式,并用双线桥标出电子转移的方向和数目:___________
(4)该课外小组欲探究某过组化钠样品是否已经变质,取少量样品,溶解,加入___________ 溶液,充分振荡后有白色沉淀,证明 已经变质。
已经变质。
(5)超氧化钾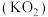 与过氧化钠一样能吸收
与过氧化钠一样能吸收 生成碳酸盐及
生成碳酸盐及 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
 而变质。某课外小组欲用以下装置探究过氧化钠与
而变质。某课外小组欲用以下装置探究过氧化钠与 反应后的产物。试回答下列问题:
反应后的产物。试回答下列问题:
(1)写出A中反应的化学方程式
(2)B装置的作用是
(3)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转变为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式,并用双线桥标出电子转移的方向和数目:
(4)该课外小组欲探究某过组化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(5)超氧化钾
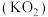 与过氧化钠一样能吸收
与过氧化钠一样能吸收 生成碳酸盐及
生成碳酸盐及 ,写出该反应的化学方程式
,写出该反应的化学方程式
您最近半年使用:0次
名校
解题方法
3 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上使用黄铁矿(主要成分为 )制备硫酸的反应原理如下图:
)制备硫酸的反应原理如下图:___________ ;煅烧时发生反应的化学方程式为___________ 。
(2)“氧化”时,发生反应的化学方程式为___________ ;保持其他条件不变,只改变一个反应条件时,生成 的反应速率会如何变化?(填“增大”“减小”或“不变”)
的反应速率会如何变化?(填“增大”“减小”或“不变”)
(3)研究证明,高炉中 与
与 反应不能完全转化为
反应不能完全转化为 和
和 ,据此写出高炉炼铁时
,据此写出高炉炼铁时 与
与 反应的化学方程式:
反应的化学方程式:___________ ;若投入 的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中
的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中 的转化率为
的转化率为___________ 。
 )制备硫酸的反应原理如下图:
)制备硫酸的反应原理如下图: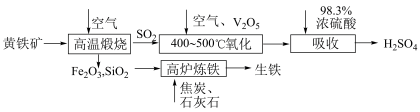
(2)“氧化”时,发生反应的化学方程式为
 的反应速率会如何变化?(填“增大”“减小”或“不变”)
的反应速率会如何变化?(填“增大”“减小”或“不变”)| 改变条件 | 升高温度 | 增大反应容器体积 | 反应达到平衡状态后,延长反应时间 |
生成 的速率 的速率 |
(3)研究证明,高炉中
 与
与 反应不能完全转化为
反应不能完全转化为 和
和 ,据此写出高炉炼铁时
,据此写出高炉炼铁时 与
与 反应的化学方程式:
反应的化学方程式: 的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中
的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中 的转化率为
的转化率为
您最近半年使用:0次
2023-08-20更新
|
354次组卷
|
3卷引用:河北省沧州市东光县等3地海兴县中学等2校2022-2023学年高一下学期3月月考化学试题
名校
4 . 用如图所示实验装置可以完成中学化学实验中的一些实验。
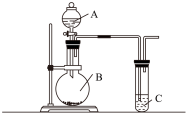
利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。在装置A中加入70%的硫酸溶液,B中加入Na2SO3粉末。
(1)C中应加入溶液___ (填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是___ ,反应完全后,将C试管加热一段时间发生的现象是___ 。
(2)如果仅用如图装置进行此实验,可能造成环境污染,此污染属于___ (选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有___ 溶液的洗气瓶。
(3)将二氧化硫气体通入FeCl3溶液中反应一段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:___ 。

利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。在装置A中加入70%的硫酸溶液,B中加入Na2SO3粉末。
(1)C中应加入溶液
(2)如果仅用如图装置进行此实验,可能造成环境污染,此污染属于
(3)将二氧化硫气体通入FeCl3溶液中反应一段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:
您最近半年使用:0次
5 . 铅元素位于周期表ⅣA族,其氧化物铅丹(Pb3O4)可作防锈涂料,围绕铅丹的制备与性质有如下流程。下列有关说法错误的是
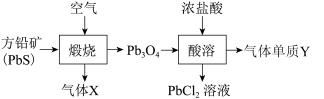

| A.Pb3O4可表示为2PbO·PbO2 |
| B.“煅烧”时PbS只作还原剂,Cl2的氧化性强于Pb3O4 |
| C.气体X既是氧化产物又是还原产物,气体Y为氧化产物 |
| D.“酸溶”时0.1 mol Pb3O4与足量的浓盐酸反应,生成0.1 mol Cl2 |
您最近半年使用:0次
2023-08-11更新
|
92次组卷
|
2卷引用:河北省霸州市第一中学2022-2023学年高二下学期期末考试化学试题
名校
解题方法
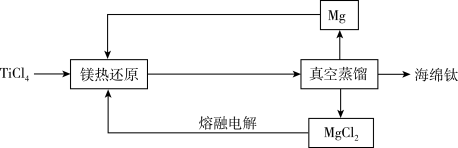
6 . Ti具备优良的抗腐蚀性,被称为未来金属,工业上可以采用铁热还原法高温制备,工艺流程如下;已知: ,下列说法错误的是
,下列说法错误的是
 ,下列说法错误的是
,下列说法错误的是 
| A.Mg的循环使用可以提高原料利用率,降低成本 |
B.热还原的化学方程式为: |
| C.Ti和Mg高温下化学性质非常活泼,镁还原需在惰性气氛中进行 |
| D.整个工艺流程中,Cl元素化合价始终不变 |
您最近半年使用:0次
名校
解题方法
7 . 某新型合成NH3的原理如图所示,下列说法不正确的是
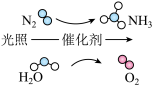

| A.N2和O2在高温和放电条件下都能反应 |
| B.该反应中的4种物质中,仅有1种属于电解质 |
C.发生反应的 |
| D.NH3在过量氧气的体系中催化氧化生成NO2和H2O |
您最近半年使用:0次
解题方法
8 . 在中国古代,硫酸被炼丹术士称为“绿矾油”。这是因为生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧后,釜中逸出刺激性气味的气体,同时有油状液体流出,残留固体呈红棕色。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①___________ ;
②___________ 。
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①
②
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。
A.若将反应后的气体通入 溶液中,产生的沉淀为 溶液中,产生的沉淀为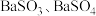 |
B.b中产物用紫色石蕊试液即可检验出其中 和 和 |
C.为检验反应的气态生成物是 ,试管c中应加入的试剂为NaOH溶液 ,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
您最近半年使用:0次
名校
9 . 高铁酸钾是一种新型水处理剂,使用说明书如下。
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 。
(2)制备 需要在
需要在___________ (填“酸性”“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,错误的是
的说法中,错误的是___________ (填字母)。
a.是具有强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4) 与水反应生成
与水反应生成 胶体、
胶体、 和
和 反应的化学方程式为
反应的化学方程式为___________ ;该反应消耗 转移的电子数为
转移的电子数为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(5)消毒净化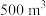 水,至少需要
水,至少需要 的质量为
的质量为___________  。
。
(6)产生 胶体时,该分散系区别于其他分散系的本质特征是
胶体时,该分散系区别于其他分散系的本质特征是___________ 。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着  减小,稳定性下降。 减小,稳定性下降。 能与水反应放出氧气并通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 能与水反应放出氧气并通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用。 胶体,可除去水中细微的悬浮物,有净水作用。【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放 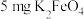 即可达到卫生标准 即可达到卫生标准 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,错误的是
的说法中,错误的是a.是具有强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)
 与水反应生成
与水反应生成 胶体、
胶体、 和
和 反应的化学方程式为
反应的化学方程式为 转移的电子数为
转移的电子数为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(5)消毒净化
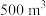 水,至少需要
水,至少需要 的质量为
的质量为 。
。(6)产生
 胶体时,该分散系区别于其他分散系的本质特征是
胶体时,该分散系区别于其他分散系的本质特征是
您最近半年使用:0次
名校
解题方法
10 . 下图是实验室中制取 的流程图,已知
的流程图,已知 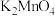 显墨绿色,下列说法错误的是
显墨绿色,下列说法错误的是

 的流程图,已知
的流程图,已知 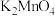 显墨绿色,下列说法错误的是
显墨绿色,下列说法错误的是
| A.第①步在铁坩埚中进行,第⑥步中加热浓缩在蒸发皿中进行 |
B.第②步中 作还原剂,第③步分批浸取可提高浸取率 作还原剂,第③步分批浸取可提高浸取率 |
C.第④步通 发生反应: 发生反应: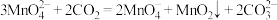 ,当有43.5g沉淀生成,反应中转移的电子数为NA个 ,当有43.5g沉淀生成,反应中转移的电子数为NA个 |
D.第⑤步加热趁热过滤,说明 的溶解度随温度变化较大 的溶解度随温度变化较大 |
您最近半年使用:0次



