解题方法
1 . 1.四氧化三铁在强碱性溶液中与次氯酸盐反应,生成高铁(VI)酸盐,其化学反应方程式是_______ 。高铁酸盐的作用之一是净化水,这是因为_______ 、_______ 。
您最近一年使用:0次
2 . 某元素X的氧化物很多,其中常见的有A、B两种
(1)A为黄绿色气体,其中X元素在化合物中化合价为+4价,氧含量为47.4%,可用于漂白木浆和水处理,A在液态和浓缩的气态时具有爆炸性,该气体为_______ ;
(2)B为黄棕色气体,氧含量为18.41%,当加热或遇电火花时会发生爆炸,该气体为_______ 。
(3)你认为这两种气体是否可以在防SARS中作为消毒剂_______
(4)写出气体A与NaOH反应的化学方程式_______ 。由于工业上大量使用的A具有爆炸性,A适宜存放在_______ (填“酸”或“碱”)性溶液中。
(5)用SO2还原X的+5价的盐,可制得A,写出该反应的离子方程式_______ 。
(1)A为黄绿色气体,其中X元素在化合物中化合价为+4价,氧含量为47.4%,可用于漂白木浆和水处理,A在液态和浓缩的气态时具有爆炸性,该气体为
(2)B为黄棕色气体,氧含量为18.41%,当加热或遇电火花时会发生爆炸,该气体为
(3)你认为这两种气体是否可以在防SARS中作为消毒剂_______
| A.都可以 | B.都不可以 | C.只有气体A可以 | D.只有气体B可以 |
(5)用SO2还原X的+5价的盐,可制得A,写出该反应的离子方程式
您最近一年使用:0次
3 . 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3 大量地用于电镀工业中。
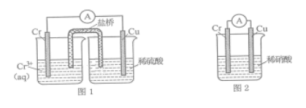
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体。根据上述现象试推测金属铬的两个重要化学性质___________ 、___________ 。
(2) CrO3 具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3 被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为___________ 。
(3) CrO3 的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。
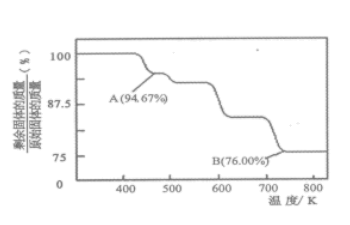
①A点时剩余固体的成分是___________ (填化学式)
②从开始加热到750K 时总反应方程式为___________ 。
(4) CrO3和K2Cr2O7 均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3 和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6. 0 × 10-31]。
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3 和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6. 0 × 10-31]。
①电解过程中NaCl的作用是___________ 。
②已知电解后的溶液中c(Fe3+)为2.0×10-13mol·L-1,则溶液中c(Cr3+)为___________ mol·L-1。
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体。根据上述现象试推测金属铬的两个重要化学性质

(2) CrO3 具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3 被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为
(3) CrO3 的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。

①A点时剩余固体的成分是
②从开始加热到750K 时总反应方程式为
(4) CrO3和K2Cr2O7 均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O
 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3 和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6. 0 × 10-31]。
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3 和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6. 0 × 10-31]。①电解过程中NaCl的作用是
②已知电解后的溶液中c(Fe3+)为2.0×10-13mol·L-1,则溶液中c(Cr3+)为
您最近一年使用:0次
4 . 完成下列反应方程式(一律要配平): BrCl+ H2O=___________ ;(CN)2、(OCN2、(SCN)2 等与X2(X=F、Cl、Br、I)的性质相似,CN-、OCN-、SCN-与X-的性质相似,被称为拟卤素。(CN)2+H2O⇌___________ ;AgSCN+Br2=___________ ;AgCN 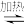
___________
您最近一年使用:0次
解题方法
5 . 下列反应方程式中,书写正确的是
| A.C6H12O6+9O2=6H2O+ 6CO2↑ |
| B.5FeCl2+8HCl+KMnO4=5FeCl3+MnCl2+4H2O |
| C.AgNO3 + K2CrO4 = Ag2CrO4↓+ 2 KNO3 |
| D.Na2SO4 + Ba(NO3)2 = BaSO4↓+ 2 NaNO3 |
您最近一年使用:0次
解题方法
6 . 钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、CaO和SiO2等杂质)来制备,其工艺流程如下:

请回答下列问题:
(1)已知FeTiO3与盐酸反应后有TiOCl 生成, 写出该反应的离子方程式
生成, 写出该反应的离子方程式______ 。
(2)流程中的“氧化剂”最好选用什么试剂?为什么______ ?
(3)写出由FePO4制备LiFePO4的化学反应方程式______ 。
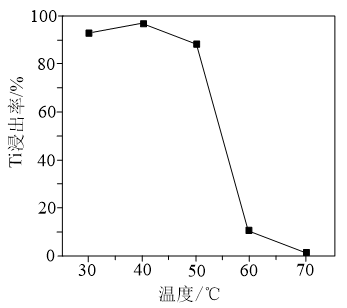
(4)用双氧水和氨水溶解TiO2固体时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降,为什么______ ?
(5)过氧化钛酸锂Li2Ti5O15为一种配合物,请分析说明其中的过氧键(O- O)数目有多少_____ 个。
(6)“浸出”步骤中,温度对铁、钛的浸出效果如下图所示:
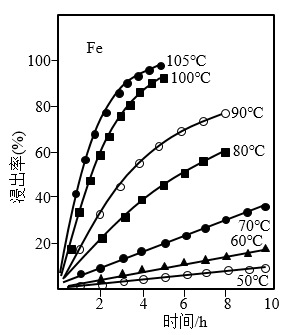

总结温度的影响规律:温度对铁和钛浸出效果的影响相似。请另写出两条规律_____ 。
(7) 25 °C 下,已知FePO4、Ca3(PO4)2与Mg3(PO4)2的标准溶度积常数K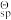 (简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K
(简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K (简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成
(简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成_____ ?
(8)若采用钛酸锂和磷酸亚铁锂作电极组成电池,充电时发生反应为:Li4Ti5O12 + LiFePO4 = Li4+xTi5O12 +Li 1-xFePO4 (0<x<1),请写出该电池放电时的阳极反应方程式_____ 。

请回答下列问题:
(1)已知FeTiO3与盐酸反应后有TiOCl
 生成, 写出该反应的离子方程式
生成, 写出该反应的离子方程式(2)流程中的“氧化剂”最好选用什么试剂?为什么
(3)写出由FePO4制备LiFePO4的化学反应方程式
(4)用双氧水和氨水溶解TiO2固体时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降,为什么

(5)过氧化钛酸锂Li2Ti5O15为一种配合物,请分析说明其中的过氧键(O- O)数目有多少
(6)“浸出”步骤中,温度对铁、钛的浸出效果如下图所示:


总结温度的影响规律:温度对铁和钛浸出效果的影响相似。请另写出两条规律
(7) 25 °C 下,已知FePO4、Ca3(PO4)2与Mg3(PO4)2的标准溶度积常数K
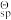 (简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K
(简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K (简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成
(简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成(8)若采用钛酸锂和磷酸亚铁锂作电极组成电池,充电时发生反应为:Li4Ti5O12 + LiFePO4 = Li4+xTi5O12 +Li 1-xFePO4 (0<x<1),请写出该电池放电时的阳极反应方程式
您最近一年使用:0次
解题方法
7 . 农业生产离不开空气、水、土壤和肥料,保护土壤资源,防止土壤污染,改良土壤酸碱性是保证社会可持续发展的重要工作。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:_______ 。
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。_______ ;_______ 。
(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):_______ 。
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):_______ 。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中
 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):
您最近一年使用:0次
8 . 在400°C,0.1MPa 以及Xe过量条件下,Xe和F2可以直接反应生成+2价态的化合物。反应的方程式是___________ 。所生成的氟化物与碘阴离子在常温下即可以反应,相应的反应式是___________ 。该反应说明氟化物具有(氧化性、还原性中选一项回答)___________ 。该氟化物溶于水,且缓慢地与水产生反应,反应式是___________ 。
您最近一年使用:0次
9 . HN3(叠氮酸)是一种易爆炸的油状物,在水中稳定,是一种弱酸。分子中N的化合价是___________ ,HN3与KOH反应的方程式是___________ 。HN3受热时反应的方程式是___________ ,在水溶液中的电离方程式是___________ 。H3N的氧化性与HNO3相似,请完成下列方程式Cu +3HN3=___________ + N2 +NH3
您最近一年使用:0次
10 . 除一种元素外,其余由周期表中前20号元素组成的物质A、B、C、D、E,它们间的反应关系如下图所示:

(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式为_______ 。写出该反应的离子方程式_______ 。
(2)若A和B都是盐,A难溶于水而B易溶于水,D不溶于稀硝酸,C为无色无味气体,则B的化学式为_______ 。写出该反应的离子方式_______ 。
(3)A是2:1型的离子化合物,B是正盐,D既可溶于盐酸又可溶于NaOH溶液,且A与B以物质的量之比为3:1恰好完全反应,推知B的化学式为_______ ;写出该反应的化学方程式:_______ 。
(4)若A是一个1:2型的离子化合物,A与B的溶液反应时只生成C、D和水;C的燃烧热为QkJ/mol,其燃烧产物通过装有碱石灰干燥管或浓硫酸的洗气瓶,两者质量都增重,则A的电子式_______ ;C燃烧的热化学方程式为_______ 。

(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式为
(2)若A和B都是盐,A难溶于水而B易溶于水,D不溶于稀硝酸,C为无色无味气体,则B的化学式为
(3)A是2:1型的离子化合物,B是正盐,D既可溶于盐酸又可溶于NaOH溶液,且A与B以物质的量之比为3:1恰好完全反应,推知B的化学式为
(4)若A是一个1:2型的离子化合物,A与B的溶液反应时只生成C、D和水;C的燃烧热为QkJ/mol,其燃烧产物通过装有碱石灰干燥管或浓硫酸的洗气瓶,两者质量都增重,则A的电子式
您最近一年使用:0次



