1 . 废旧锌锰电池中的黑锰粉中含有 、
、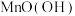 、
、 和少量:
和少量: 、
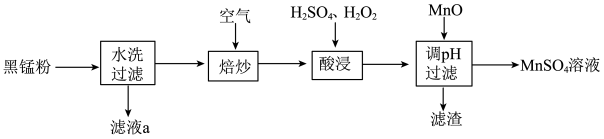
、 及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备
及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备 。
。______ 。
(2)“焙炒”的目的是除炭黑、氧化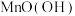 得到
得到 。空气中
。空气中 氧化
氧化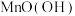 的化学方程式为
的化学方程式为____________ 。
(3)“酸浸”过程中 的作用是
的作用是____________ ,“酸浸”时加入试剂的顺序是______ 。
(4)滤渣的主要成分是______ 。
(5) 可通过反应制得
可通过反应制得 ,在加热烘干
,在加热烘干 过程中常常混有
过程中常常混有 杂质,现对样品中
杂质,现对样品中 的含量进行测定。取
的含量进行测定。取 样品21.48 g,加入足量浓盐酸并加热(
样品21.48 g,加入足量浓盐酸并加热( 和
和 在加热时均能和浓盐酸反应生成
在加热时均能和浓盐酸反应生成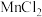 ),得到标准状况下2.24 L氯气。计算得样品中
),得到标准状况下2.24 L氯气。计算得样品中 的质量分数为
的质量分数为______ 。(写出计算过程,结果保留四位有效数字)
 、
、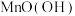 、
、 和少量:
和少量: 、
、 及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备
及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备 。
。
(2)“焙炒”的目的是除炭黑、氧化
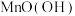 得到
得到 。空气中
。空气中 氧化
氧化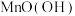 的化学方程式为
的化学方程式为(3)“酸浸”过程中
 的作用是
的作用是(4)滤渣的主要成分是
(5)
 可通过反应制得
可通过反应制得 ,在加热烘干
,在加热烘干 过程中常常混有
过程中常常混有 杂质,现对样品中
杂质,现对样品中 的含量进行测定。取
的含量进行测定。取 样品21.48 g,加入足量浓盐酸并加热(
样品21.48 g,加入足量浓盐酸并加热( 和
和 在加热时均能和浓盐酸反应生成
在加热时均能和浓盐酸反应生成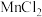 ),得到标准状况下2.24 L氯气。计算得样品中
),得到标准状况下2.24 L氯气。计算得样品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
2 . FeOOH在生产生活中有广泛应用。
I.用硫酸渣(主要成分为 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。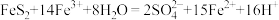 ;
; 、
、 均与
均与 不反应。
不反应。
(1)基态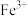 价层电子排布式为
价层电子排布式为___________ 。
(2)“还原”时还原产物与氧化产物的物质的量之比为___________ 。
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为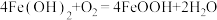 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:___________ 。
II. 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(4)在80℃下,向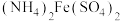 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备1mol 理论上需要
理论上需要 的物质的量为
的物质的量为___________ mol;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验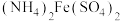 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(5) 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。 分子中的共价键的物质的量为
分子中的共价键的物质的量为___________ mol。
②写出反应II的化学方程式:___________ 。
I.用硫酸渣(主要成分为
 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。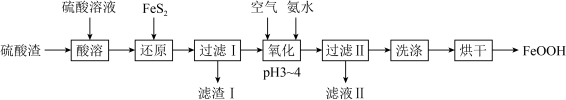
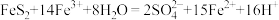 ;
; 、
、 均与
均与 不反应。
不反应。(1)基态
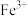 价层电子排布式为
价层电子排布式为(2)“还原”时还原产物与氧化产物的物质的量之比为
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。
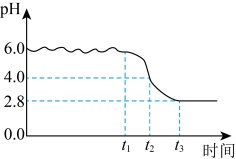
 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为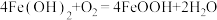 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:II.
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(4)在80℃下,向
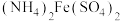 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备1mol
 理论上需要
理论上需要 的物质的量为
的物质的量为 低于理论用量的原因是
低于理论用量的原因是②为检验
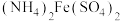 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(5)
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。
 分子中的共价键的物质的量为
分子中的共价键的物质的量为②写出反应II的化学方程式:
您最近一年使用:0次
7日内更新
|
41次组卷
|
2卷引用:江苏省南通市海安高级中学2023-2024学年高一下学期期中考试化学试题
名校
3 . 近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的 、
、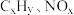 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。___________ ,X的化学式为___________ 。
②钡元素在周期表中的位置是___________ 。
(2)SCR技术可使 与
与 直接反应,实现无害转化。当
直接反应,实现无害转化。当 与
与 的物质的最之比为2:1时,写出发生反应的化学方程式:
的物质的最之比为2:1时,写出发生反应的化学方程式:___________ 。
(3)利用 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: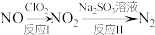 反应I的化学方程式是
反应I的化学方程式是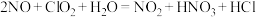 ,反应II的离子方程式是
,反应II的离子方程式是_______________ 。
(4)加入过量次氯酸钠可使废水中 完全转化为
完全转化为 ,而本身被还原为
,而本身被还原为 。检验废水中是否存在
。检验废水中是否存在 的方法是
的方法是___________ 。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的
 、
、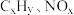 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。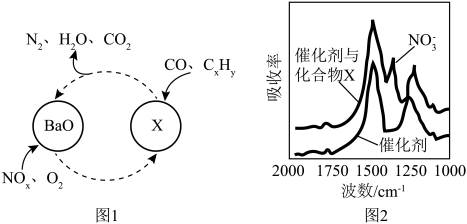
②钡元素在周期表中的位置是
(2)SCR技术可使
 与
与 直接反应,实现无害转化。当
直接反应,实现无害转化。当 与
与 的物质的最之比为2:1时,写出发生反应的化学方程式:
的物质的最之比为2:1时,写出发生反应的化学方程式:(3)利用
 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: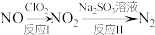 反应I的化学方程式是
反应I的化学方程式是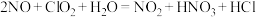 ,反应II的离子方程式是
,反应II的离子方程式是(4)加入过量次氯酸钠可使废水中
 完全转化为
完全转化为 ,而本身被还原为
,而本身被还原为 。检验废水中是否存在
。检验废水中是否存在 的方法是
的方法是
您最近一年使用:0次
名校
4 . 以铝土矿(主要成分为 ,含
,含 和
和 等杂质)为原料制备铝的一种工艺流程如下:
等杂质)为原料制备铝的一种工艺流程如下: 在“碱溶”时转化为铝硅酸钠沉淀
在“碱溶”时转化为铝硅酸钠沉淀
②电解时,阳极发生氧化反应
下列说法正确的是
 ,含
,含 和
和 等杂质)为原料制备铝的一种工艺流程如下:
等杂质)为原料制备铝的一种工艺流程如下: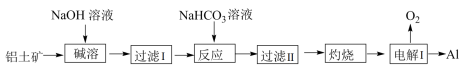
 在“碱溶”时转化为铝硅酸钠沉淀
在“碱溶”时转化为铝硅酸钠沉淀②电解时,阳极发生氧化反应
下列说法正确的是
A.“碱溶”时生成偏铝酸钠的离子方程式为 |
B.“过滤Ⅰ”的滤渣成分为 |
C.“反应”中加入 溶液的作用同于通入 溶液的作用同于通入 |
| D.“电解Ⅰ”中作阳极的石墨易消枆,阳极反应中失电子物质主要是石墨 |
您最近一年使用:0次
名校
5 . 电池在人们的生产生活中起着重要的作用,请回答下列问题:
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为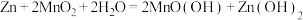 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为:___________ 。___________ ;
②写出a电极上发生的电极反应___________ 。
(3)钴酸锂电池的正极采用钴酸锂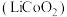 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: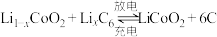 ,写出放电时负极的电极反应
,写出放电时负极的电极反应___________ 。
(4)利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
①烧渣是LiCl、 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为___________ ;
②“滤饼2”的主要成分是___________ ,常温下, 的溶解度比LiOH
的溶解度比LiOH___________ (填“大”或“小”);
③“850℃煅烧”时的化学方程式为:___________ ;
④在实验室检查滤饼2是否洗涤干净的具体操作是:___________ 。
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为
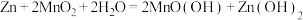 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为: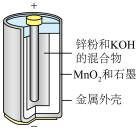
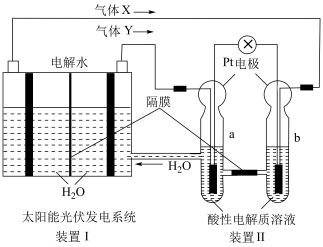
②写出a电极上发生的电极反应
(3)钴酸锂电池的正极采用钴酸锂
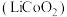 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: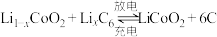 ,写出放电时负极的电极反应
,写出放电时负极的电极反应(4)利用
 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: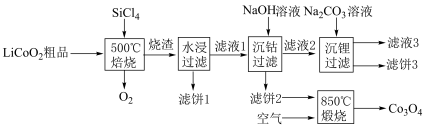
①烧渣是LiCl、
 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为②“滤饼2”的主要成分是
 的溶解度比LiOH
的溶解度比LiOH③“850℃煅烧”时的化学方程式为:
④在实验室检查滤饼2是否洗涤干净的具体操作是:
您最近一年使用:0次
名校
解题方法
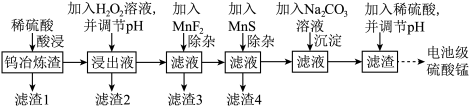
6 . 钨在自然界的储量只有620万吨,江西独占有520万吨。江西每年产生大量的钨冶炼渣(主要含SiO2、MnO2、Al2O3、CaO、MgO、FeO、Fe2O3以及少量重金属氧化物等),以钨冶炼渣为原料,提炼制备电池级硫酸锰的工艺流程如下: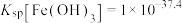 ,
,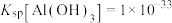 。
。
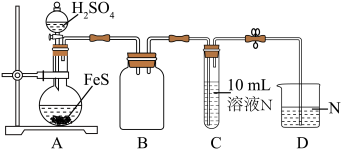
(1)“酸浸”时,为提高锰的浸出率,可采取的措施是_______ (写一种即可),滤渣1的主要成分为SiO2、_______ (填化学式)。
(2)酸浸后所得浸出液中金属阳离子包括Mn2+,写出生成Mn2+的离子方程式_______ 。
(3)若要使 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为_______ 。
(4)滤渣3的主要成分是CaF2和_______ 。
(5)加MnS的目的是_______ 。
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为_______ , _______ ,洗涤,干燥,碾磨,即得到了电池级硫酸锰。
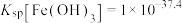 ,
,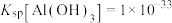 。
。(1)“酸浸”时,为提高锰的浸出率,可采取的措施是
(2)酸浸后所得浸出液中金属阳离子包括Mn2+,写出生成Mn2+的离子方程式
(3)若要使
 和
和 沉淀完全,则需调节溶液的pH最小值为
沉淀完全,则需调节溶液的pH最小值为(4)滤渣3的主要成分是CaF2和
(5)加MnS的目的是
(6)如图为MnSO4溶解度曲线。从MnSO4溶液中提取MnSO4晶体的操作为

您最近一年使用:0次
解题方法
7 .  的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),
(1)装置A中发生的化学反应方程式是_______ 。
(2)加入药品前,检验装置气密性,方法是_______ 。
(3)装置B的作用是_______ 。
(4)实验Ⅲ中生成黑色沉淀的离子方程式是_______ 。
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
① 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离_______ 。
②完善下列离子方程式:_______ 。
_______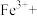 _______
_______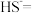 _______
_______ _______
_______ _______。
_______。
结论:实验Ⅱ的pH比实验Ⅰ的小, 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。
(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是_______ 。
(7)实验Ⅰ充分反应后,测 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为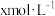 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中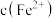 还需要的实验数据:
还需要的实验数据:___ 。
 的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),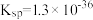
| 序号 | 溶液N | C中实验现象 |
| Ⅰ | 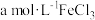 溶液( 溶液(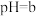 ) ) | 溶液颜色变浅,有乳白色沉淀生成 |
| Ⅱ | 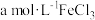 溶液(含少量稀 溶液(含少量稀 , ,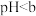 ) ) | 溶液颜色变浅,有乳白色沉淀生成,沉淀比实验Ⅰ少 |
| Ⅲ | 一定浓度的 溶液 溶液 | 溶液颜色变浅,有黑色沉淀生成 |
| Ⅳ | 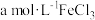 (含有一定浓度的 (含有一定浓度的 溶液, 溶液,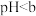 ) ) | 溶液颜色变浅,先有黑色沉淀生成,一段时间后转化为乳白色,沉淀比实验Ⅰ多 |
(1)装置A中发生的化学反应方程式是
(2)加入药品前,检验装置气密性,方法是
(3)装置B的作用是
(4)实验Ⅲ中生成黑色沉淀的离子方程式是
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
①
 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离②完善下列离子方程式:
_______
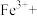 _______
_______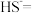 _______
_______ _______
_______ _______。
_______。结论:实验Ⅱ的pH比实验Ⅰ的小,
 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是
(7)实验Ⅰ充分反应后,测
 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为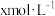 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中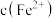 还需要的实验数据:
还需要的实验数据:
您最近一年使用:0次
名校
8 .  (亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。
(亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。
(1)用石灰乳吸收硝酸工业尾气中 、
、 ,既能获得
,既能获得 ,亦能净化尾气。
,亦能净化尾气。
① 和
和 与石灰乳生成
与石灰乳生成 的化学方程式为
的化学方程式为_______ 。
②下列措施能提高尾气中 和
和 去除率的有
去除率的有_______ (填字母)
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量石灰乳
③吸收后经处理得到 晶体,该晶体的主要杂质是
晶体,该晶体的主要杂质是_______ (填化学式);吸收后排放的尾气含量较高的氮氧化物是_______ (填化学式)。
(2)实验室可用反应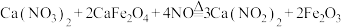 制备
制备 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为_______ 。对于 硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系:
硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系: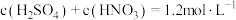 ,则理论上最多能溶解的铜的物质的量为
,则理论上最多能溶解的铜的物质的量为_______  .
.
 (亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。
(亚硝酸钙)广泛应用于钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。(1)用石灰乳吸收硝酸工业尾气中
 、
、 ,既能获得
,既能获得 ,亦能净化尾气。
,亦能净化尾气。①
 和
和 与石灰乳生成
与石灰乳生成 的化学方程式为
的化学方程式为②下列措施能提高尾气中
 和
和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量石灰乳
③吸收后经处理得到
 晶体,该晶体的主要杂质是
晶体,该晶体的主要杂质是(2)实验室可用反应
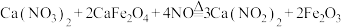 制备
制备 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为 硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系:
硫酸和硝酸的混合溶液,若硫酸和硝酸的物质的量浓度存在如下关系: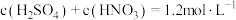 ,则理论上最多能溶解的铜的物质的量为
,则理论上最多能溶解的铜的物质的量为 .
.
您最近一年使用:0次
名校
解题方法
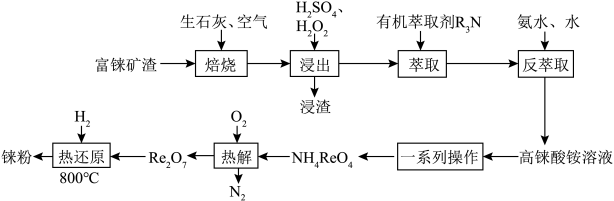
9 . 铼是一种稀有贵重金属,广泛用于制造飞机、卫星和火箭的外壳等。工业上一种利用富铼矿渣(主要成分ReS2)提取铼的工艺流程如图所示:
②Re2O7是酸性氧化物,HReO4的性质与HClO4的性质相似;高铼酸铵(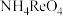 )微溶于冷水,易溶于热水;
)微溶于冷水,易溶于热水;
③室温下, 。
。
回答下列问题:
(1)Re2O7与水反应的离子方程式为___________ ;室温下,加入氨水后,测得溶液pH约为11,则溶液中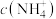
___________ (填“>”“<”或“=”)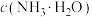 。
。
(2)“焙烧”时,空气从焙烧炉底部通入,粉碎后的矿渣从顶部加入,目的是___________ 。
(3)写出“热解”时发生反应的主要化学方程式:___________ 。
(4)测得制得的铼粉(含少量Re2O7)中Re与O的原子个数比为1∶0.35,则该产品的纯度为___________ %(保留三位有效数字)。
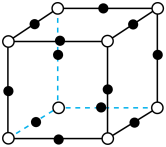
(5)已知ReO3的立方晶胞结构如图所示,则Re在晶胞中的位置为___________ ;晶体中一个Re周围与其最近的O的个数为___________ 。
②Re2O7是酸性氧化物,HReO4的性质与HClO4的性质相似;高铼酸铵(
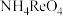 )微溶于冷水,易溶于热水;
)微溶于冷水,易溶于热水;③室温下,
 。
。回答下列问题:
(1)Re2O7与水反应的离子方程式为
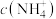
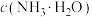 。
。(2)“焙烧”时,空气从焙烧炉底部通入,粉碎后的矿渣从顶部加入,目的是
(3)写出“热解”时发生反应的主要化学方程式:
(4)测得制得的铼粉(含少量Re2O7)中Re与O的原子个数比为1∶0.35,则该产品的纯度为
(5)已知ReO3的立方晶胞结构如图所示,则Re在晶胞中的位置为
您最近一年使用:0次
名校
10 . 下列过程中的化学反应,相应的离子方程式正确的是
A.用淀粉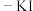 溶液和醋酸检验加碘盐中的 溶液和醋酸检验加碘盐中的 : :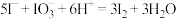 |
B. 溶液中通入少量 溶液中通入少量 : :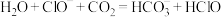 |
C.氯化亚铁溶液中加入酸性的 溶液: 溶液: |
D. 固体与氢碘酸反应: 固体与氢碘酸反应: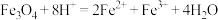 |
您最近一年使用:0次
2024-06-11更新
|
363次组卷
|
2卷引用:重庆市荣昌仁义中学校2024届高三下学期模拟预测化学试题1



