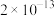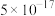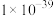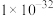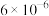名校
1 . 以高硫铝土矿(主要成分为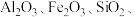 少量
少量 )为原料,生产
)为原料,生产 的部分工艺流程如下:
的部分工艺流程如下: 是一种难溶于水的酸性氧化物,
是一种难溶于水的酸性氧化物, 酸性比碳酸弱,难溶于水。下列说法
酸性比碳酸弱,难溶于水。下列说法不正确 的是
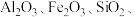 少量
少量 )为原料,生产
)为原料,生产 的部分工艺流程如下:
的部分工艺流程如下: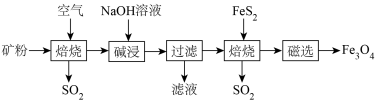
 是一种难溶于水的酸性氧化物,
是一种难溶于水的酸性氧化物, 酸性比碳酸弱,难溶于水。下列说法
酸性比碳酸弱,难溶于水。下列说法| A.高硫铝土矿加工成粉状,可以加快焙烧速率,又能提高原料利用率 |
B.碱浸过程 发生的反应: 发生的反应: |
C.向过滤后得到的滤液中通入过量 ,得到的沉淀为 ,得到的沉淀为 |
D.若由 与 与 在无氧条件下焙烧制得 在无氧条件下焙烧制得 ,则两者物质的量之比为 ,则两者物质的量之比为 |
您最近一年使用:0次
2023-06-27更新
|
606次组卷
|
3卷引用:江苏省连云港市2022-2023学年高一下学期6月期末考试化学试题
江苏省连云港市2022-2023学年高一下学期6月期末考试化学试题江西省赣州市全南中学2023-2024学年高二上学期开学考试化学试题(已下线)重难点05 铁及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)
2 . 以废锰渣(含MnO2及少量KOH、MgO、Fe2O3)为原料制备MnSO4晶体,其工艺流程可表示为:_____ 。
(2)“酸浸”时为提高锰离子的浸出率,可采取的措施有_____ 。
(3)“反应I”中加入硫铁矿(主要成分FeS2)与MnO2反应生成Mn2+与Fe3+,滤渣1的主要成分为FeS2和S,写出该反应的离子方程式_____ 。
(4)已知:Ksp[Fe(OH)3]=1×10-38。“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为_____ ;滤渣2除MnO2、CaCO3外主要成分是_____ (填化学式)。
(5)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO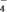 ,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)
,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)_____ 。
[已知: +
+ →CO2↑+Mn2+(未配平)]
→CO2↑+Mn2+(未配平)]
(2)“酸浸”时为提高锰离子的浸出率,可采取的措施有
(3)“反应I”中加入硫铁矿(主要成分FeS2)与MnO2反应生成Mn2+与Fe3+,滤渣1的主要成分为FeS2和S,写出该反应的离子方程式
(4)已知:Ksp[Fe(OH)3]=1×10-38。“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为
(5)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO
 ,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)
,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)[已知:
 +
+ →CO2↑+Mn2+(未配平)]
→CO2↑+Mn2+(未配平)]
您最近一年使用:0次
名校
解题方法
3 . 党的二十大报告中着重强调了生态文明建设的重要性,在这场蓝天保卫战中,如何有效脱除NOx是当前科学家研究的重要课题。
(1)碱性KMnO4氧化法可将NOx进行脱除。
①KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整_______ 。
_______NO+_______MnO _______
_______ =______NO
=______NO 3NO
3NO 10MnO
10MnO _______
_______
②下列叙述错误的是_______ 。
A.将脱除后的混合溶液进行分离可获得氨态氮肥
B.反应后混合溶液中:[MnO ]+[MnO
]+[MnO ]=[K+]
]=[K+]
C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
D.NO 中的O-N-O键角大于NO
中的O-N-O键角大于NO 中的O-N-O键角
中的O-N-O键角
③在实验室用KMnO4(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO ,理论上需要KMnO4的质量为
,理论上需要KMnO4的质量为_______ g。
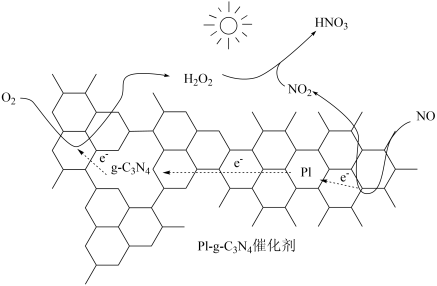
(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。_______ 。
无害化处理水体中的含氮化合物(以NH3、NO 、NO
、NO 等形式存在)也是生态文明建设的重要环节之一。
等形式存在)也是生态文明建设的重要环节之一。
(3)向该酸性废水(主要是以NH 形式存在)中加入NaClO溶液可将NH
形式存在)中加入NaClO溶液可将NH 转化成无害气体放出,发生反应的离子方程式为
转化成无害气体放出,发生反应的离子方程式为_______ ;NaClO可以通过Cl2与NaOH溶液反应制得,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(4)使用NH3时也要注意防止污染环境。电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图:_______ 极(填“正”或“负”);Pt电极(b)上的电极反应式为_______ 。
②电池总反应的化学反应方程式为_______ ,反应一段时间后,KOH溶液的浓度将_______ (填“增大”“减小”或“不变”)。
(1)碱性KMnO4氧化法可将NOx进行脱除。
①KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整
_______NO+_______MnO
 _______
_______ =______NO
=______NO 3NO
3NO 10MnO
10MnO _______
_______
②下列叙述错误的是
A.将脱除后的混合溶液进行分离可获得氨态氮肥
B.反应后混合溶液中:[MnO
 ]+[MnO
]+[MnO ]=[K+]
]=[K+]C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
D.NO
 中的O-N-O键角大于NO
中的O-N-O键角大于NO 中的O-N-O键角
中的O-N-O键角③在实验室用KMnO4(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO
 ,理论上需要KMnO4的质量为
,理论上需要KMnO4的质量为(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。
无害化处理水体中的含氮化合物(以NH3、NO
 、NO
、NO 等形式存在)也是生态文明建设的重要环节之一。
等形式存在)也是生态文明建设的重要环节之一。(3)向该酸性废水(主要是以NH
 形式存在)中加入NaClO溶液可将NH
形式存在)中加入NaClO溶液可将NH 转化成无害气体放出,发生反应的离子方程式为
转化成无害气体放出,发生反应的离子方程式为(4)使用NH3时也要注意防止污染环境。电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图:
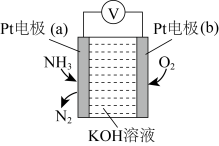
②电池总反应的化学反应方程式为
您最近一年使用:0次
4 . 以废钒电池负极电解液(主要化学成分是V3+、V2+、H2SO4) 为原料,回收其中的钒制备V2O5的工艺流程如图所示:
回答下列问题:
(1)在“氧化”中低价态钒都转化为 ,其中V3+转化反应的离子方程式为
,其中V3+转化反应的离子方程式为___________ ,实际生产中的氧化剂不选择HClO3的原因是___________ 。
(2)“浓缩”至钒溶液质量浓度(折合V2O5质量浓度)为27.3 g·L-1'时,则溶液中c( )=
)=___________ mol·L-1。(结果保留1位小数)
(3)pH对沉钒率(η)的影响如图所示,则沉钒时控制钒液合适的pH范围是___________ ,沉淀产物为2NH4V3O8·H2O,则加(NH4)2SO4沉钒的化学方程式是___________ 。___________ 。检验沉淀已洗涤干净的操作是___________ 。
(5)“煅烧”需要在通风或氧化气氛下进行,其目的是___________ 。
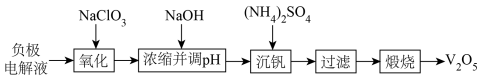
回答下列问题:
(1)在“氧化”中低价态钒都转化为
 ,其中V3+转化反应的离子方程式为
,其中V3+转化反应的离子方程式为(2)“浓缩”至钒溶液质量浓度(折合V2O5质量浓度)为27.3 g·L-1'时,则溶液中c(
 )=
)=(3)pH对沉钒率(η)的影响如图所示,则沉钒时控制钒液合适的pH范围是
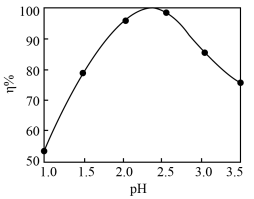
(5)“煅烧”需要在通风或氧化气氛下进行,其目的是
您最近一年使用:0次
5 . 用废锰渣(主要成分为MnO2、MgO和Fe2O3)和硫铁矿(主要成分FeS2)制取MnSO4·H2O的工艺流程如下:___________ 。
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Mn(OH)2]=2×10-13,“氧化”后溶液中c(Mn2+)=0.2mol·L-1。
①欲使溶液中c(Fe3+)<10-5mol·L-1,“除铁”过程需控制溶液pH的范围是___________ 。
②写出“除铁”过程中生成Fe(OH)3反应的化学方程式:___________ 。
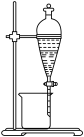
(3)氧化后溶液的Fe3+还可用P204(一种有机萃取剂,密度比水小)萃取除去,实验装置如图所示,从图示装置中得到Mn2+水溶液的实验操作方法是___________ 。 ,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数
,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数___________ 。(写出详细计算过程)。
C2O 发生的反应为
发生的反应为 (未配平)。
(未配平)。
②若实验测定MnSO4·H2O样品的纯度大于100%,可能的原因是___________ (忽略操作过程中的误差)。
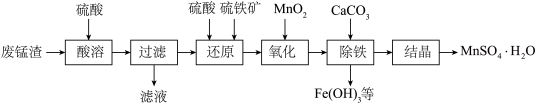
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Mn(OH)2]=2×10-13,“氧化”后溶液中c(Mn2+)=0.2mol·L-1。
①欲使溶液中c(Fe3+)<10-5mol·L-1,“除铁”过程需控制溶液pH的范围是
②写出“除铁”过程中生成Fe(OH)3反应的化学方程式:
(3)氧化后溶液的Fe3+还可用P204(一种有机萃取剂,密度比水小)萃取除去,实验装置如图所示,从图示装置中得到Mn2+水溶液的实验操作方法是
 ,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数
,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数C2O
 发生的反应为
发生的反应为 (未配平)。
(未配平)。②若实验测定MnSO4·H2O样品的纯度大于100%,可能的原因是
您最近一年使用:0次
2023-06-05更新
|
431次组卷
|
3卷引用:江苏省扬州中学2023届高三下学期考前练习化学试题
解题方法
6 . 电解金属锰阳极渣(主要成分MnO2,杂质为PbCO3、Fe2O3、CuO)和黄铁矿(FeS2)为原料可制备Mn3O4,其流程如图所示:
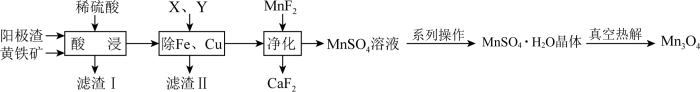
已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:Fe3+ 3.7,Fe2+ 9.7,Cu2+ 7.4,Mn2+ 9.8
回答下列问题:
(1)“酸浸”过程中,滤渣Ⅰ的主要成分为S、______ (填化学式)。
(2)“酸浸”过程中Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图1所示。
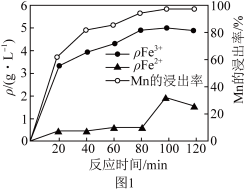
20~80min,浸出Mn元素的主要离子方程式为______ 。80~100min时,Fe2+浓度上升的原因可能是______ 。
(3)“除Fe、Cu”过程中依次加入的试剂X、Y为______ (填序号)。
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
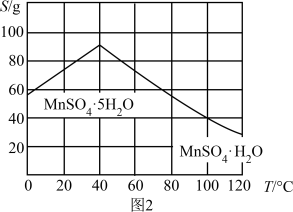
(4)硫酸锰晶体的溶解度曲线如图2,由MnSO4溶液获得MnSO4•H2O晶体的系列操作为______ 、洗涤、干燥。
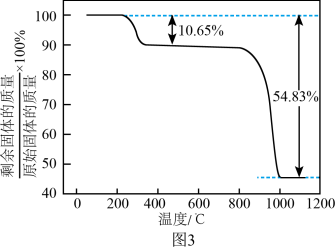
(5)“真空热解”过程中,测得固体的质量随温度变化如图3所示。需控制的温度为______ 。
(6)由MnSO4溶液制取Mn3O4的另一种方案是:向MnSO4溶液中加入氨水,产生Mn(OH)2沉淀和少量Mn2(OH)2SO4,滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。沉淀加热通空气过程中,7小时之前,溶液的pH=6,7小时之后迅速下降,原因是______ 。

已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:Fe3+ 3.7,Fe2+ 9.7,Cu2+ 7.4,Mn2+ 9.8
回答下列问题:
(1)“酸浸”过程中,滤渣Ⅰ的主要成分为S、
(2)“酸浸”过程中Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图1所示。

20~80min,浸出Mn元素的主要离子方程式为
(3)“除Fe、Cu”过程中依次加入的试剂X、Y为
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
(4)硫酸锰晶体的溶解度曲线如图2,由MnSO4溶液获得MnSO4•H2O晶体的系列操作为

(5)“真空热解”过程中,测得固体的质量随温度变化如图3所示。需控制的温度为

(6)由MnSO4溶液制取Mn3O4的另一种方案是:向MnSO4溶液中加入氨水,产生Mn(OH)2沉淀和少量Mn2(OH)2SO4,滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。沉淀加热通空气过程中,7小时之前,溶液的pH=6,7小时之后迅速下降,原因是
您最近一年使用:0次
2023-04-27更新
|
876次组卷
|
2卷引用:山东省泰安市2023届高三下学期二模考试化学试题
名校
解题方法
7 . 向仅含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法错误的是
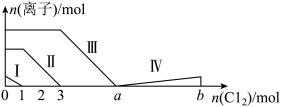
| A.线段Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表I-、Fe2+、Br-、HIO3的变化情况 |
| B.Fe2+、I-和Br-的物质的量之比为1∶2∶3 |
| C.根据图像可计算b=11 |
| D.线段Ⅳ对应的反应中氧化剂和还原剂的物质的量之比是5∶1 |
您最近一年使用:0次
2023-08-14更新
|
508次组卷
|
4卷引用:河北省迁安市第一中学2022-2023学年高三上学期期中考试化学试题
河北省迁安市第一中学2022-2023学年高三上学期期中考试化学试题浙江省宁波市鄞州中学(宁波鄞州蓝青高级中学)2023-2024学年高一上学期12月月考化学学科试题 山东省日照市五莲县第一中学2024届高三上学期阶段性测试化学试题(已下线)第04讲 氧化还原反应的基本概念和规律(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
8 . 下列反应的离子方程式书写正确的是
A. 溶液中加入过量醋酸溶液: 溶液中加入过量醋酸溶液: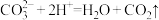 |
B. 溶液中通入过量 溶液中通入过量 : :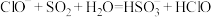 |
C. 溶液中加入 溶液中加入 溶液: 溶液: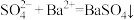 |
D.酸性高锰酸钾溶液中滴加KI溶液: |
您最近一年使用:0次
2023-02-10更新
|
987次组卷
|
2卷引用:山东省潍坊市2022-2023学年高一上学期期末考试化学试题
名校
9 . 以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
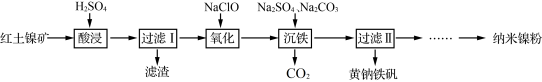
已知:
①Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2;
②SiO2为不溶于水的酸性氧化物,常温下和硫酸不反应,但可以溶于强碱溶液。
下列说法不正确的是

已知:
①Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2;
②SiO2为不溶于水的酸性氧化物,常温下和硫酸不反应,但可以溶于强碱溶液。
下列说法不正确的是
| A.“滤渣”的主要成分是SiO2 |
| B.为提高“酸浸”速率,可将稀硫酸更换为浓硫酸 |
| C.“氧化”过程发生的离子方程式为:2H++2Fe2++ClO-=2Fe3++Cl-+H2O |
| D.“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9 |
您最近一年使用:0次
2023-01-14更新
|
374次组卷
|
2卷引用:山东师范大学附属中学 2022-2023 学年高一上学期学科水平自我诊断化学试题
解题方法
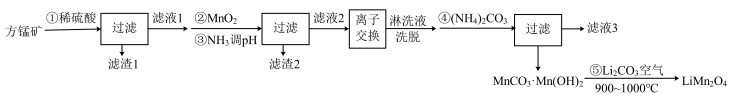
10 . 锰酸锂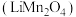 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
,还含有少量的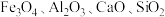 )为原料制备锰酸锂的流程如下:
)为原料制备锰酸锂的流程如下:
已知:I. 时,相关物质的
时,相关物质的 如下表:
如下表:
II. 时,
时, 电离常数
电离常数
III.离子浓度低于 时即为沉淀完全
时即为沉淀完全
回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质 反应的离子方程式
反应的离子方程式___________ 。
(2)滤渣1的成分是_____ (填化学式);步骤②加入 的目的是
的目的是____ 。
(3)步骤③加入 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为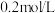 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为_______ 。反应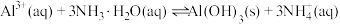 的平衡常数
的平衡常数
________ 。
(4)“离子交换”步骤和“洗脱”过程是利用反应: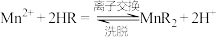 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用_____ 。
(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有___________ (填化学式)。
(6)步骤⑤反应的化学方程式为___________ 。
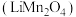 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
,还含有少量的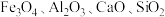 )为原料制备锰酸锂的流程如下:
)为原料制备锰酸锂的流程如下:
已知:I.
 时,相关物质的
时,相关物质的 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
|
|
 时,
时, 电离常数
电离常数
III.离子浓度低于
 时即为沉淀完全
时即为沉淀完全回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质
 反应的离子方程式
反应的离子方程式(2)滤渣1的成分是
 的目的是
的目的是(3)步骤③加入
 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为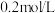 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为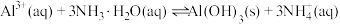 的平衡常数
的平衡常数
(4)“离子交换”步骤和“洗脱”过程是利用反应:
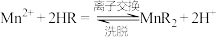 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有
(6)步骤⑤反应的化学方程式为
您最近一年使用:0次
2023-01-13更新
|
1140次组卷
|
2卷引用:四川省绵阳市2023届高三第二次诊断性考试理科综合化学试题